外周血NLR、PLR 和LDH 在结直肠癌中的临床应用价值*
2022-05-09孙长江曹桂莲钱飞丁伟峰
孙长江,曹桂莲,钱飞,丁伟峰***
(1 南通大学公共卫生学院,南通 226019;南通大学附属医院2 医学检验科,3 胃肠外科)
结直肠癌(colorectal cancer,CRC)是居恶性肿瘤第3 位的消化道肿瘤[1]。目前,CRC 的辅助诊断标志物糖类抗原199(carbohydrate antigen199,CA199)、癌胚抗原(carcinoembryonic antigen,CEA)等[2]灵敏性和特异性不高,特别是CRC 早期;且这些基于免疫学方法的肿瘤标志物检测价格偏高,因此,迫切需要寻找性价比更高的辅助诊断标志物。CRC 复发和远处转移是影响预后的主要因素,而复发与转移很难早期发现,故研究CRC 预后的有效判断指标极具临床应用价值[3]。研究[4]表明,炎症特别是慢性炎症在CRC 等实体瘤的炎症-癌症进程及CRC 转移过程中发挥关键作用。恶性肿瘤患者持续性的炎症反应性改变常伴有外周血中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板淋巴细胞比值(platelet to lymphocyte ratio,PLR)、血小板计数(platelet,PLT)和乳酸脱氢酶(lactic dehydrogenase,LDH)的异常变化,可实时反映肿瘤的发生发展与转移过程中的病理变化[5],可用于肿瘤的诊断与预后评估。基于此,本研究拟通过研究CRC 患者NLR、PLR 及LDH检测结果与其临床表型的关联特点,为CRC 的临床诊断和预后判断提供新的思路。
1 资料与方法
1.1 临床资料 选取2010 年7 月—2015 年12 月南通大学附属医院胃肠外科行手术治疗的2 056 例CRC 患者为对象,入组标准参照《结直肠癌诊疗规范2010 版》。CRC 患者年龄28~91 岁,平均(64.6±11.6)岁,术前均未进行化学药物治疗、放射治疗及靶向治疗的初发病例。其中男1 260 例,年龄28~89岁,平均(64.7±11.2)岁;女796 例,年龄31~91 岁,平均(63.9±12.3)岁。另选取201 例年龄、性别匹配的健康体检人群作为健康对照组,年龄25~76 岁,平均(57.6±10.8)岁,其中男124 例,年龄25~74 岁,平均(57.5±10.6)岁;女77 例,年龄27~76 岁,平均(57.4±11.5)岁。该研究方案经南通大学附属医院医学伦理委员会批准(2018-K008)。
1.2 仪器与试剂 XN-2000 全自动血细胞分析仪及配套试剂购自日本希司美康公司,Beckman Coulter AU5800 全自动生化分析仪及配套试剂购自美国贝克曼公司。
1.3 观察指标 CRC 患者于术前和术后1 周采集抗凝静脉血各2 mL,利用全自动血细胞分析仪进行中性粒细胞、淋巴细胞及PLT 计数,并计算NLR、PLR;采集非抗凝静脉血2 mL,利用生化分析仪检测血清LDH 含量,作为反映肿瘤负荷的指标。同时检测并计算健康体检人群NLR、PLR。
1.4 统计学方法 采用GraphPad Prism 8.0.1 软件进行统计分析,数据以表示,两组之间比较采用双尾Students′t 检验,多组间比较采用单因素方差分析。受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线)采用GraphPad Prism8.0.1 软件绘制。P<0.05 为差异有统计学意义。
2 结 果
2.1 术前中性粒细胞计数和NLR 在CRC 中的临床价值 健康对照组中性粒细胞数为(3.407±0.164)×109/L、NLR 为1.707±0.684,CRC 患者中性粒细胞数[(3.81±0.845)×109/L]和NLR(3.05±2.504)均显著增高(均P<0.000 1);以健康对照人群及CRC 患者的外周血NLR 绘制ROC 曲线,发现曲线下面积(area under curve,AUC)为0.71、特异性为76.29%、灵敏性为59.62%,截断值为2.26(图1)。
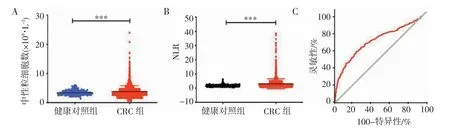
图1 中性粒细胞计数和NLR 在健康对照组及CRC 组中的表达及临床价值
2.2 术前NLR、PLR 与CRC 患者临床病理因素的相关性 结果发现NLR 的表达水平在不同肿瘤部位、分级的CRC 患者之间差异有统计学意义(均P<0.05),而在不同分期CRC 患者间差异无统计学意义(P>0.05)(表1,图2)。CRC 患者的术前NLR 与肿瘤负荷指标LDH 呈正相关(P=0.000 2,r=0.160 1)(图2)。

图2 术前NLR 与CRC 分级、LDH 的相关性
表1 术前外周血NLR、PLR 与CRC 患者临床病理因素的相关性(n=2 056,)
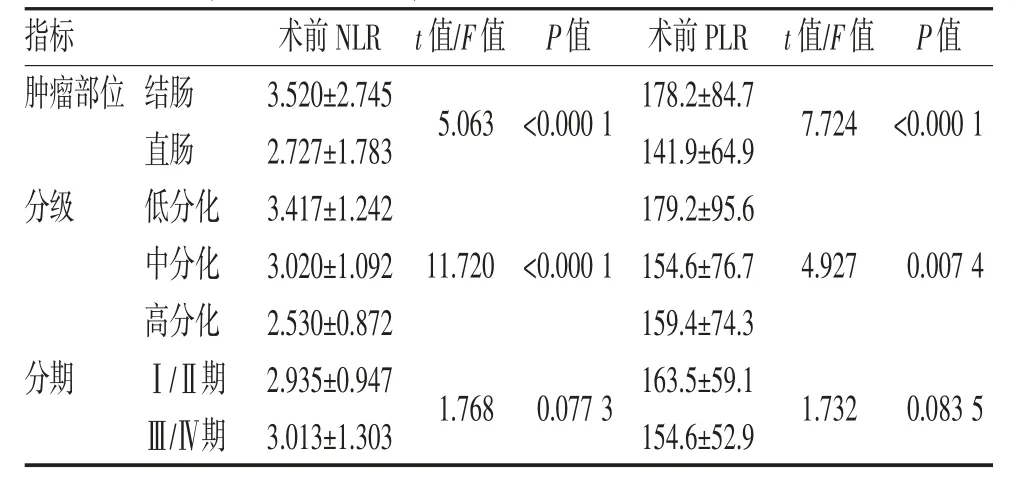
表1 术前外周血NLR、PLR 与CRC 患者临床病理因素的相关性(n=2 056,)
CRC 组患者的PLR(158.2±68.5)显著高于健康对照组(111.0±52.3)(图3)。术前PLR 的表达水平在不同肿瘤部位、分级的CRC 患者之间差异均有统计学意义(均P<0.05),但在Ⅰ/Ⅱ期与Ⅲ/Ⅳ期CRC 患者间差异无统计学意义(P>0.05)(表1,图3)。以健康对照人群及CRC 患者的外周血PLR 绘制ROC 曲线,发现AUC 为0.68、特异性为77.47%、灵敏性为58.56%,截断值为154.3(图3)。

图3 术前PLR 在CRC 中的临床价值
2.3 CRC 患者术前与术后1 周的PLT、PLR 和NLR比较 术后1 周PLT 显著低于术前(P<0.05),提示手术影响了患者的造血与免疫功能;而PLR、NLR 均显著高于术前(均P<0.000 1)(表2),提示术后1 周患者处于免疫与炎症状态。
表2 CRC 患者术前与术后1 周PLT、PLR 和NLR 的比较(n=2 056,)
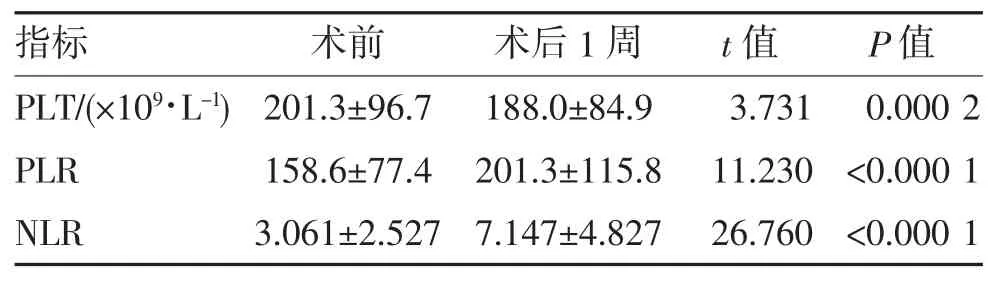
表2 CRC 患者术前与术后1 周PLT、PLR 和NLR 的比较(n=2 056,)
2.4 NLR 与PLR 联合诊断价值 单独NLR 和PLR的CRC 诊断效能均不够显著,而联合NLR 和PLR可提高诊断效能(表3)。
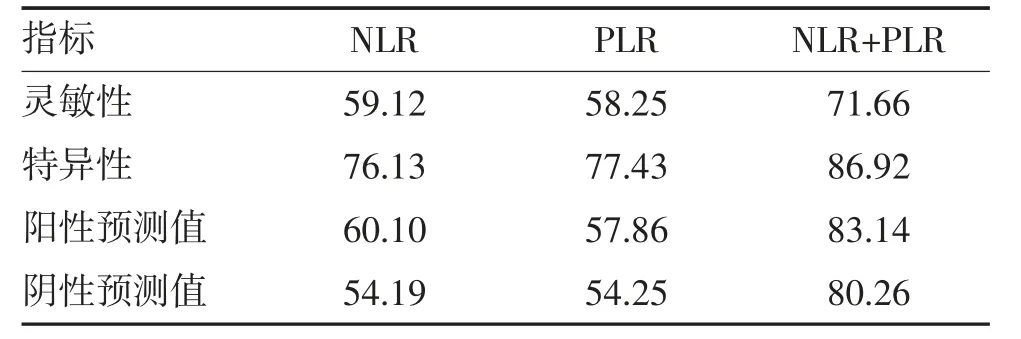
表3 单独NLR、PLR 及两种方式联合诊断的价值 %
3 讨 论
CRC 是第三大常见恶性肿瘤,且近年来其发病率和死亡率均高于世界平均水平[6]。由于肿瘤标志物出现在外周循环中的时间较临床症状早,故选择灵敏性及特异性高的诊断标志物可以提高CRC 诊断效率[7]。慢性炎症与肿瘤的发生发展密切相关,持续存在的慢性炎症可激活免疫系统,进而诱导大量的炎症细胞激活和趋化,在损伤器官组织的局部造成炎症细胞聚集,并分泌和释放各种细胞因子,参与DNA 突变诱导、抗凋亡、细胞周期调节、血管生成诱导及参与肿瘤的侵袭和转移过程[8]。
NLR 和PLR 是机体炎症系统的敏感指标,可反映炎症状态,与胰腺癌、结直肠癌等恶性肿瘤的预后显著相关[9]。目前关于反映慢性炎症的指标,如NLR的研究多集中在预测恶性肿瘤的预后方面[10]。研究[11]证实,肿瘤杀伤效应过程中淋巴细胞是最重要的细胞,在抗肿瘤免疫中发挥重要作用,淋巴细胞相对或绝对减少,可引起肿瘤的免疫逃逸而致肿瘤发生发展。中性粒细胞和PLT 较高提示较强的炎症反应,而淋巴细胞计数较低表明机体免疫反应较差[5]。同时研究[12]发现,LDH 可调节癌症的进展,促进肿瘤炎症和血管的形成,对转移性CRC 的无进展生存期有预测价值。
本研究显示,与健康对照组相比,CRC 患者外周血NLR、PLR 明显增高,进一步印证了中性粒细胞、PLT、淋巴细胞与CRC 的发生发展密切相关[9],且NLR 与CRC 患者分级呈负相关,高分化者平均NLR较低,且CRC 患者的术前NLR 与肿瘤负荷指标LDH呈正相关,提示NLR 与LDH 可用于判断CRC 患者预后。NLR 与PLR 联合检测较两者单独使用时灵敏性和特异性均显著升高。综上所述,CRC 患者外周血NLR、PLR 均显著升高,且与CRC 恶性度呈负相关,因此,检测外周血NLR、PLR 及LDH 水平对CRC 的诊断和预后评估及调整治疗方案有重要的临床价值。
