泡沫传输法制备嘧菌酯/聚乳酸微球
2022-05-07韩万青何艳萍李贵营潘孝霖
韩万青,何艳萍,李贵营,潘孝霖,王 芸
(昆明理工大学 化学工程学院,云南 昆明 650500)
0 引 言
从聚合物出发制备微球的主要制备方法有:溶剂挥发法[1-3]、喷雾干燥法[4-5]、SPG膜乳化法[6-7]、微流控技术[8]等.传统的溶剂挥发法操作简单,但是制备过程中溶剂的挥发速率较慢,生产效率低且不能实现连续化生产;喷雾干燥法虽然可以实现大规模的连续生产,但其在微球结构的调控上具有一定的局限性;SPG膜乳化技术和微流控技术虽然可以实现连续化生产,且能生产单分散性较好的微球,但是其对装置的要求较高并且生产效率相对较低.基于上述微球制备方法的特点,找到一种简单、高效、可连续化大规模生产聚合物微球的制备方法,具有十分重要的意义.
泡沫是一种气体在液体中的分散体系,在流动过程中能够携带液体油、水和固体砂石等.本实验室在前期的研究工作中,发明了一种通过泡沫传输的简单、高效、可连续化制备聚合物微球的新方法[9-11].该方法是对传统的溶剂挥发法进行技术改进而来,通过机械搅拌和升温,促使低沸点良溶剂挥发并与水相中保护胶体PVA协同作用产生大量泡沫并流出;在泡沫流出的同时,大量的油相液滴被夹带传输进入收集器中并最终固化成球.相较于传统的溶剂挥发法,泡沫传输过程中有机溶剂挥发更快,因此微球的制备效率更高;同时,由于泡沫的产生和输送可以连续化,因此该新方法可以连续化制备聚合物微球.
本文拟将实验室发明的泡沫传输法拓展到生物可降解的聚乳酸微球的制备中,并进一步制备负载嘧菌酯的聚乳酸微球.首先系统分析了泡沫夹带油滴传输的过程,然后探讨了不同的制备条件对泡沫夹带传输油滴能力的影响规律.在此基础上,使用该方法连续制备了嘧菌酯/聚乳酸微球,考察了致孔剂用量对制备的多孔嘧菌酯/聚乳酸微球的载药性能的影响以及缓释动力学.本部分工作的开展,有助于进一步提高对泡沫传输法制备聚合物微球的认识.
1 实验材料及方法
1.1 主要原料与试剂
聚乳酸(PLA,Mw ~ 80000,上海麦克林生化科技有限公司);聚乙烯醇(PVA1788,分析纯,成都市科隆化学品有限公司);嘧菌酯(Azoxystrobin,98%,上海源叶生物科技有限公司);二氯甲烷(Dichloromethane,DCM,分析纯,天津市风船化学试剂科技有限公司);正庚烷(HT,分析纯,天津市风船化学试剂科技有限公司);甲醇(MeOH,色谱级,上海麦克林生化科技有限公司);去离子水为实验室自制.
1.2 聚乳酸微球的制备
首先将称量好的PLA和DCM进行磁力搅拌混合均匀,保持油相中质量m(PLA)∶m(DCM)=1∶20,精确称取 30 g 作为油相,100 g PVA水溶液作为水相,然后将配制好的油水相加入反应器中,以5 ℃/min 的升温速率进行水浴加热.在 600 r/min 搅拌速率、1.0% PVA质量分数条件下改变油水比(10∶100、15∶100、20∶100、30∶100、40∶100).在油水比为30∶100、1.0% PVA质量分数条件下改变转速(200 r/min、400 r/min、500 r/min、600 r/min、1 000 r/min).在 600 r/min 搅拌速率、油水比为30∶100条件下改变PVA质量分数(0.2%、0.3%、0.5%、1.0%、2.0%).在反应器端口连接弯管,使泡沫可以经由弯管从反应器进入到收集器.在接收器中使用 50 ℃ 的热水并以 200 r/min 的速率进行搅拌,当水浴锅升温至泡沫不再流出则反应结束,分别将反应器和收集器内的微球滤出,去离子水冲洗3次,真空干燥后得到聚乳酸微球.
1.3 嘧菌酯/聚乳酸微球的制备
1.3.1 间歇制备
精确称取聚乳酸 2 g、DCM 40 g、嘧菌酯 0.5 g,正庚烷分别为 0 g、3 g、6 g,混合均匀后取 30 g 作为油相溶液.取1.0% PVA水溶液 100 g 作为水相,反应器中转速为 600 r/min,水浴锅升温速率为 5 ℃/min.收集器条件与1.2节相同.
1.3.2 连续化制备
在定制的连续反应装置中进行嘧菌酯/聚乳酸微球的连续化生产,如图1所示.两个储液罐分别用于储存油相和水相.将油水相输送到预乳化瓶(5)中,并在 600 r/min 下乳化,油泵(3)的流量为 9 g/min,水泵(4)的流量为 30 g/min.反应器置于恒温 45 ℃ 水浴锅中,设置耐溶剂泵(6)以 39 g/min 的流量进料.蠕动泵(12)以 40 g/min 的流量外加 50 ℃ 热水,进行快速消泡,同时保持接收器水温为 50 ℃.连续生产运行 30 min,反应结束.对收集器(14)中微球进行洗涤、过滤和真空干燥,得到干燥的嘧菌酯/聚乳酸微球.
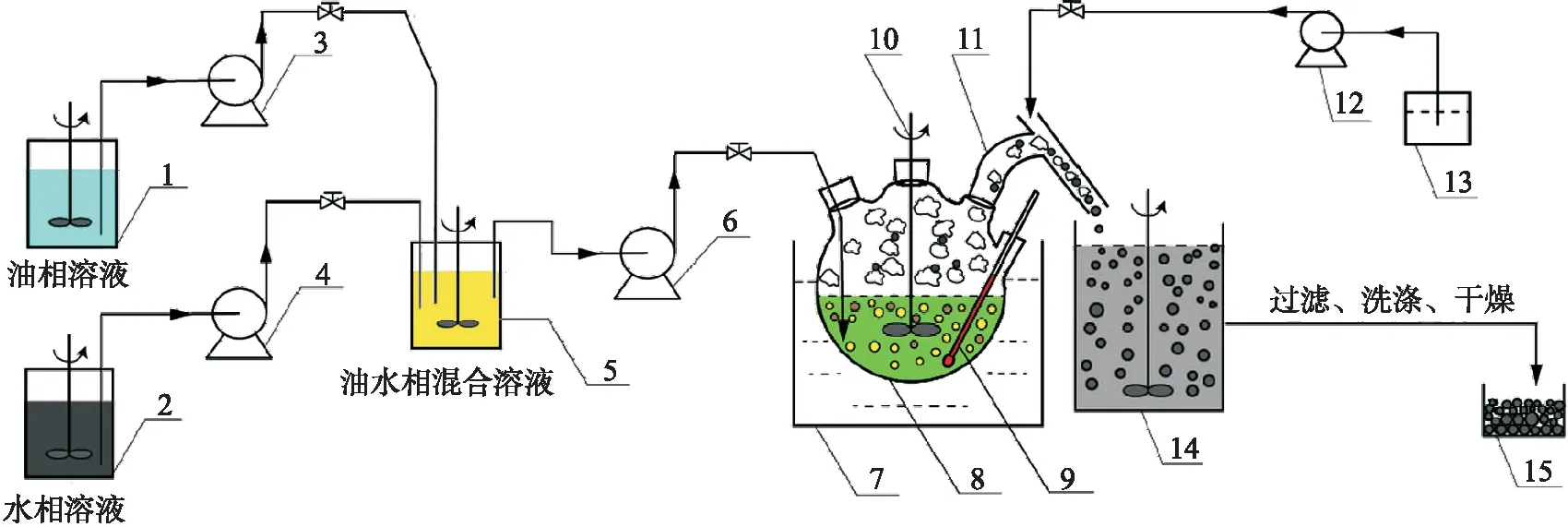
图1 连续化制备嘧菌酯/聚乳酸微球示意图Fig.1 Schematic diagram of the continuous process to prepare azoxystrobin/polylactic microspheres
1.4 分析与测试表征
1.4.1 泡沫的夹带传输能力
将反应结束后收集器中的微球进行称量,计算微球的收率:
(1)
式中:Y为收集器中微球的收率,%;m为收集器中微球的质量,g;m1、m2为加入的PLA和嘧菌酯的质量,g.
泡沫对液相的夹带传输能力与剩余液体的质量呈负相关,剩余液体质量越少,说明被泡沫夹带传输进入收集器中的液相越多,根据公式(2)计算剩余液体的质量分数:
(2)
式中:w为剩余液体的质量分数,%;m为反应器内剩余液体的质量,g;m0为反应器中加入的物质总质量,g.
1.4.2 微球的形貌观察和粒径分析
采用徕卡光学显微镜(徕卡显微系统贸易有限公司,DM4000)对制备得到的微球进行形貌观察.采用Nano measurer软件随机选取200个微球进行粒径测量,计算微球的平均粒径.
采用钨灯丝扫描电子显微镜(日本Hitachi制作所,TM3000)对微球进行观察.首先将干燥好的微球分散于粘有导电胶的载物台上,然后喷金处理60~70 s,最后将样品放入仪器中进行检测分析.
1.4.3 载药量和包封率的测定
首先精确称取 0.2 g 嘧菌酯/聚乳酸微球溶于一定量的二氯甲烷中并定容至 50 mL,然后取出 1 mL 溶液至试管中,接着加入 5 mL 甲醇后将试管置于 60 ℃ 的热水中使二氯甲烷完全挥发,将甲醇溶液定容至 10 mL,最后经 0.22 μm 滤膜过滤,使用高效液相色谱仪(美国安捷伦科技有限公司,Agilent 1200 series)采用外标法对滤液中嘧菌酯的含量进行测定.液相色谱仪选用C18色谱柱(150 mm×4.6 mm×5 μm),流动相为色谱级甲醇,流量设定为 0.8 mL/min,检测波长为 225 nm,进样量为 10 μL.微球的包封率(EE)和载药量(DL),分别按式(3)和(4)计算:
(3)
(4)
式中:mA、mB、mC分别为微球中嘧菌酯的质量、加入的嘧菌酯的质量和微球的总质量,g.
1.4.4 缓释性能分析
首先,在室温下精确称取 0.05 g 载药微球干粉,用 5 mL 去离子水分散成微球悬浮液;然后,将其放置于透析小袋(截留分子量 7 000 Da)中,将其浸入盛有 300 mL 缓释介质(含20%甲醇的去离子水)的烧杯中,同时以嘧菌酯悬浮液作为对照.在 1 h、4 h、7 h、12 h 后面每间隔 12 h 取缓释介质 3 mL,取样后立即补充 3 mL 缓释介质.用1.4.3节中高效液相色谱方法测定嘧菌酯含量,计算方式如下:

(5)
式中:Q为微球中药物累积释放率,%;m为投放微球中嘧菌酯的总质量,g;V0为缓释介质体积,mL;ρi为第i次取样时释放介质中药物的质量浓度,g/mL,其中ρ0为零;V为取样的缓释介质体积,mL;n为取样次数.
2 结果与讨论
2.1 泡沫夹带传输微球的过程分析
泡沫对微球的夹带传输可以分为两个过程,如图2所示.第一个过程(见图2a):油滴从液相被泡沫夹带进入泡沫相中;第二个过程(见图2b):泡沫夹带油滴输送至收集器中成球.

(a)泡沫夹带油滴的示意图;(b)泡沫传输制备微球现场图;(c)普来特边界示意图图2 泡沫夹带传输油相液滴过程Fig.2 Process diagram of oil phase droplet transport via form entrainment
泡沫对油相液滴的夹带传输始于反应器中的液相,在机械搅拌和加热作用下,DCM从油相中不断扩散至水相,并且挥发形成小气泡.当液相中的气泡足够多时,密集的气泡群将会夹带气泡间的油滴继续上升直至气液界面,并不断堆积形成泡沫相直至流出.其中,油相液滴从液相进入泡沫相主要依靠的是泡沫浮力产生的托举作用.在泡沫夹带油滴的过程中,随着泡沫的持续产生,越来越多含有油滴的液相被“拖拽”进入泡沫相中[12].上层的泡沫由于重力作用产生排液现象,致使许多油滴随水流下移,同时新的气泡在反应器中不断产生和上升,导致油滴的“多次夹带”现象发生.
与传统的溶剂挥发法相比,改进方法中的溶剂挥发过程较为复杂.起初,油滴中的挥发性有机溶剂直接挥发并形成泡沫,然后泡沫中夹带的油滴进一步发生溶剂挥发,最后用热水加速微球在收集器中的固化.因此,与水相相比,挥发性有机溶剂在泡沫相中的挥发阻力相对较低,泡沫夹带的油相液滴中的溶剂挥发速率比水相中的快得多,如图2c所示.
2.2 制备条件对PLA微球的影响
2.2.1 油水比
由图3a可知,油水比的改变对微球的收率、反应器中剩余液体的质量分数均具有较大的影响,而对泡沫的初始流出温度没有影响.随着油水比的增大,微球的收率由10.99%逐步提高到94.63%,反应器中剩余液体的质量分数则由55.54%逐步下降到4.21%.随着油水比的提高,反应器中的有机溶剂增多,从而在微球制备过程中产生更多的泡沫,增大了泡沫对油相液滴的夹带传输能力.
从图3b~3f可以看出,收集器中微球的形貌较好,而反应器内微球的形貌随着油水比的提高逐渐变差.这是由于油水比的提高有利于泡沫的产生,泡沫的存在有效防止了被夹带油滴之间的聚并,因此收集器中微球的形貌较好;而在反应器中,随着泡沫的不断形成,水相中的PVA分子会吸附在泡沫液膜中,造成水相中的PVA浓度减少,导致反应器中微球的球形变差.在泡沫夹带微球流出的过程中,后流出的微球的粒径越来越小,油水比的提高延长了泡沫夹带微球流出的过程,导致收集器中微球的平均粒径随着油水比的提高而降低,如图3g所示.

(a)油水比与泡沫传输能力;(b~f)油水比分别为10∶100、15∶100、20∶100、30∶100、40∶100 (S代表反应器中的微球,P代表收集器中的微球);(g)油水比与平均粒径图3 油水比对泡沫传输能力以及微球形貌粒径的影响Fig.3 The effect of oil-water ratio on the foam-transfer capacity and the morphology and particle size of microspheres
2.2.2 转速
如图4a所示,随着转速的增大,微球的收率由1.59%增加到94.07%,反应器中剩余液体的质量分数由66.61%降至9.15%,泡沫的初始流出温度由 46 ℃ 降至 29 ℃.这是由于较低转速下DCM的挥发速率较慢,造成泡沫难以快速积聚在一起形成密集的泡沫群,并且泡沫流出速率很慢,造成泡沫间重力排液现象严重,致使许多油滴随水流重新进入反应器而没有被夹带进入收集器.转速的提高使得泡沫可以稳定的形成并且积聚在一起形成泡沫流体,泡沫的夹带传输能力提高.
由图4b~4e可知,收集器中微球的形貌较好,反应器内微球的形貌随着转速的提高逐渐变差.这是由于高转速下,反应器中剩余液相中的PVA浓度伴随泡沫传输过程的进行越来越低,从而导致了油相液滴的变形,而泡沫夹带进入泡沫相的油滴,在PVA和泡沫的保护下具有较好的球形.此外,图4f研究了微球的平均粒径与转速的关系,结果表明,微球的平均粒径会随着转速的提高而降低.
2.2.3 PVA浓度
PVA的存在不仅会降低水相的表面张力,还会在一定程度上提高水相的粘度,这为泡沫的产生提供了有利的条件[13-14].如图5a所示,当ωPVA从0.2%增加到2.0%时,微球的收率由31.48%增加到90.88%,反应器中剩余液体的质量分数由30.24%降至5.03%,泡沫的初始流出温度基本不变.这是由于PVA浓度较低时,制备过程中泡沫产生较少,因此泡沫的夹带传输能力较弱.由图5b~5f可知,当PVA浓度≤0.5%时,制备出的微球互相粘连、团聚,球形较差.提高水相中PVA浓度,接收器和反应器中的微球的球形都得到了改善.图5g反映了随着PVA浓度的提高,制备出的微球的平均粒径逐渐缩小.

(a)转速与泡沫传输能力;(b~e)转速分别为400 r/min、500 r/min、600 r/min、1 000 r/min (S代表反应器中的微球,P代表收集器中的微球);(f)转速与平均粒径图4 转速对泡沫传输能力以及微球形貌粒径的影响Fig.4 The effect of stirring rate on the foam-transfer capacity and the morphology and particle size of microspheres

(a)PVA浓度与泡沫传输能力的关系图;(b~f)PVA浓度分别为0.2%、0.3%、0.5%、1.0%、2.0% (S代表反应器中的微球,P代表收集器中的微球);(g)PVA浓度与平均粒径的关系图图5 PVA浓度对泡沫传输能力以及微球形貌粒径的影响规律Fig.5 The effect of PVA concentration on the foam-transfer capacity and the morphology and particle size of microspheres
2.3 嘧菌酯/聚乳酸微球的载药性能
利用微球制备技术制备了生物可降解的嘧菌酯/聚乳酸微球,通过缓释作用有效地延长药物的抑菌效果.
以二氯甲烷作为良溶剂,正庚烷作为非良溶剂,制备了多孔结构的嘧菌酯/聚乳酸微球,在此基础上连续化制备了嘧菌酯/聚乳酸多孔微球.由图6可知,采用间歇工艺(图6b~6d)和连续工艺(图6e~6g),均能成功制备嘧菌酯/聚乳酸多孔微球.同时,随着油相中致孔剂正庚烷的引入,嘧菌酯/聚乳酸微球均会呈现多孔结构,且微球的孔径随着R正庚烷/PLA的增加而增大.由图6a可知,采用间歇工艺和连续工艺得到的微球的载药性能相近.不引入致孔剂正庚烷时,嘧菌酯的包封率≥86.54%,载药量≥17.31%,随正庚烷含量的增加,微球的包封率和载药量逐渐降低.

(a)微球的载药性能;(b~g)光学显微镜和SEM图图6 微球载药性能与形貌Fig.6 The ability to carry druy and the morphology of microspheres

图7 嘧菌酯/聚乳酸微球的累积释放曲线Fig.7 Cumulative release curve of azoxystrobin/PLA microspheres
2.4 嘧菌酯/聚乳酸微球的缓释性能
在嘧菌酯/聚乳酸微球制备的基础上,进一步研究了嘧菌酯的释放行为,如图7所示.具有不同孔结构的嘧菌酯/聚乳酸微球在释放初期,药物释放速率较快.这是因为在药物释放的第一阶段,释放出来的主要是微球表面的药物和表层附近的药物,它们的释放速率相比于内部药物的释放速率快很多.随着缓释的进行,药物的释放曲线变得平缓,并最终达到平台释放区域.与单纯的嘧菌酯悬浮液相比,微球具有明显的缓释效果,不同条件下制备出的嘧菌酯/聚乳酸微球的释放曲线相似.
使用零级、一级、Higuchi和Korsmeyer-Peppas方程[15],对随时间变化的嘧菌酯/聚乳酸微球累积释放曲线进行拟合,释放指数n和相关系数R2见表2和表3.嘧菌酯/聚乳酸的药物扩散动力学最符合Higuchi和Korsmeyer-Peppas模型,R2均大于0.99,在Korsmeyer-Peppas模型中n<0.45,所以嘧菌酯/聚乳酸微球中药物释放以Fick扩散为主.

表2 零级方程、一级方程拟合

表3 Higuchi、 RitgerPeppas方程拟合
3 结 论
采用本实验室发明的泡沫传输法成功制备了聚乳酸微球和嘧菌酯/聚乳酸微球.其中,当油水比≥30∶100、转速≥600 r/min、PVA浓度≥1.0%时,泡沫具备较强的夹带输送油滴的能力,通过泡沫传输获得的聚乳酸微球的收率达到89.09%以上.引入致孔剂,在间歇工艺和连续工艺下均成功制备了多孔嘧菌酯/聚乳酸微球且两种工艺制备的微球载药性能基本一致.其中,未引入致孔剂时,两种工艺制备的微球的包封率≥86.54%,载药量≥17.31%;引入致孔剂后,随着R正庚烷/PLA的提高,微球的包封率和载药量逐渐下降.对嘧菌酯/聚乳酸的累积释放数据进行了四种常用释放模型的拟合,嘧菌酯微球的释放最符合Higuchi和Korsmeyer-Peppas模型,以Fick扩散为主.本论文成功将实验室发明的简单、高效、可连续化生产的泡沫传输法拓展到了生物可降解聚合物载药微球的制备中,能够实现快速大量的生产.
