SOX2转染星形胶质细胞促大鼠脊髓损伤神经功能恢复研究
2022-05-07王志刚徐耀端丁向前李经辉余化霖
王志刚,徐耀端,丁向前,王 为,敬 聪,耿 鑫,李经辉,余化霖
(1.昆明医科大学第一附属医院 神经外二科,云南 昆明 650032; 2.云南省红河州肿瘤医院 神经外科,云南 个旧 661000;3.红河州第三人民医院 神经外科,云南 个旧 661000)
0 引 言
脊髓损伤(Spinal Cord Injury,SCI)是脊柱损伤严重的并发症,损伤破坏脊髓上下行传导束,导致损伤节段以下肢体的运动、感觉及自主神经功能障碍,甚至危及生命[1-2],具有高患病率、高致残率等特性[3],临床治疗效果差,给家庭及社会带来极为繁重的经济和心理压力[4-5].如何有效改善SCI后脊髓神经再生修复及功能恢复是一项挑战.细胞重新编程技术是一门生物学新技术,利用该技术将体细胞重新编程为诱导多功能干细胞,再分化为所需要的细胞类型[6].研究发现一些成熟的体细胞,导入转录因子并使其表达,能将其定向转换成需要的细胞[7-8].如成年小鼠的胰腺分泌细胞在体内通过导入转录因子转换成胰岛β细胞[9].在损伤的小鼠心脏中成心肌细胞通过转录因子转换成心肌细胞[10].星形胶质细胞广泛分布于脊髓组织中.其中脊髓损伤后星形胶质细胞反应性增生形成胶质瘢痕,可维持周围细胞的完整性,然而胶质瘢痕的持续存在不利于脊髓损伤后功能的恢复[11],有趣的是星形胶质细胞不管是在大脑中还是在体外是经得起重新编程这个重任的[12].研究发现星形胶质细胞在体内外可以重新转变为神经干细胞[12-13].Su Z等[14]通过一些神经源性因子能促使反应性星形胶质细胞转为神经元.目前参与细胞重编程转录因子常用的有OCT3/4、SOX2、KLF4 和 MYC[15],其中SOX2是脊髓中的一个关键的重新编程因素[16].慢病毒经常作为基因货物的信使[17],其中星形胶质细胞是慢病毒靶向的细胞之一[14].双皮质素(Doublecortin,DCX)广泛表达于神经干细胞及未成熟神经元.丙戊酸(Valproic Acid,VPA)是一种组蛋白脱乙酰激酶抑制剂,能提高胞内基因重组编程,并能够加速神经元的形成,促使诱导的未成熟神经元成熟[14].
本实验运用急性钳夹型大鼠脊髓损伤模型,通过慢病毒介导SOX2转录因子转染大鼠脊髓损伤星形胶质细胞,探讨其能否促进成DCX-阳性的神经干细胞和神经元的增殖,通过 BBB评分、病理学检查、免疫组化、免疫印迹等监测分析其对脊髓损伤后神经功能恢复的关系,从而为临床治疗SCI提供潜在的治疗手段.
1 材料和方法
1.1 动物来源
成年雄性SD大鼠60只,体重240g左右,由昆明医科大学实验动物中心供给.随机分为:(1) Sham组(假手术组,n=12);(2) SCI组(脊髓损伤组,n=12);(3) SOX2-NC组(脊髓损伤+慢病毒组,n=12);(4) SOX2-OE组(脊髓损伤+过表达SOX2慢病毒组,n=12);(5) SOX2-OE+VPA组(脊髓损伤+过表达SOX2慢病毒+丙戊酸组,n=12).
1.2 试剂及仪器
用到的试剂及仪器有:动脉瘤夹(德国Rebstock公司,夹合力 70 g),动脉瘤夹持夹器(德国Rebstock公司),OCT(美国SAKURA公司),正置白光拍照显微镜(Nikon,Japan),Western Blot电泳仪(BIO-R),Western Blot转膜仪(BIO-RAD),PCR用试剂primer(生工生物工程上海有限公司),移液枪(德国Dragon),微量注射泵(上海高鸽工贸有限公司),脑立体定位仪、磨钻(深圳沃瑞德科技有限公司).
1.3 过表达SOX2慢病毒制备
选用载体PGMLV-6751,设计PCR扩增片段引物,并在引物5’端引入线性化克隆载体末端的同源序列,使得扩增产物5’和3’最末端序列分别和线性化克隆载体两末端序列完全一致,将设计好的引物进行合成.将含有载体的质粒的菌液进行过夜培养后进行质粒提取,取 1 μg 新鲜质粒用相应的限制性内切酶进行双酶切,将酶切产物进行电泳,多次离心得到载体片段;将目的基因进行扩增,将过表达载体与目的基因的无缝连接,将其进行转化并测定;经Western Blot验证,构建成功的过表达载体有较好的过表达效果.
1.4 动作模型制作及慢病毒的注射
麻醉充分,备皮,固定,消毒,铺巾.以T10节段为中心,切口约 3.0 cm.切开组织,夹起T10棘突,剪除椎板,露出脊髓;医用动脉瘤夹钳夹脊髓,Sham组按照上述方式只剪除T10椎板.参照文献[18-19]报道的钳夹型急性大鼠脊髓损伤模型的建立与评价.
SOX2-NC组(立体定向仪引导下,使用注射微量泵注射 2 μL 慢病毒在损伤处上下两端约 1.5 mm,距中线 0.5 mm 处,深度 2 μm,注射 1 min,停顿 3 min,缓缓退针)SOX2-OE组和SOX2-OE+VPA组(同一位置注射 2 μL 过表达SOX2慢病毒).Sham和SCI组(同一位置注入 2 μL 0.9%氯化钠),术后SOX2-OE+VPA组腹腔连续给与丙戊酸(100 mg/kg,2次/天)4 w,其余组给与相同剂量0.9%氯化钠.
1.5 BBB运动评分和Rivlin实验评价各组的运动恢复
在各时间观察点(1、3、7、14、21、28 d)对各组行BBB评分和Rivlin实验,评价运动恢复状况.各组随机抽10只,由2名人员按照BBB运动评分和Rivlin实验分别独自评分3次,取平均值.
1.6 HE染色观察各组SCI的结构变化
4 w 后进行灌注取材,用10%水合氯醛麻醉充分后固定,暴露心脏,从心尖进针至主动脉,打开右心耳.先用0.9%氯化钠灌注,再用多聚甲醛灌注.剪除椎板,保留距损伤处上下各约 2 cm 脊髓.多聚甲醛固定过夜,梯度脱水.行苏木精-伊红染色(HE染色):漂洗,处理脊髓,苏木精浸泡,冲洗,伊红染色,清洗,脱水,透明,封固,观测脊髓结构形态改变.其余切片自然干燥,-20 ℃ 保存.
1.7 甲苯胺蓝染色尼氏小体变化
复温,漂洗,水平衡,染液,洗去,分色,脱水,透明,封固,观测尼氏小体数量、形态、染色深度,对阳性面积结果进行分析.
1.8 免疫组化检测SOX2转染星形胶质细胞数量、增殖神经元数量
脱蜡、水化,修复,阻断,血清封闭,加入一抗、二抗,DBA,复染细胞核,封片,观测.
1.9 Western Blot免疫印迹检测SOX2转染星形胶质细胞数量及DCX细胞含量
提取蛋白,4 ℃ 离心,标准蛋白稀释为不同浓度,37 ℃ 水浴 30 min,取出胶板加入电泳液准备上样,以 250 mA 转膜 1 h,封闭 1 h,抗体孵育,洗脱3次×10 min,显影.
1.10 统计学分析
2 结 果
2.1 评价脊髓损伤模型
术后所有大鼠均出现运动丧失和尿潴留,死亡3只,其原因有麻醉过深、肺部感染、膀胱破裂,其中SCI组死亡1只,SOX2-OE组死亡1只,SOX2-OE+VPA组死亡1只,用相同体重雄性SD大鼠替换.
2.2 过表达SOX2对大鼠SCI运动恢复评价
术后对各组在时间观察点(1,3,7,14,21,28 d)行BBB评分和Rivlin实验,其结果如表1、图1所示.术后各组BBB评分和Rivlin实验评分都有所降低,但随着时间发展评分逐渐上升,在各时间观察点其他组评分都低于Sham组;SOX2-OE组与SCI组相比,SOX2-OE组中大鼠的BBB和Rivlin实验评分明显比SCI组高(P<0.05),其中SOX2-OE+VPA组与SOX2-OE组相比,SOX2-OE+VPA组中大鼠的BBB和Rivlin实验评分明显比SOX2-OE组高(P<0.05),然而SOX2组与SCI-NC组相比,SCI组及SCI-NC组无明显区别(P<0.05).

表1 各组大鼠SCI后 BBB 评分比较
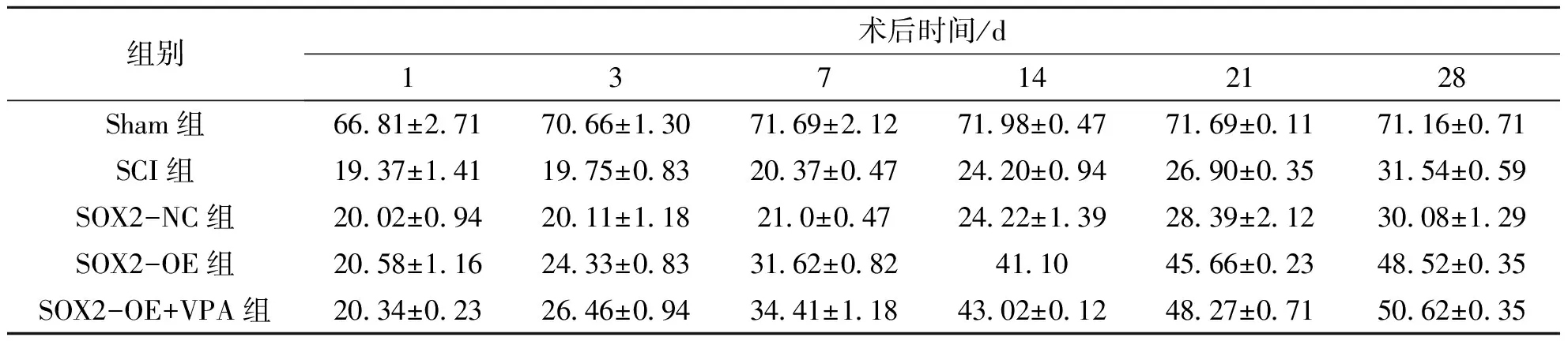
表2 各组大鼠脊髓损伤后Rivlin斜板实验评分比较

注*:SOX2-OE组与SCI组相比,P<0.05,n=8。#:SCI组与SOX2-NC组相比,P>0.05,n=8。&:与SOX2-OE组相比,P<0.05,n=8。图1 SOX2对大鼠SCI后BBB运动功能评分Fig.1 SOX2 on the BBB motor function score in rats after SCI

*:SOX2-OE组与SCI组相比,P<0.05,n=8.#:SCI组与SOX2-NC组相比,P>0.05,n=8.&:与SOX2-OE组相比,P<0.05,n=8.图2 SOX2对大鼠SCI后Rivlin实验评分Fig.2 SOX2 on the Rivlin test score in rats after SCI
2.3 过表达SOX2对脊髓结构的影响
采用HE染色来说明过表达SOX2对脊髓结构的影响,结果如图3和图4所示.从图3得出Sham组(图A)脊髓层次清楚,灰白质结构清楚,SCI组(图B)、SOX2-NC组(图C)脊髓组织层次排列混乱,脊髓空洞形成(黑色长箭头);SOX2-OE(图D)和SOX2-OE+VPA组(图E)脊髓灰白质界线尚可区分,脊髓空洞面积相对较小.图4中,Sham组(图A):脊髓结构清晰,白质、灰质分界明显,白质神经纤维数量丰富,未见明显脱髓鞘;灰质神经元数量丰富;SCI组(图B)、SOX2-NC组(图C)脊髓组织层次排列混乱,脊髓空洞形成(黑色短箭头),明显脱髓鞘(黑色长箭头),灰白质界线不清;SOX2-OE组(图D)、SOX2-OE+VPA组(图E):脊髓灰白质界线尚可区分,少量脱髓鞘
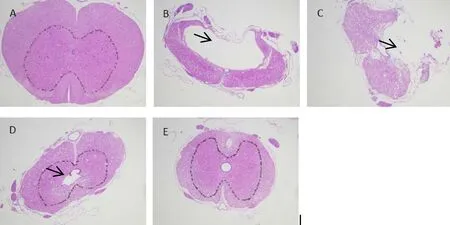
图3 术后 28 d 各组大鼠脊髓HE染色(×40)Fig.3 HE staining of the rat spinal cord in each group 28 days after operation (×40)

图4 术后 28 d 各组大鼠脊髓HE染色(×200)Fig.4 HE staining of the rat spinal cord in each group 28 days after operation (×200)
2.5 过表达SOX2对尼氏(Nissl)小体的影响
采用过表达SOX2对Nissl小体的影响,结果如图5所示,SCI组(图B)、SOX2-NC组(图C)、SOX2-OE组(图D)、SOX2-OE+VPA组(图 E)中 Nissl小体(短箭头)少于Sham组(图 A),SCI组Nissl小体明显减少,染色淡,形态不规则,部分成颗粒状.SOX2-OE组中 Nissl小体较SCI组多(P<0.05),形态略规则.SOX2-OE-VPA组中 Nissl小体较SOX2-OE组多(P<0.05)(阳性面积百分比(%)=阳性面积/组织面积*100).
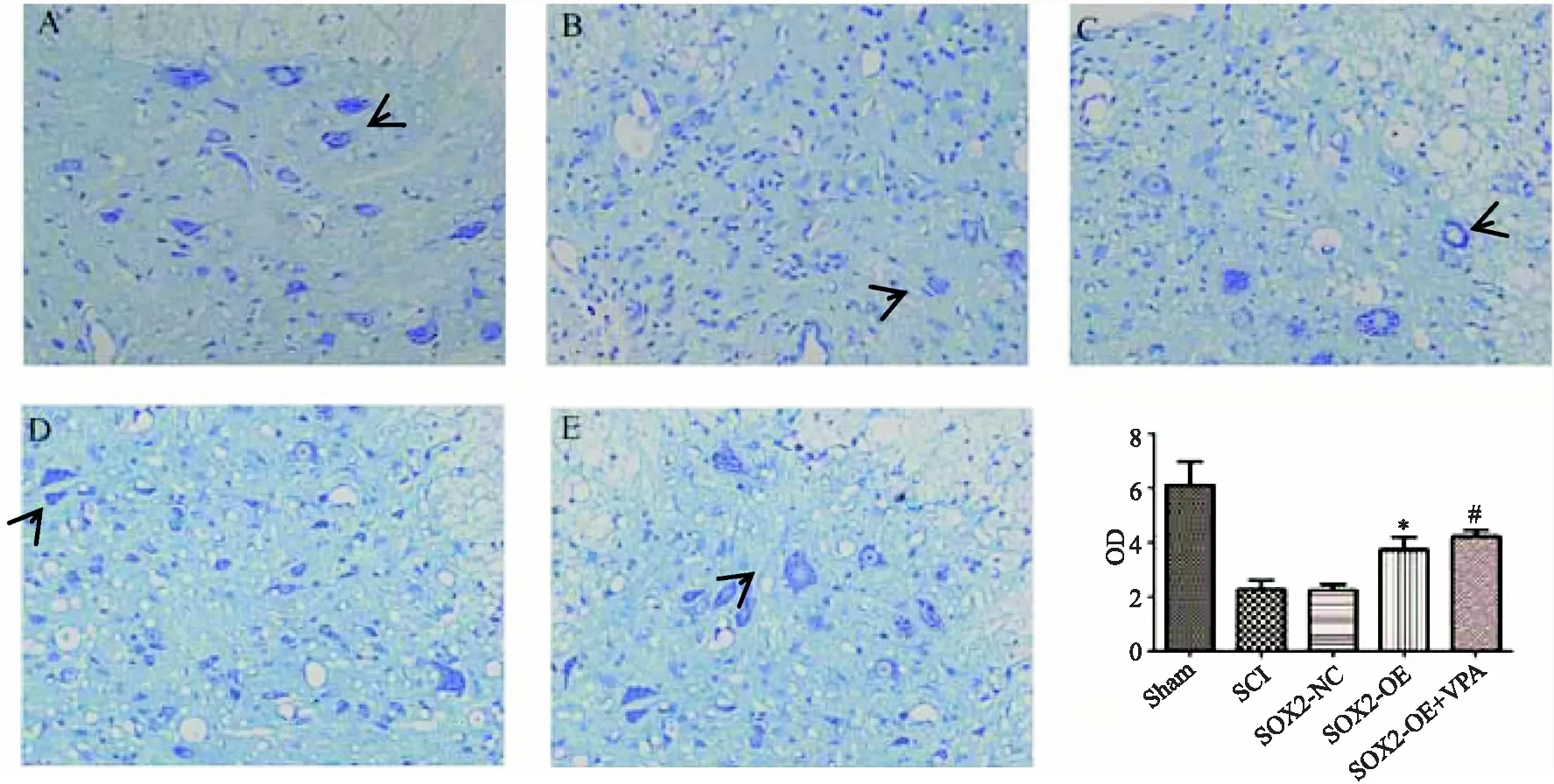
图5 术后 4 周各组大鼠脊髓尼氏染色(×400)Fig.5 Nissl staining of rat spinal cord slices in each group 4 weeks after operation (×400)
2.6 过表达SOX2转染星形胶质细胞后促进DCX-干细胞和神经元增多
通过免疫组化检测SOX2转染星形胶质细胞数量,结果图6所示.SOX2-OE组中转染星形胶质细胞(短箭头)阳性面积百分比较SCI组多(P<0.05);SOX2-OE-VPA组中转染星形胶质细胞(短箭头)阳性面积百分比较SOX2-OE组多(P<0.05).也通过Brdu检测增殖神经元数目情况,结果图7所示:SOX2-OE组中增殖神经元(短箭头)阳性面积百分较SCI组多(P<0.05);SOX2-OE-VPA组中增殖神经元(短箭头)阳性面积百分比较SOX2-OE组多(P<0.05)(阳性面积百分比(%)=阳性面积/组织面积*100).
同时,通过Western Blot免疫印迹检测DCX-神经干细胞数目,结果图8所示.SOX2-OE组中转染星形胶质细胞数量较SCI组多(P<0.05);SOX2-OE-VPA组中转染星形胶质细胞数量较SOX2-OE组多(P<0.05);SOX2-OE组中DCX-阳性干细胞数量较SCI组多(P<0.05);SOX2-OE-VPA组中DCX-阳性干细胞数量比较SOX2-OE组多(P<0.05).

图6 术后4周各组大鼠脊髓SOX2免疫组化染色(×400)Fig.6 SOX2 immunohistochemical staining of spinal cord of rats in each group 4 weeks after operation (×400)
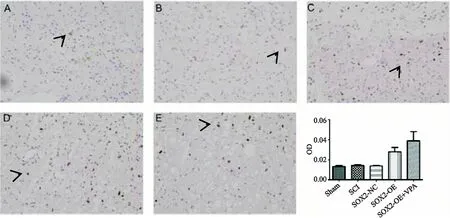
图7 术后4周各组大鼠脊髓Brud免疫组化染色(×400)Fig.7 Brud immunohistochemical staining of spinal cord of rats in each group 4 weeks after operation (×400)

图8 术后4周各组大鼠脊髓Western Blot免疫印迹结果检测SOX2 转染星形胶质细胞及DCX-阳性神经干细胞表达情况Fig.8 The Western Blot results of the spinal cord of each group detected the expression of SOX2 transfected astrocytes and DCX-positive neural stem cells 4 weeks after operation
3 讨 论
SCI后除了原发性损伤外,更为重要的是损伤后缺血、炎症免疫反应、兴奋毒性、星形胶质细胞活化的一连串的联级反应,导致损伤加重[20-21].其中,星形胶质细胞充当着要紧的作用.SCI后反应性胶质增生,致使脱髓鞘[22],脱髓鞘也会导致星形胶质细胞增殖和胶质瘢痕形成[23],而且星形胶质细胞释放炎症因子和兴奋性氨基酸,进一步导致损伤加剧[24-25].此外,星形胶质细胞增殖并迁徙到损伤处,形成胶质瘢痕屏障及产生抑制因子,从而影响神经元和轴突再生[26].
神经元再生是SCI功能恢复的最理想途径.目前,SCI研究多以干细胞为主,并取得喜人效果,但实际工作却面临很大阻力,首先面临伦理问题、免疫排斥、成瘤风险等[27-28];另外,移植过程中二次损伤[29].细胞重编程技术是一项生物学新技术,利用该技术从患者体细胞中产生所需的诱导多能干细胞,再分化成所需要的细胞类型[6].研究发现在神经系统中的多种细胞已经被证明在体内是可重新编程的[30],包含星形胶质细胞、NG2胶质细胞和早期有丝分裂后神经元等[31],其中星形胶质细胞具有丰富、分布广泛、神经损伤后易转化为不同细胞等独特优势[32],另外,研究表明星形胶质细胞向神经干细胞的转化不会改变其神经元谱系,从而产生稳定的生物学表型[33].
研究表明体内重编程主要是由关键转录因子的异位表达启动的[34].SOX2是一种高迁移率的DNA结构域转录因子,参加胚胎发生,干细胞的维持和原始生殖细胞的增殖,也参与体细胞重编程为多功能干细胞或神经干细胞,有关键作用[13-35].引人注意的是,不同转录因子可以让星形胶质细胞转化为不同类型的神经元[36].研究发现SOX2是成人脊髓中的一个关键的重新编程因素[15].而慢病毒可作为基因货物的信使,它能够短时间以细胞特异性的方式传递遗传物质,提供了有效的组织转导,不会立即产生免疫反应或细胞毒性[17-37],星形胶质细胞是慢病毒靶向的细胞[14].本实验利用慢病毒将SOX2注射到SCI局部,4w后取SCI组织以免疫组化及Western Blot免疫印迹观察DCX-阳神经干细胞和增殖神经元,结果:①SOX2-OE组和SOX2-OE+VPA组的DCX-阳性神经干细胞、增殖神经元均多于SCI组(P<0.05),提示SOX2能使脊髓中星形胶质细胞重新编程,促进神经干细胞或神经元增殖;②SOX2-OE组和SOX2-OE+VPA组脱髓鞘程度均小于SCI组,提示SOX2可减轻脱髓鞘程度.研究发现防止脱髓鞘不仅对轴突再生至关重要,而且对OPC在再髓鞘形成过程中变成少突胶质细胞也至关重要[33];③SOX2-OE组和SOX2-OE+VPA组的Nissl小体数量、形态及染色情况均优于SCI组(P<0.05),当神经元受损坏时,Nissl小体能产生变化,如Nissl小体消融等,Nissl小体能反映神经元损伤[36];④结合HE染色发现SOX2-OE组和SOX2-OE+VPA组脊髓空洞面积均低于SCI组;⑤SOX2-OE组和SOX2-OE+VPA组在各时间观察点的BBB评分和Rivlin实验结果高于SCI组(P<0.05),提示慢病毒介导SOX2转录因子转染大鼠脊髓损伤星形胶质细胞可改善SCI大鼠后肢功能.
4 结 论
通过BBB评分、Rivlin斜板实验、病理改变、免疫组化、Western Blot免疫印迹观察大鼠SCI的行为学、结构、分子水平改变,证实过表达SOX2能转染星形胶质细胞促进DCX-阳性神经干细胞和神经元增多,从而改善SCI神经功能恢复情况,为自体细胞移植提供来源,也使得原位治疗SCI成为可能,其具体分子途径和机制有待进一步研究.
