脂质体前列腺素E1对重症肺炎大鼠炎性介质的调控机制
2022-05-07李俊杰
赵 申,李俊杰
湖北文理学院附属医院/襄阳市中心医院儿科,襄阳 441000
重症肺炎是指肺炎患者出现严重低氧血症、急性呼吸衰竭,需要通气支持或者出现低血压和休克等循环衰竭表现[1]。由于病菌的入侵往往会引起机体的炎症反应,适当的炎症因子表达能够加快患者机体对病菌的清除速度,但重症肺炎会造成机体产生大量的促炎因子,过度激活机体的炎症反应,最终导致以细胞自身性破坏为特征的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[2-3]。脂质体前列腺素E1(liposome prostaglandin E,lip-PGE1)为花生四烯酸的衍生物,是一种抗炎因子[4]。袁科等[5]研究表明,lip-PGE1 可减轻重症肺炎大鼠的炎症反应,可能与调节CD4+、CD25+调节性T细胞表达有关。本文旨在研究lip-PGE1对重症肺炎大鼠炎性介质的影响,并初步分析其作用机制,从而为重症肺炎患者的治疗提供理论依据。
1 仪器与材料
1.1 仪器
BX46型光学显微镜、BX53型荧光显微镜,均购自日本Olympus公司;iMark型酶标仪(美国BioRad公司);DYCZ-24K型双板垂直电泳仪、DYCP-40C型半干式碳板转移槽,均购自北京六一生物科技有限公司。
1.2 试药
前列腺素E1(比法尔,国药准字H20000721,批号20181208,广东香山堂制药有限公司);白细胞介素-6(interleukin-6,IL-6,批 号12100-550)、IL-1β(批号18421-125)和肿瘤坏死因子α(tumor necrosis factorα,TNF-α,批 号22300-150)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自上海酶联生物科技有限公司;核因子κB(nuclear factorκB,NF-κB)P65(批号8596)、磷酸化P65(p-P65,批号9250)、NF-κB抑制蛋白(NF-κB inhibitory protein,IκB,批号2265)、p-IκB、Toll样受体4(toll-like receptor 4,TLR4,批号5230)和髓样分化因子88(myeloid differentiation factor 88,MyD88,批号1655)蛋白一抗均购自美国Abcam 公司。
1.3 细胞与动物
肺炎克雷伯菌由中国科学院微生物研究所提供;SPF级6~8周龄SD 大鼠45只,雄性,体质量200~240 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2020-0005。饲养温度20~25℃,相对湿度50%~65%,自由摄食、饮水,适应性喂养1周后进行实验。
2 方法
2.1 动物分组及模型建立
选取45只雄性SD 大鼠,随机分为对照组、模型组和脂质体前列腺素E1(lip-PGE1)组,每组15只,模型组和lip-PGE1组采用气管穿刺肺炎克雷伯菌液法制做重症肺炎模型。方法:大鼠术前禁食12 h,腹腔注射水合氯醛麻醉处理,切开颈部皮肤,钝性分离皮下组织,暴露上段气管,用注射器穿刺气管缓慢滴入0.25 mL 新鲜配制的肺炎克雷伯菌液(含菌量为1.2×109cfu·mL-1),使大鼠保持直立位约20 s,以保证菌液均匀分布于肺,6 d后观察到大鼠表现出呆滞和呼吸急促,经HE 染色观察到肺部组织损伤严重,伴有大量的炎性细胞浸润,提示重症肺炎大鼠模型构建成功[6],对照组以等量生理盐水替代。
2.2 药物干预
造模成功后,lip-PGE1组尾静脉注射1μg·kg-1的lip-PGE1[7],连续注射5 d,对照组和模型组分别注射等量的生理盐水,药物注射后7、9和11 d采集大鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)进行炎症因子和细胞数量检测,再处死大鼠采集肺组织,进行病理染色观察和相关蛋白表达水平的检测。
2.3 检测项目
2.3.1 大鼠BALF的收集与细胞计数 将2 mL无菌生理盐水注入大鼠气管,轻轻按摩左肺30 s后,抽回灌注液体,再灌注该液体,重复3次后,将灌入的液体抽出,此为1 次灌洗完毕。收集3 次灌洗后的BALF,使用层干纱布过滤后,以1 500 r·min-1离心15 min,取上清液待测。收集经过滤的BALF 细胞沉淀,调整密度为1×109个·L-1,采用细胞计数板对总细胞进行计数,再取200μL 细胞进行Diff-quick染色,于光镜下计数中性粒细胞。
2.3.2 BALF 中IL-6、IL-1β和TNF-α水平的检测取大鼠BALF,参照ELISA 试剂盒说明书操作,检测BALF中IL-6、IL-1β和TNF-α的含量。
2.3.3 HE染色观察大鼠肺组织病理变化 取药物注射后第11天的大鼠肺组织用中性甲醛溶液固定24 h后,石蜡包埋切片,经HE 染色,在光镜下观察肺组织病理变化。
2.3.4 蛋白印迹检测肺组织相关蛋白的表达 取药物注射后第11天的大鼠肺组织约200 mg,加入放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液,冰上裂解1 h,以12 000 r·min-1离心10 min,分离上清液测定蛋白浓度,水浴变性后,取50μg蛋白进行电泳,蛋白完全分离后再转移至聚二偏氟乙烯(polyvinylidenefluoride,PVDF)膜,取出载有蛋白的PVDF膜,浸于脱脂牛奶,室温下孵育2 h,接着浸于1∶1 000蛋白一抗,4℃下摇床振荡过夜,再浸于1∶5 000蛋白二抗,37℃下摇床振荡1 h,最后添加电化学发光法(electro-chemi-luminescence,ECL)试剂进行蛋白显影。
2.3.5 免疫荧光法检测NF-κB P65核迁移情况取药物注射后第11天的大鼠肺组织,用中性甲醛溶液固定24 h后,石蜡包埋切片,脱蜡水化后,置于枸橼酸缓冲液中高温抗原修复,添加1∶50 NF-κB P65一抗,4℃下孵育过夜,再滴加相应二抗,避光条件下室温孵育1 h,滴加4′,6-二脒基-2-苯基吲哚[2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI]染液,避光条件下室温孵育10 min,封片后,于荧光显微镜下观察并拍照,计数总细胞数和NF-κB P65核染色阳性细胞数。
2.4 统计学方法
3 结果
3.1 各组大鼠BALF 中细胞总数和中性粒细胞数的比较
药物注射后的第7、9和11天,模型组、lip-PGE1组BALF 中的细胞总数和中性粒细胞数逐渐增加;与对照组相比,模型组大鼠BALF 中的细胞总数和中性粒细胞数均显著增加(P<0.05);与模型组相比,lip-PGE1组细胞总数和中性粒细胞数均显著减少(P<0.05)。结果见表1。
表1 各组大鼠BALF中细胞总数和中性粒细胞数的比较(,n=5)Tab.1 Comparison of the total number of cells and neutrophils count in BALF among groups(,n=5)

表1 各组大鼠BALF中细胞总数和中性粒细胞数的比较(,n=5)Tab.1 Comparison of the total number of cells and neutrophils count in BALF among groups(,n=5)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.2 各组大鼠BALF中IL-6、IL-1β 和TNF-α 水平的比较
药物注射后第7、9和11天,模型组和lip-PGE1组BALF 中炎性细胞因子水平逐渐升高;与对照组相比,模型组大鼠BALF中IL-6、IL-1β和TNF-α的水平均显著升高(P<0.05);与模型组相比,lip-PGE1组IL-6、IL-1β和TNF-α的水平均显著降低(P<0.05)。结果见表2。
表2 各组大鼠BALF中IL-6、IL-1β 和TNF-α 水平的比较 (,n=5)Tab.2 Comparison of IL-6,IL-1βand TNF-αlevels in BALF among groups (,n=5)

表2 各组大鼠BALF中IL-6、IL-1β 和TNF-α 水平的比较 (,n=5)Tab.2 Comparison of IL-6,IL-1βand TNF-αlevels in BALF among groups (,n=5)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.3 各组大鼠肺组织HE染色观察
各组大鼠肺组织HE 染色结果见图1。由图1可见,对照组大鼠肺泡结构完整,肺泡腔内无渗出液且肺泡间隔正常;模型组大鼠肺组织实变,结构消失,肺泡腔内可见大量渗出液,肺泡间隔增宽且呈代偿性肺气肿或肺萎缩;lip-PGE1组大鼠肺部结构较为完整,与模型组比较,腔内渗出液减少,炎性细胞浸润程度降低且范围显著缩小。
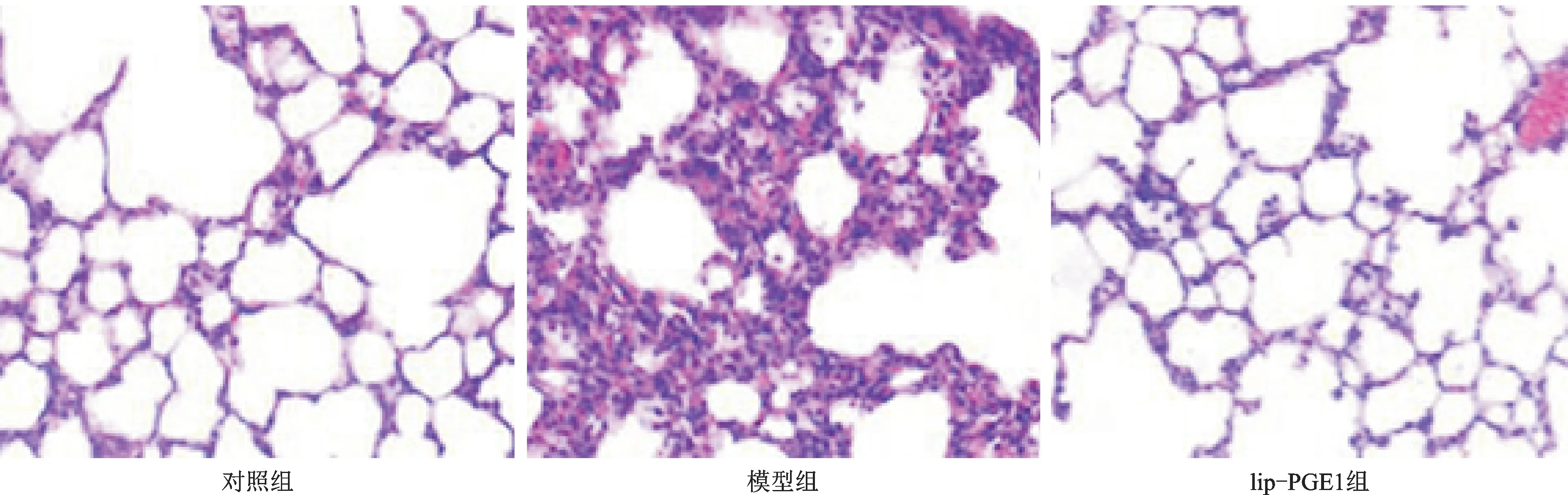
图1 各组大鼠肺组织HE染色结果 (×400)Fig.1 HE staining of lung tissues in all groups (×400)
3.4 各组大鼠肺组织相关蛋白表达水平的比较
与对照组相比,模型组大鼠肺组织p-P65/P65、TLR4和My D88的水平均显著升高,p-IκB/IκB的水平降低(P<0.05);与模型组相比,lip-PGE1 组p-P65/P65、TLR4 和My D88的水平均显著降低,p-IκB/IκB的水平升高(P<0.05)。结果见图2、表3。
表3 各组大鼠肺组织相关蛋白表达的比较 (,n=5)Tab.3 Comparison of the expressions of related proteins in lung tissues among groups(,n=5)

表3 各组大鼠肺组织相关蛋白表达的比较 (,n=5)Tab.3 Comparison of the expressions of related proteins in lung tissues among groups(,n=5)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
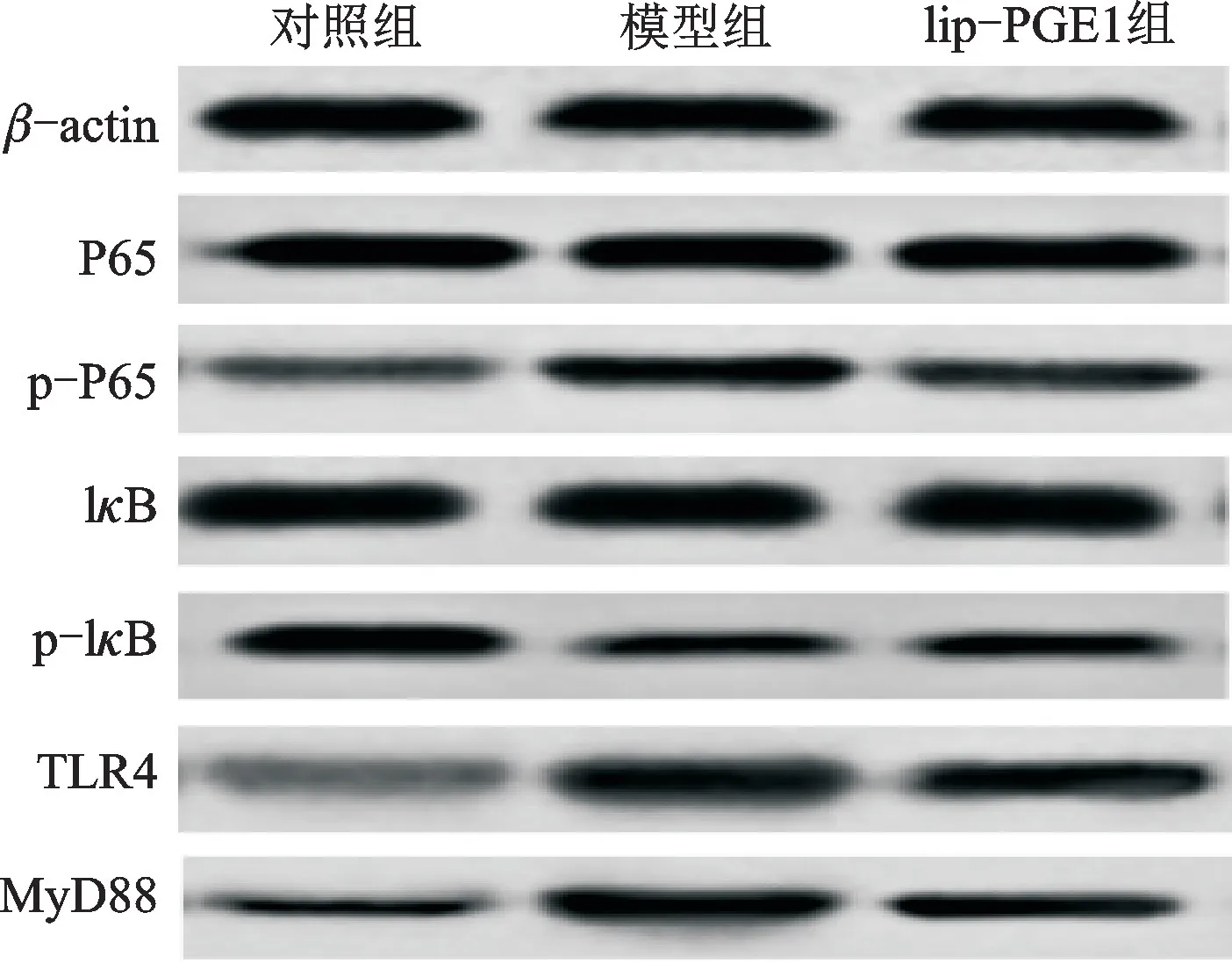
图2 蛋白印迹检测肺组织相关蛋白的表达水平Fig.2 Expressions of related proteins in lung tissues detected by Western blot
3.5 各组大鼠NF-κB P65核迁移情况的比较
各组大鼠NF-κB P65核迁移情况的比较见图3。由图3 可见,对照组、模型组和lip-PGE1 组NF-κB P65阳性细胞数占比分别为9.21% ±2.14%、56.87%±7.62%、29.63%±8.21%,与对照组相比,模型组大鼠肺组织NF-κB P65阳性细胞数显著增加(P<0.05);与模型组相比,lip-PGE1组NF-κB P65阳性细胞数显著减少(P<0.05)。结果见图3。

图3 各组大鼠NF-κB P65核迁移情况的比较Fig.3 Comparison of nuclear migration of NF-κB P65 among groups
4 讨论
目前,对重症肺炎的治疗主要依靠抗生素及一些支持治疗,但重症肺炎的病死率仍较高[8-10],因此,亟待寻找有效的治疗药物。既往研究显示,lip-PGE1具有强效的抗炎作用,能够抑制多种组织病理生理损伤[11]。发生严重肺部感染时,病原菌的内毒素会刺激中性粒细胞、巨噬细胞和嗜酸性粒细胞等多种细胞在肺内聚集,再释放与炎症相关的细胞因子,启动炎症反应[12]。同时,这些细胞还会释放氧自由基和脂质代谢产物,损害周围细胞和组织,从而导致肺微血管膜及肺泡上皮的损伤[13]。本研究发现,lip-PGE1组大鼠BALF中细胞总数和中性粒细胞数显著少于模型组。IL-6、IL-1β和TNF-α均是重要的促炎性细胞因子,它们主要由单核细胞和巨噬细胞等免疫细胞和非免疫细胞等分泌,是炎症的重要介导物质[14]。本研究发现,经lip-PGE1处理后,大鼠BALF中IL-6、IL-1β和TNF-α的水平降低。同时,病理染色结果也证实,与模型组比较,lip-PGE1组肺组织结构较为完整,腔内渗出液减少,炎性细胞浸润程度降低且范围显著缩小,表明lip-PGE1能有效减少中性粒细胞的数量,抑制促炎症因子IL-6、IL-1β和TNF-α的表达,从而减轻大鼠体内的炎症反应,缓解由肺炎克雷伯菌诱导的肺组织损伤。
TLR4/MyD88/NF-κB 信号通路是调控炎症反应的重要信号通路之一,病原菌入侵后,与单核巨噬细胞表面的TLR4结合,募集下游信号分子MyD88,致使IκB发生自身磷酸化,解离的NF-κB转位进核,诱导单核巨噬细胞合成并分泌大量的炎症细胞因子(IL-6、IL-1β和TNF-α等),造成肺损伤[15-17]。WANG Y等[18]通过建立肺炎支原体肺炎小鼠模型,发现微小RNA-143-3p 过表达可通过抑制TLR4/MyD88/NF-κB信号通路,改善模型小鼠肺内炎症因子的水平,减少肺泡上皮细胞的凋亡。CHEN L等[19]研究显示,卵泡素样蛋白1 可能介导TLR4/NF-κB信号通路,在肺炎链球菌感染期间的炎症反应中发挥重要作用。卿蕊等[20]使用肺炎克雷伯菌Fim H 蛋白刺激巨噬细胞,发现Fim H 蛋白可通过TLR4/NF-κB途径,诱导巨噬细胞分泌IL-6、IL-1β和TNF-α因子,这可能是肺炎克雷伯菌的潜在致病机制。本研究的结果显示,对大鼠气管穿刺滴注肺炎克雷伯菌菌液后,大鼠肺组织内的TLR4/MyD88/NF-κB信号通路被激活,经lip-PGE1处理后,p-P65/P65、TLR4和My D88的水平均显著降低,p-IκB/IκB的水平升高,且NF-κB P65从细胞质向细胞核移位的阳性细胞数也明显减少,提示lip-PGE1可能通过阻滞TLR4/My D88/NF-κB通路,抑制重症肺炎大鼠体内的炎症反应。
综上所述,lip-PGE1 可有效抑制重症肺炎大鼠的炎症反应,减轻肺组织损伤,其作用机制可能与阻滞TLR4/NF-κB信号通路有关。本研究后续将用信号通路特异激动剂或抑制剂,激活或抑制TLR4/MyD88/NF-κB信号通路,进一步观察lip-PGE1 发挥作用的分子机制。
