番茄SlDNMT2基因的克隆和抗逆性研究
2022-05-06汪宏涛刘嘉荔刘永胜唐晓凤
张 玉, 汪宏涛, 刘嘉荔, 刘永胜, 唐晓凤
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
植物在生长发育过程中可能受到一定的生物胁迫与非生物胁迫。生物胁迫主要有植物病毒性感染、虫害等;非生物胁迫主要包括盐胁迫、干旱胁迫、热胁迫、冷胁迫和一些重金属离子胁迫等。植物响应非生物胁迫发生一系列生理生化反应,以适应不同的环境变化。自然界中较长寿的树木进化出相应的机制以应对环境的变化,维持正常的生长发育[1-3]。Zn2+离子胁迫可能降低瓢儿菜根部营养物质的积累[4];Mn2+胁迫降低垂穗披碱草幼苗叶片中叶绿素含量的积累,进而对幼苗的生长发育产生影响[5];Fe2+离子胁迫条件下,拟南芥菜和油菜会产生更多的丙二醛,对植物的生长发育产生毒害作用[6]。随着科技和工业的发展,重金属离子污染日益加重,对农作物的生长发育产生影响,进而对食品安全产生威胁。因此,关于这些胁迫方面的研究对提高作物产量和食品安全与品质意义重大。
DNA甲基化是一种常见的DNA复制后共价修饰作用,在植物生长发育过程中至关重要[7-8]。植物体内DNA甲基化的水平主要与DNA甲基转移酶有关,根据结构域的排列形式,其主要可分为4个家族,即甲基转移酶(methyltransferase,MET1)、染色质域甲基转移酶(chromomethylase,CMT)、域重排甲基转移酶(domains rearranged methyltransferase,DRM)、5’端胞嘧啶甲基转移酶(DNA 5’cytosine methyltransferase2,DNMT2)[9-10]。MET1和CMT最早从拟南芥中克隆,其在植物体器官和组织中均有表达,具有特殊的结构域,主要参与维持胞嘧啶位点的甲基化作用[11];DRM可以分为DRM1和DRM2,主要识别半甲基化或未甲基化的DNA,在DNA甲基化过程中发挥重要作用[12-13]。有研究报道,拟南芥中DNMT2可以与组蛋白去乙酰化酶发生相互作用,并且在冷处理胁迫下,DNMT2的表达量有一定的增加,对生长发育产生影响[13]。拟南芥中DNA甲基转移酶基因的突变扰乱正常的DNA甲基化过程,不利于植物的生长发育[14]。植物体中DNMT2具有高度保守的结构域,但却没有催化活性[13],因此,目前关于植物体内DNA甲基过程中DNMT2的作用机制和功能性的研究较少。
番茄(Solanumlycopersicum)是一年或多年生短日照植物。其含有丰富的碳水化合物、维生素等营养成分,因此具有一定食用价值;此外,番茄中含有番茄红素、类黄酮等物质,具有抗氧化作用,因此其还具有一定药用价值[15-17]。目前番茄广泛种植于中国南北方,在我国果蔬供应方面影响深远[18]。
本文以模式植物番茄为实验材料,分析DNA甲基转移酶SlDNMT2基因的表达模式;通过生物信息学技术,分析SlDNMT2蛋白的生物学进化关系;利用烟草瞬时表达系统,分析SlDNMT2蛋白的亚细胞定位情况;并成功构建植物RNAi表达载体,利用农杆菌介导的侵染法转化野生型番茄,得到番茄转基因RNAi植株;进一步探究不同非生物胁迫条件对转基因RNAi植株和野生型植株的影响作用。本文为进一步分析SlDNMT2基因在DNA甲基化过程中的功能作用奠定了基础,对研究植物体内DNA甲基转移酶DNMT2基因作用的分子机制具有重要作用。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
野生型(AC)番茄植物(SolanumlycopersicumMill. cv. Aillsa Craig)来自美国康奈尔大学THOMPSON植物研究所,由本实验室繁殖保存;烟草(NicotianatabacumL.)来自美国康奈尔大学THOMPSON植物研究所,由本实验室繁育保存。
1.1.2 菌株和质粒
大肠杆菌DH5α(EscheriachiacoliDH5α)、根癌农杆菌GV2260(AgrobacteriumtumefaciensGV2260)、根癌农杆菌EHAl05(AgrobacteriumtumefaciensEHAl05)、亚细胞定位表达载体pART-27GFP及植物表达载体pBI121均保存于本实验室-80 ℃冰箱。
1.1.3 分子生物学试剂
RNA提取试剂 (Invitrogen公司);反转录试剂盒(5X All-In-One RT Master Mix)、质粒提取试剂盒(Easy Pure Plasmid Mini Prep Kit)),(TOYOBO公司);琼脂糖胶回收试剂盒(Easy Pure Quick Gel Extraction Kit,Omega公司)高保真DNA聚合酶Primer Star、DNA聚合酶、限制性内切酶、T4 DNA Ligase (TaKaRa公司);聚合酶链式反应(polymerase chain reaction,PCR)引物和测序(上海生工技术有限公司)。
1.2 方法
1.2.1SlDNMT2目的基因的克隆
根据番茄SlDNMT2基因序列设计2对引物。第1对特异性引物信息具体为:
DNMT2-F 5’CGGTTGTTTGCTTGCGTCT3’,
DNMT2-R 5’CTTGTGCAGATGGAGCTTCAG3’;
第2对特异性引物信息具体为:
DNMT2-F1 5’ATGGAATCGGAAGTTTCTAGA3’,
DNMT2-R1 5’TCATGAATGGTTGATGAAGAGATATT3’。
利用PCR技术,获得SlDNMT2基因编码区序列。本文为了增加PCR产物的特异性,使用2对引物,通过巢式PCR进行2轮扩增,如图1所示,黑色箭头所指位置为起始密码子(ATG)和终止密码子(TGA),第1对引物位于目的基因的非编码区,然后以第1轮产物为模板,使用第2对引物进行巢式PCR第2轮扩增。PCR反应程序为: 94 ℃、2 min,94 ℃、20 s,58 ℃、20 s,72 ℃、2 min,72 ℃、5 min,30个循环。PCR产物经琼脂糖胶回收试剂盒胶回收,并与克隆载体pEASY-Blunt Simple Cloning Vector连接,转化大肠杆菌DH5α感受态细胞,菌落PCR阳性鉴定,送上海生工技术有限公司测序。

图1 巢式PCR引物位置示意图
1.2.2SlDNMT2的组织特异性表达分析
利用RNA提取试剂,分别从野生型番茄植株幼苗不同发育时期的根、茎、叶、花、果实中提取植物总RNA,样品取样质量为100 mg,经反转录试剂盒反转录获得SlDNMT2的cDNA序列。以cDNA为模板,以番茄UBI3基因(GenBank登录号为X58253)为内参,通过实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术分析不同植物组织中SlDNMT2基因的表达情况。
1.2.3 SlDNMT2蛋白的亚细胞定位
经限制性内切酶酶切、T4 DNA Ligase 连接、转化及菌落PCR阳性鉴定等生物化学与分子生物学实验方法,将目的基因SlDNMT2的CDS序列构建至pART-27GFP表达载体,载体构建过程中所用引物见表1所列。

表1 本研究中所用的引物
pART-27GFP为本实验保存的亚细胞定位载体,含有强绿色荧光蛋白(eGFP),在激光共聚焦显微镜下可观察到强烈的绿色荧光。利用农杆菌介导的烟草瞬时表达系统,获得目的基因SlDNMT2融合表达载体,命名为pART-27-35S::SlDNMT2-eGFP。
转化根癌农杆菌GV2260,菌落PCR阳性鉴定,获得阳性菌菌样于28 ℃摇床培养18 h,转接至新培养基培养6~8 h,加入诱导液1在28 ℃摇床中培养12 h,暗处理10 min,诱导液2处理,注射烟草叶片,放置36~48 h后,撕取烟草叶片表皮细胞,在激光共聚焦显微镜下观察。诱导液1、诱导液2、AB盐溶液、IM溶液配制方法如下。
诱导液1(20 mL):1 mL AB盐溶液、19 mL IM溶液、ACE溶液(39 mg/mL、稀释1 000倍)、Kana溶液(50 mg/mL、稀释1 000倍);
诱导液2(20 mL):1 mL MES溶液(0.20 mol/L、稀释20倍)、19 mL无菌水、ACE溶液(39 mg/mL、稀释1 000倍);
AB盐溶液(1 L):适量无菌水中加入20.00 gNaCl、3.00 g KCl、0.05 g FeSO4、0.60 g MgSO4· 7H2O;另取一容器,加入3.00 g CaCl2·2H2O,加入适量无菌水,将 CaCl2溶液缓慢倒入上一溶液中,定容至1 L,4 ℃保存;
IM溶液(1 L):适量无菌水中加入9.76 g MES、5.00 g葡萄糖、0.25 g NaH2PO4,玻璃棒搅拌溶解后,定容至1 L,灭菌,4 ℃保存。
1.2.4SlDNMT2基因RNAi表达载体的构建
本文选择pBI121载体作为番茄植物表达载体,限制性内切酶处理pSK-SlDNMT2 RNAi阳性菌重组质粒和pBI121空载质粒,经胶回收试剂盒回收SlDNMT2基因RNAi特异性片段,T4 DNA Ligase 4 ℃过夜连接,转化大肠杆菌DH5α感受态细胞,经阳性菌鉴定、发夹结构的验证等实验,送上海生工技术有限公司测序正确,最终获得番茄植株SlDNMT2基因RNAi表达载体。本文中构建RNAi表达载体所需引物及其酶切位点见表1所列。
1.2.5 番茄植株的遗传转化
利用根癌农杆菌EHA105介导的浸染法,将上述构建成功的重组质粒转化至本实验室保存的野生型番茄植株。利用植物组织培养技术,预培养、共培养、筛选培养,最终获得转基因番茄植株。根据pBI121载体中的卡那霉素抗性基因NPTⅡ(GenBank登录号为AF485783)和菌落PCR技术,进行DNA水平阳性筛选,DNA水平阳性鉴定所用到的引物为:
NPTⅡ-F 5’AGACAATCGGCTGCTCTGAT3’,
NPTⅡ-R 5’TCATTTCGAACCCCAGAGTC3’。
此外,提取转基因RNAi植株总RNA,反转录获得cDNA,Step One Real-time PCR仪定量分析,进行RNA水平阳性鉴定,结果如图2所示,定量PCR相关引物见表1所列。图2中,1~6表示通过菌数PCR鉴定得到的转基因阳性样品。结果表明转基因植株在DNA和RNA水平均为阳性。
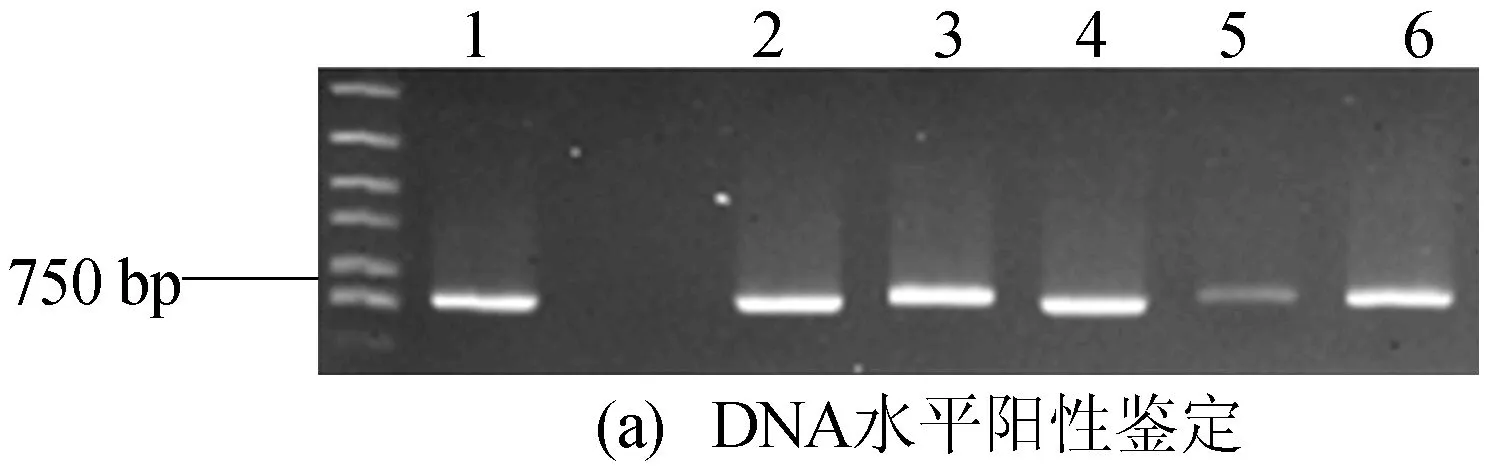
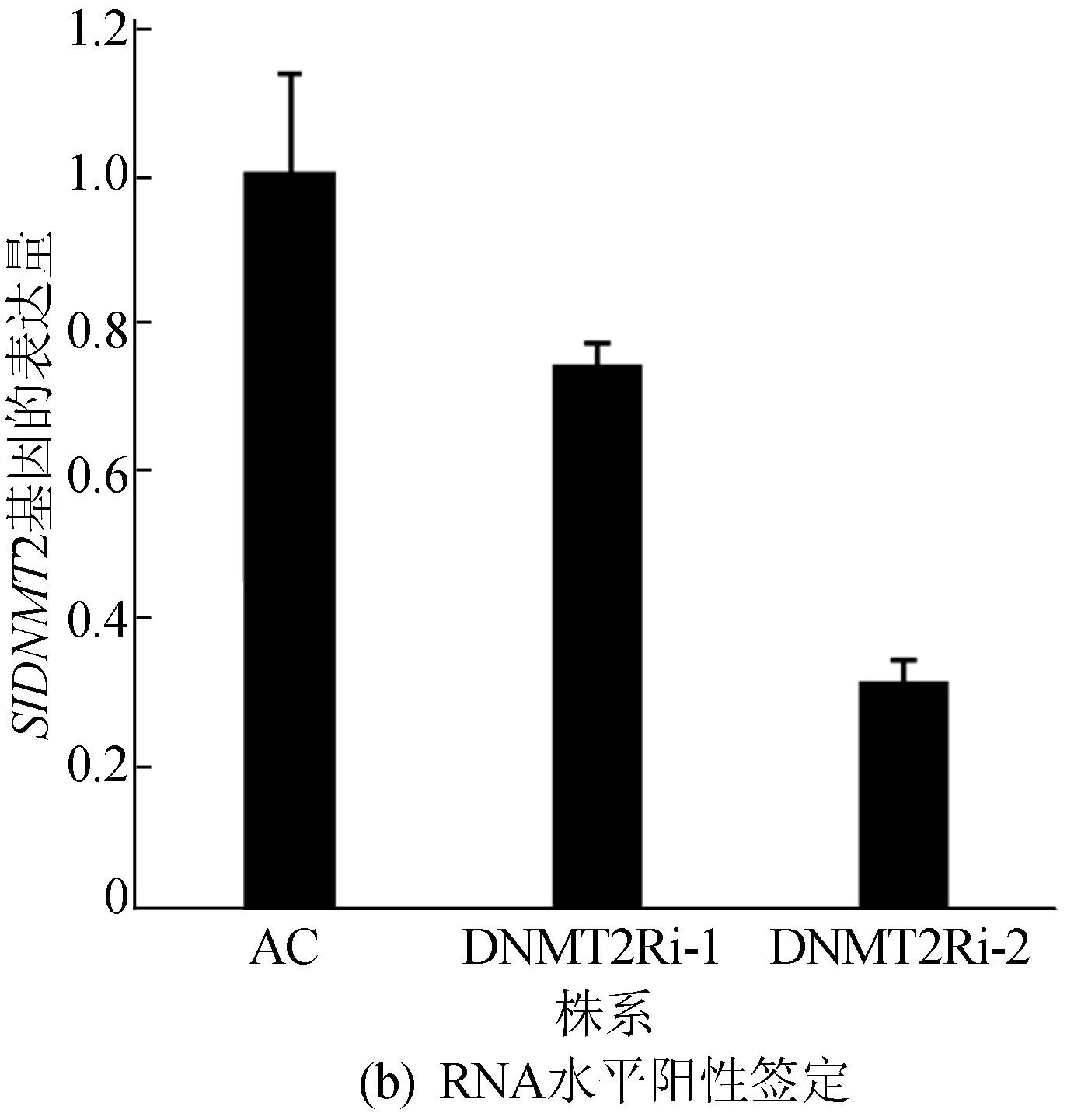
图2 转基因RNAi植株的阳性鉴定结果
1.2.6 二价重金属离子胁迫条件下的表型分析
为了探究转基因RNAi番茄植株在重金属离子胁迫条件下的生长发育情况,本文将初始生长状态一致的野生型(AC)与转基因RNAi植株,分别移植到1/2MS培养板、含300 μmol/L Fe2+的1/2 MS培养基、含300 μmol/L Zn2+的1/2 MS培养基、含300 μmol/L Mn2+的1/2 MS培养基中,垂直放置于培养架,置于22 ℃培养室生长7 d,记录不同处理条件下植株的表型。
2 结果与分析
2.1 SlDNMT2基因的生物信息学分析
TAIR拟南芥数据库中搜索获得拟南芥AtDNMT2基因序列,利用美国国家生物技术信息中心数据库(National Center for Biotechnology Information,NCBI)Blast获得番茄植株中同源基因SlDNMT2序列,进而获得不同物种中该基因编码的氨基酸序列。利用DNAMAN软件分析不同物种DNMT2蛋白保守域,如图3所示。
此外,利用PFAM网站分析不同物种DNMT2基因氨基酸序列,并通过ClustalX和MEGA7.0软件分析,绘制不同物种DNMT2蛋白结构域和系统进化树,如图4所示。结果表明,番茄SlDNMT2与马铃薯StDNMT2的亲缘关系较近,同源性高达95.54%;番茄SlDNMT2与拟南芥AtDNMT2亲缘关系较远。
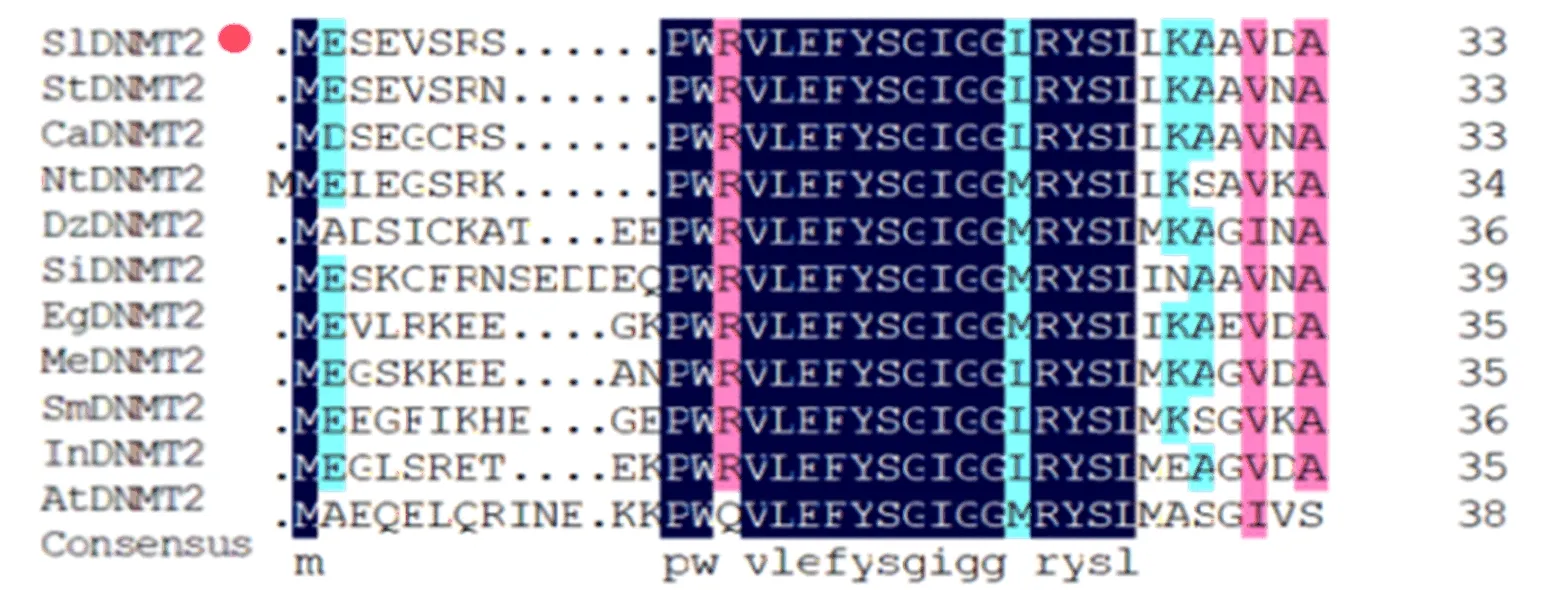

图3 不同物种DNMT2蛋白保守域
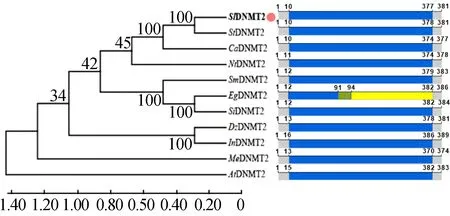
图4 DNMT2进化树分析和结构域分析
2.2 SlDNMT2基因cDNA序列克隆
以cDNA作为模板,DNMT2-F、DNMT2-R、DNMT2-F1、DNMT2-R1为引物,巢式PCR扩增得到SlDNMT2基因产物,经0.8%琼脂糖凝胶电泳进行检测,结果如图5所示。根据电泳条带的大小,判断SlDNMT2目的基因片段的正确性,并送公司测序,经DNAMAN软件比对,测序结果正确。

图5 SlDNMT2目的基因片段
2.3 SlDNMT2蛋白的亚细胞定位分析
利用农杆菌介导的转化法,将目的基因SlDNMT2转化至根癌农杆菌GV2260感受态细胞,获得pART-27-35S::SlDNMT2-eGFP融合表达载体。注射烟草,在激光共聚焦显微镜下观察,结果如6所示。用DAPI染液对细胞核染色可确定细胞核位置,由MERGE混合图像可确定SlDNMT2蛋白定位在细胞核中。
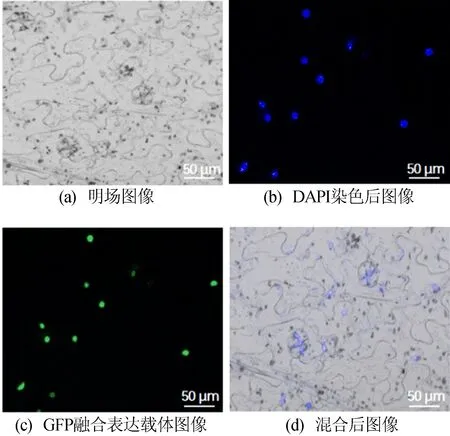
图6 SlDNMT2蛋白亚细胞定位
2.4 SlDNMT2基因表达的组织特异性分析
Trizol试剂法提取番茄植株不同组织、不同发育时期的果皮中总RNA,反转录获得cDNA,RT-qPCR分析番茄SlDNMT2基因在番茄植株不同组织中表达量的差异,结果如图7所示。
图7中,IG1代表授粉后7 d果实;IG2代表授粉后14 d果实; MG代表授粉后35 d果实;Br代表果实变色期;RR代表果实成熟期;Rt代表根;Stem代表茎;L代表叶片;F代表花。结果表明SlDNMT2基因在番茄植株不同发育时期的各组织中均有表达,IG时期果实中SlDNMT2表达量较低,叶片(L)和花(F)中SlDNMT2表达量较高。
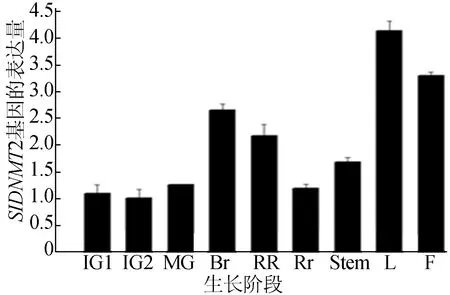
图7 SlDNMT2基因的表达模式分析
2.5 转基因植株在胁迫下的表型分析
在不同处理条件下,转基因RNAi和野生型植株的表型有一定差异,如图8所示。
由图8可知,在1/2 MS、300 μmol/L Mn2+、300 μmol/L Fe2+培养条件下,野生型和转基因RNAi植物生长状态没有显著差异;但是,在300 μmol/L Zn2+培养条件下,野生型植株比RNAi植物的生长发育状态较好。
利用ImageJ软件测量植株高度和SPSS18软件分析数据,结果如图9、图10所示。
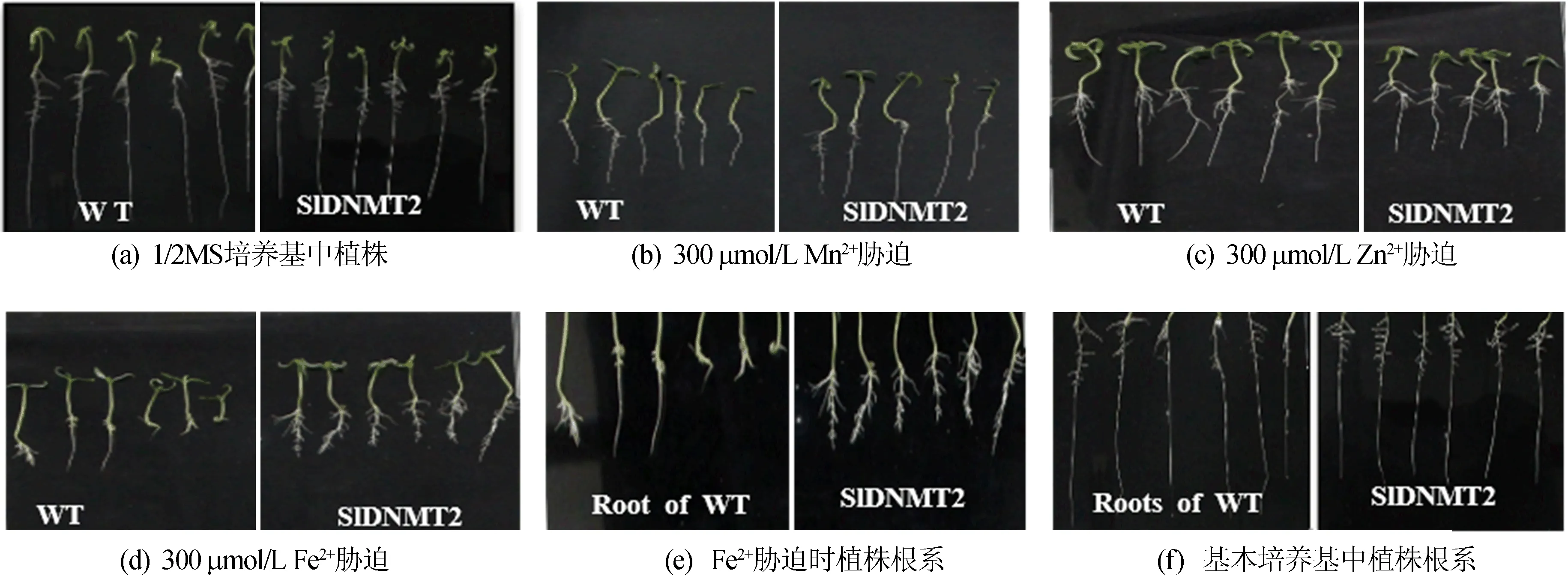
图8 重金属离子胁迫下的表型分析
从图9可以看出,300 μmol/L Zn2+条件下,野生型植株的高度比RNAi植物更长,且差异具有显著性。但是,1/2 MS、300 μmol/L Mn2+、300 μmol/L Fe2+培养条件下生长的植株高度并没有显著性差异。

图9 植株的高度统计结果
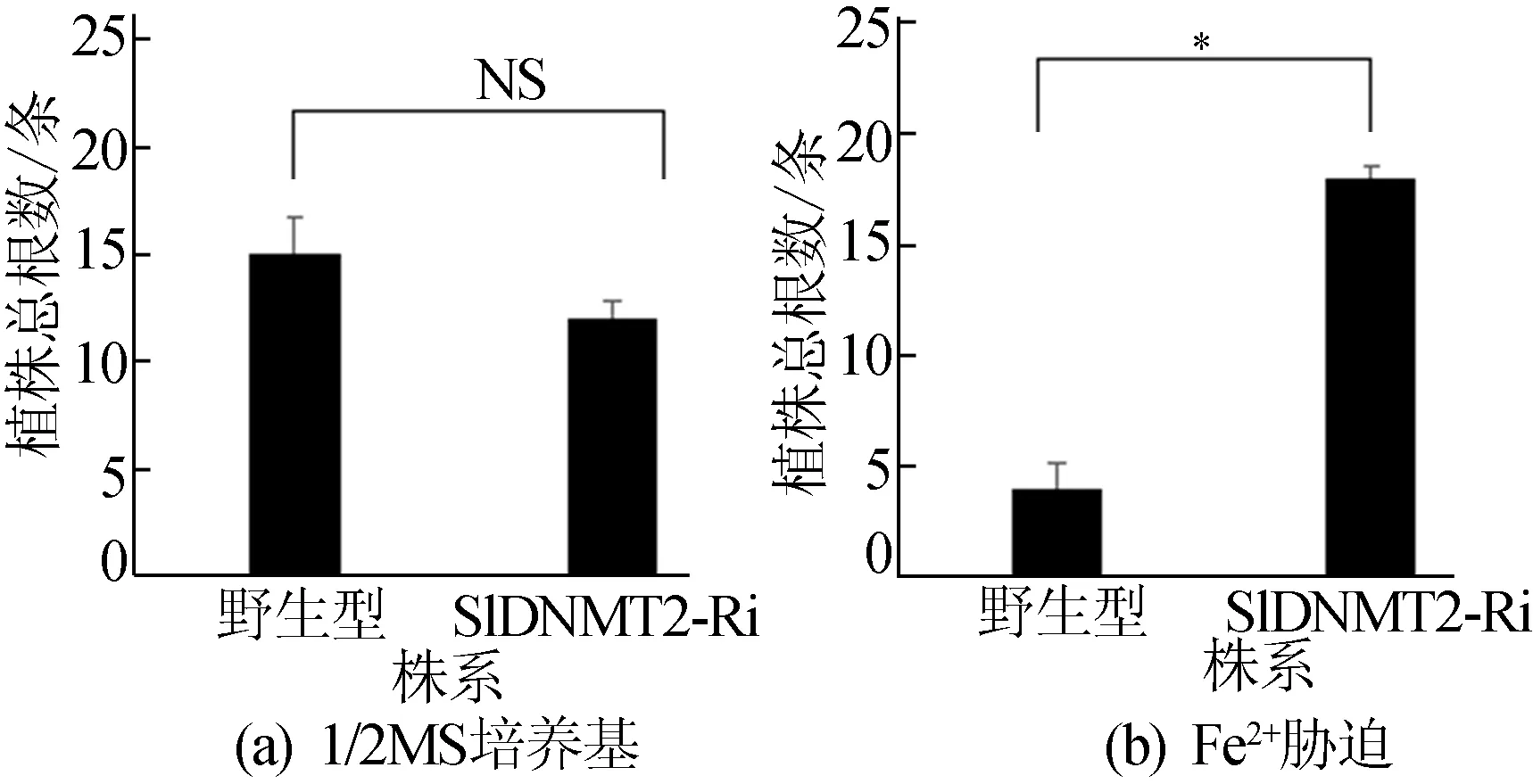
图10 植株根总数量统计
由图8e、图8f、图10可知,在1/2 MS培养基中,转基因和野生型植株根生长情况和根的总数量没有显著性差异;但是,300 μmol/L Fe2+处理时,转基因RNAi植物的根系比野生型更发达,统计根数量,差异具有显著性。以上结果表明当外源添加300 μmol/L Zn2+离子时,SlDNMT2可能参与正调控作用;当外源添加300 μmol/L Fe2+时,SlDNMT2可能参与负调控网络途径而发挥作用。
3 讨 论
植物通过DNA甲基化修饰作用调节相关基因表达,与植物生长发育、衰老、死亡密切相关。SlDNMT2是植物甲基化作用中的关键基因,本文通过基因差异表达分析实验,发现SlDNMT2基因在植物生长发育的9个重要时期均有表达,并且在叶和花时期表达量较高,说明SlDNMT2基因可能参与调节植物叶片和花器官的生长发育。
不同的胁迫处理会影响植物DNA甲基化水平的变化,在植物中,重金属离子胁迫使小麦、水稻叶片中DNA甲基化水平升高[19]。重金属离子胁迫处理可能影响三叶草植物中DNA甲基化的水平[20]。以上研究结果表明,DNA甲基化作用可能参与植物应对重金属离子胁迫应答途径。
4 结 论
本文通过分子克隆获得番茄植株SlDNMT2基因,该基因是合成DNA甲基化作用中关键酶的重要组成部分。通过遗传转化成功获得转基因RNAi植株,并发现300 μmol/L Zn2+胁迫对转基因RNAi植物影响作用比野生型更加显著。结果表明,SlDNMT2基因可能参与番茄植株对非生物胁迫(重金属离子胁迫)的响应途径。300 μmol/L Zn2+离子存在时,SlDNMT2基因可能参与正调控网络途径;而300 μmol/L Fe2+离子存在时,SlDNMT2基因可能参与负调控网络途径,因此,转基因植株对300 μmol/L Fe2+抗性更大。然而,在植物生长发育过程中,SlDNMT2基因调节植物细胞进行胁迫应答反应的机制及其在胁迫应答信号转导途径中的调控机制等问题仍需进一步研究。
