纳米银刺激黄孢原毛平革菌去除诺氟沙星
2022-05-06丁文东崔康平
丁文东, 崔康平, 郭 志
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
诺氟沙星(NOR)是废水中第2常见的氟喹诺酮类抗生素[1],已被广泛合成并用于治疗细菌感染、水产养殖和牲畜等领域[2],它们存在于污水处理厂、地表水、地下水甚至饮用水的流入[3]。诺氟沙星对微生物降解具有很强的抵抗力,并且由于其不易发生自然衰减,引起水环境、土壤、地下水等的富集[4],在环境中检测到的质量浓度可达到最大值[5](7 560 ng/L)。这些化合物不受控制地释放可能破坏水中重要的生物过程,并对水生和陆地生物构成潜在风险[6]。
纳米银(AgNPs)是商业产品中使用最广泛的纳米材料,因其具有高抗菌性能[7]被广泛用于生产日常必需品,包括纺织品、消毒医疗器械和家用电器[8]。由于纳米银技术的广泛应用,不可避免地直接或间接被排放到城市废水中,从而导致其在大气、水、土壤或生物环境中的积累、转化和降解[9],已经在天然水体和污水处理厂中检测到纳米银的存在。这对环境中的微生物具有负面影响,除了抗菌活性外,纳米银在生物处理过程中对一些水生生物和微生物群落具有较高毒性,特别是在水生环境中[10]。
AgNPs与抗生素已广泛存在于水体环境中,虽然目前对其产生的生物毒性已经有一些研究,然而在AgNPs和抗生素共存环境中的生物响应机制研究很少。因此本文对不同剂量AgNPs刺激NOR的生物去除进行评估,并通过抗氧化性酶活性的变化探究其机理,研究揭示AgNPs在废水中与NOR共存情况下对NOR生物去除的影响,对研究AgNPs在复杂水环境中的生物行为具有重要意义。
1 实 验
1.1 AgNPs的制备与表征
AgNPs的制备以文献[11]的方法为基础并加以修改,采用聚乙烯吡咯烷酮(PVP)作为稳定剂。本研究中,聚乙烯吡咯烷酮-纳米银(PVP-AgNPs)的合成路线如下:取4 mL聚乙烯吡咯烷酮(0.3%)和12 mL硼氢化钠溶液(15 mmol/L),冰浴下加入233 mL超纯水,搅拌下加入5 mL硝酸银溶液(20、40 mmol/L),搅拌3 min使其均匀反应后撤去冰浴,在室温(约20 ℃)下,使用540 r/min的磁力搅拌器将混合物进一步搅拌2 h,得到AgNPs溶液。生成的AgNPs通过1 kDa的透析袋去除多余的聚乙烯吡咯烷酮和银离子,纯化后放在42 ℃储存备用。
本研究采用火焰原子吸收光谱法测定所制备AgNPs的浓度,并利用紫外可见分光光度计、透射电子显微镜(transmission electron microscope,TEM)、动态光散射等手段表征本文合成的AgNPs材料的紫外可见吸收峰、流体动力学直径、表面电荷及晶体结构等。
1.2 黄孢原毛平革菌的培养
从中国典型培养物保藏中心(武汉)获得黄孢原毛平革菌AF-96007菌株,并储存在马铃薯葡萄糖琼脂培养基(200 g/L马铃薯提取物、20 g/L葡萄糖、20 g/L琼脂、3 g/L KH2PO4、1.5 g/L MgSO4·7H2O、8 g/L维生素B1),将孢子悬浮液转移到超纯水中,调节至2.0×106CFU/mL。然后将孢子悬浮液接种到液体培养基(0.211 g/L酒石酸铵、11.098 g/L葡萄糖、0.2 g/L KH2PO4、0.05 g/L MgSO4·7H2O、0.01 g/L CaCl2、1.641 g/L NaAc、0.5 mL/L维生素溶液、1 mL/L无机溶液)中。按上述方法将黄孢原毛平革菌培养3 d后,待其进入对数生长期后期,在锥形瓶中形成较为均匀的菌丝球。采集菌丝并用2 mmol/L NaHCO3缓冲溶液洗涤几次。
1.3 AgNPs对去除NOR的影响实验
利用配制好的0.1 mol/L NaOH和0.1 mol/L HNO3将培养3 d后黄孢原毛平革菌溶液的pH值调节为6.5,从而使除NOR的生物去除实验在最适pH值条件下进行。为了测定AgNPs浓度对黄孢原毛平革菌降解性能的影响,将0.5 g/L的黄孢原毛平革菌置于10 mg/L的NOR缓冲液中,并保持AgNPs初始浓度为0.01~60.00 μmol/L。在37 ℃、150 r/min条件下震荡培养,并于不同时间点取出小份试样进行NOR质量浓度的检测,同时还进行硝酸银的对照实验。另外,为了更进一步探究低浓度AgNPs对NOR的生物降解效果,在浓度为0.12 μmol/L的不同尺寸AgNPs(76、48 nm)刺激下,监测0.5 g/L的黄孢原毛平革菌置于10 mg/L NOR缓冲液中NOR的质量浓度变化。
NOR的质量浓度通过高效液相色谱法测定[12],采用紫外检测器和Eclipse xdb-c18柱进行分析。紫外检测器设置为275 nm,以甲醇和水的混合物(两者的体积比为2∶1)为流动相,流速为1 mL/min。
1.4 抗氧化性酶活的测定
抗氧化酶类是细胞抵御氧化胁迫的第1防御机制[13]。环境中的毒性物质会刺激抗细胞内抗氧化剂的产生,如抗氧化酶类超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及非酶类抗氧剂谷胱甘肽,以保护细胞组分免受ROS损伤。实验考察了10 mg/L的NOR处理的对照组、10.0 μmol/L银离子处理组以及10.00、0.10 μmol/L AgNPs处理组中SOD和CAT的酶活性。
离心收集胁迫后的黄孢原毛平革菌菌球,于0.05 mol/L的磷酸盐缓冲液(pH值为7.8)中破碎,将破碎后的菌浆于4 ℃、15 000 r/min离心10 min,离心后取上清液用于酶活测定。CAT的活性通过测定240 nm处吸光度的下降速率来表征其活性。3 mL的反应体系包括:0.2 mL的酶液、1 mL蒸馏水和1.5 mL 50 mmol/L的磷酸盐缓冲液(pH值为7)。将混合液于25 ℃预热后,加入0.3 mL 0.1 mol/L的H2O2启动反应,并立即记录240 nm处吸光度的变化情况,定义每分钟内的吸光度下降0.01为1个酶活单位。SOD酶活性测定采用氮蓝四唑(Nitro Blue Tetrazoliumchloride,NBT)比色法[14]。反应体系为:1 mmol/L NaCO3、200 mmol/L蛋氨酸、2.251 mmol/L NBT、 3 mmol/L EDTA、60 mmol/L核黄素和0.1 mol/L磷酸盐缓冲液(pH值为7.8)。向测定管中加入0.01 mL粗酶液,对照管则加入0.01 mL的磷酸缓冲液代替粗酶液,对照管和测定管各取2只,混合均匀后,把一支对照管放在暗处,其他置于30 μmol/(m2·s)日光灯下反应15 min,然后记录各管在560 nm的吸光度值。
2 结果与讨论
2.1 AgNPs的表征
针对不同尺寸AgNPs进行紫外可见光扫描,结果如图1a所示。从图1a可以看出,AgNPs在401 nm处有很强的特征吸收峰,关于AgNPs在自然水体中的稳定性也可以通过峰值大小的变化判断,当2种尺寸的AgNPs分散在自然水体中2 h后,溶液中的峰值发生了不同程度的变化。相比于超纯水,48 nm的AgNPs在自然水体中的吸光度减小8%,而76 nm的AgNPs减小3%。显然,小尺寸纳米银较不稳定,更容易溶解释放出银离子,但是这种释放都是微乎其微的。此外,在4 ℃的储存条件下,2个月后的AgNPs比刚合成的AgNPs特征峰值减小47%,但仍有较明显的特征峰,在6个月后峰值减小63%,特征峰已不明显。可见,合成的PVP-AgNPs在溶液中是缓慢溶解的过程,具有较长时间的稳定性。
电镜法是观察纳米材料的几何形貌、材料的颗粒度等方面最直观、最常用的方法,而材料的很多重要物理化学性质均由其形貌决定,因此对PVP-AgNPs进行TEM分析,结果如图1b所示。从图1b可以看出,实验合成的AgNPs呈颗粒状,形状分布较为均匀,在超纯水中是单分散的球形形状。
不同尺寸AgNPs流体动力学平均直径分布直方图如图2所示。从图2可以看出,实验中合成的AgNPs粒径分布较为分散,且2种不同硝酸银浓度(40、20 mmol/L)制备得到的纳米银在超纯水中的流体动力学平均直径分别为48.70、76.41 nm。另外,2种不同粒径AgNPs的zeta电位值分别为-12.70、-17.77 mV,电位值较大的更为稳定,这表明实验中所合成的大粒径的AgNPs较为稳定,较小粒径的AgNPs较不稳定且可能更容易在水环境中溶解释放出银离子,这与其在紫外可见光谱分析的结果相同。
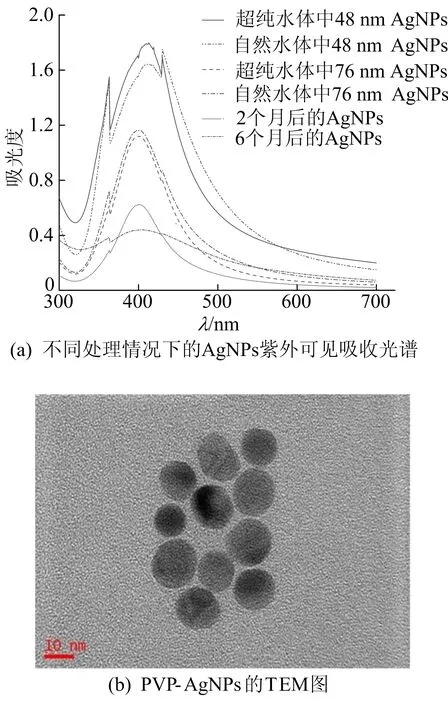
图1 AgNPs的表征分析
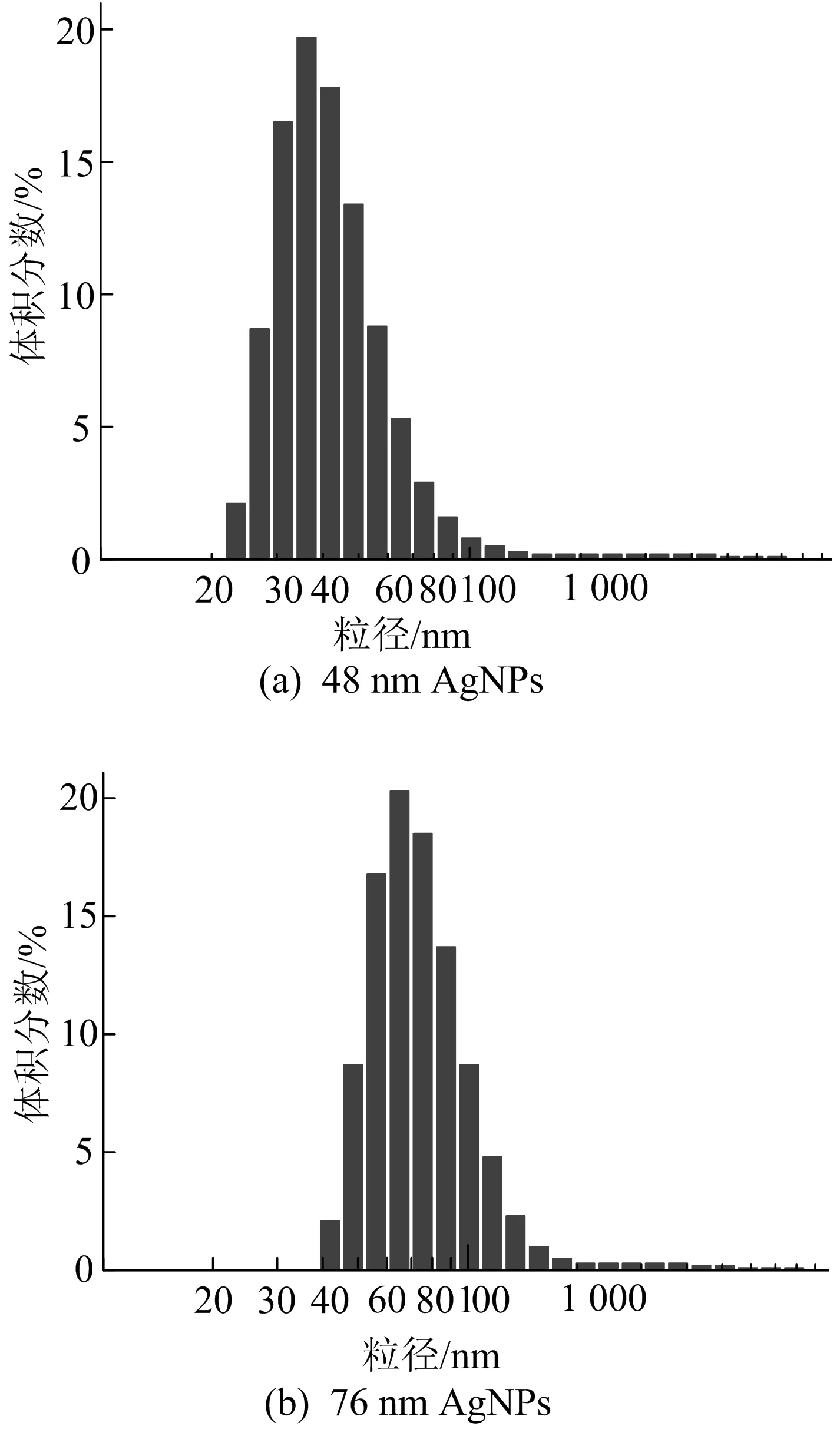
图2 不同尺寸AgNPs流体动力学平均直径分布直方图
2.2 AgNPs对NOR生物去除的影响
加入AgNPs后,NOR的去除率随时间的变化如图3所示。
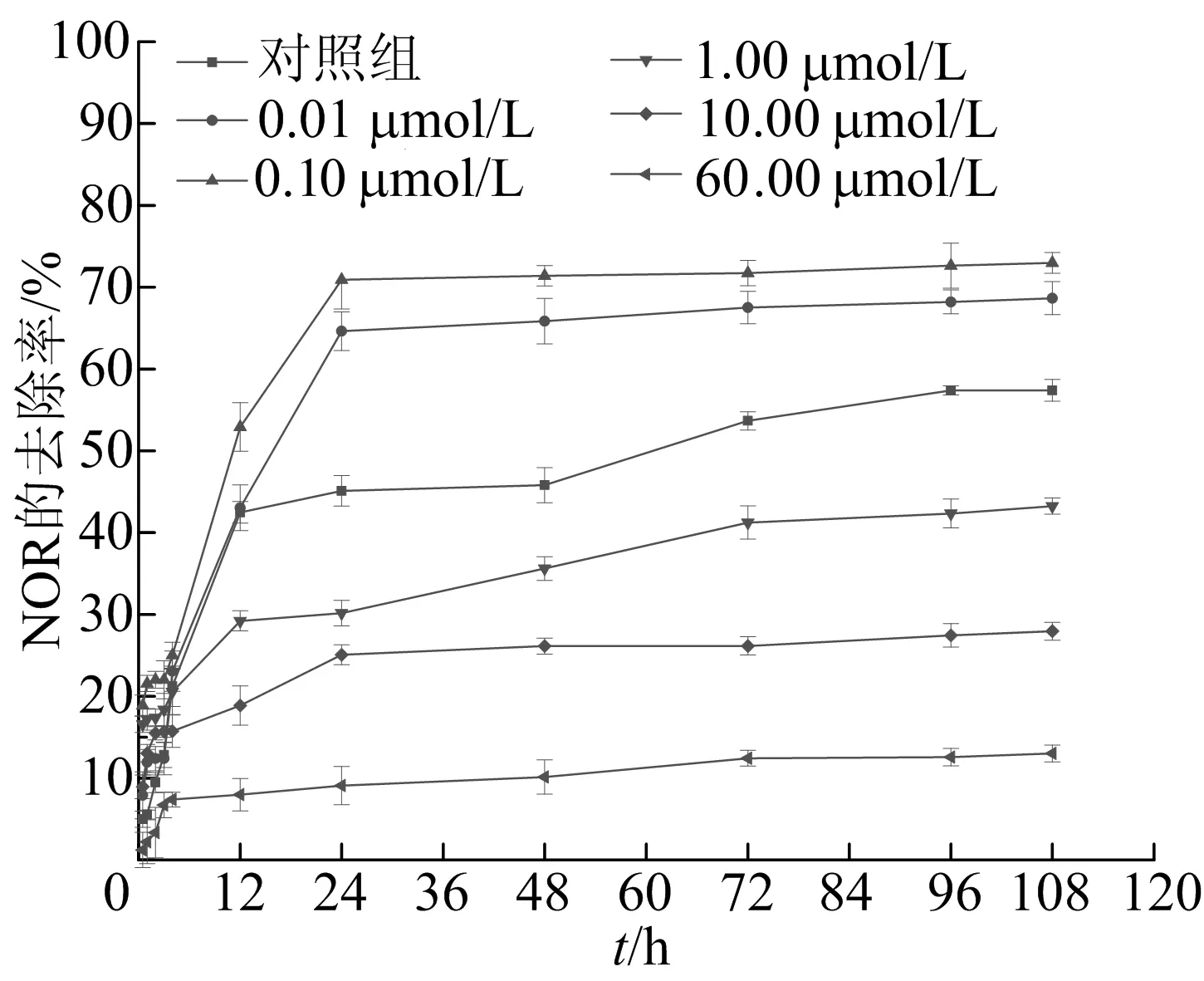
图3 AgNPs浓度对NOR去除效果的影响
从图3可以看出,NOR的生物去除均可在12 h内完成,在12 h后去除效果不明显。此外,随着AgNPs浓度的变化,NOR的去除率有显著变化。当AgNPs的初始浓度大于1.00 μmol/L时,NOR的去除率低于对照组的56%,且随着AgNPs初始浓度的增加而显著降低,在AgNPs浓度达到60.00 μmol/L时,NOR的去除率仅为13%,其生物去除作用受到了抑制。然而,当AgNPs初始浓度小于0.10 μmol/L时,NOR的去除率比对照组有所提高,可达73%。结果表明,较低浓度的AgNPs会对黄孢原毛平革菌产生毒物兴奋效应,即在一定范围内的低剂量致毒因素反而会使细胞兴奋,刺激微生物生长、抵御外部不利因素。AgNPs的毒物兴奋效应可能是由于其在低浓度下激活了毒性损伤的修复机制,这种修复过程可能对毒物的暴露进行过度补偿,从而加强对NOR生物降解[15]。另一方面,高浓度AgNPs明显抑制黄孢原毛平革菌的生物活性,AgNPs的毒性机制包括破坏膜完整性,使活性氧(reactive oxygen species,ROS)生成以及对能量代谢和基因转录的破坏,这些都可能与AgNPs本身或银离子的释放直接相关[16]。这也导致AgNPs在较高的初始浓度下,可能因AgNPs释放或溶解产生的银离子对NOR的生物去除产生抑制作用。
为了进一步探索AgNPs在低浓度下对NOR的生物去除效果,实验采用不同粒径的AgNPs,并监测其初始浓度在0.12 μmol/L下溶液中NOR去除率随时间的变化,如图4所示。由图4可知,76 nm AgNPs刺激下的NOR最大去除率为75%,而48 nm AgNPs刺激下的去除率为70%。可以发现,不同粒径AgNPs的初始浓度均在0.12 μmol/L对黄孢原毛平革菌产生毒物兴奋效应,可以增强对NOR的生物去除,相比对照组有明显的提高。不同的是,在48 nm AgNPs的刺激下,黄孢原毛平革菌对NOR的去除率迅速提高,24 h后去除率达到稳定水平。相比之下,在76 nm AgNPs的刺激下,NOR的生物去除过程持续48 h,并在之后较为稳定。结果表明,小尺寸AgNPs的刺激在低浓度更有效率,AgNPs可以通过“特洛伊木马效应”将离子或颗粒输送到细胞中,从而提高颗粒和离子在有机物和细胞中的渗透性和生物利用度[17]。通过这种方式,AgNPs可以很容易地进入细胞,而较小的颗粒更容易进入细胞,同时也具有更大的表面积和更多的连接位点,低浓度AgNPs产生毒物兴奋效应,对于NOR的去除效率较为明显。

图4 不同粒径AgNPs对NOR去除效果的影响
2.3 银离子对NOR生物去除的影响
银离子浓度对NOR去除效果的影响如图5所示,从图5可以看出,硝酸银的初始浓度为0.1、0.5、1.0、10.0、60.0 μmol/L时,NOR的最大去除率分别为41%、31%、28%、25%、22%。可以发现,在所有组别中,在最初的4 h内,NOR的去除率逐渐增加,在4 h之后NOR的去除率基本保持不变,去除率均显著低于对照组的57%。一般认为,银离子是对生物产生毒性作用最主要的机理,银离子可以连接在质膜和细胞内的含硫蛋白上,导致细胞膜的完整性被破坏、功能蛋白受损以及产生氧自由基[18]。暴露的银离子会与DNA碱基对反应,引起基因的损伤。然而当银离子被基团络合时,银离子则不具有毒性。因此在一开始黄孢原毛平革菌表面基团受到银离子的刺激与银离子络合,使银离子暂时不具有毒性,从而仍对NOR具有降解作用。然而,随着银离子浓度的升高,黄孢原毛平革菌对NOR的去除率越来越低。这是由于黄孢原毛平革菌菌丝表面基团对银离子的络合量有限,从而使更多的银离子暴露在细胞表面,对细胞产生毒性,抑制了细胞的活性以及对NOR的去除。显然,低浓度的银离子并没有显示出毒物兴奋效应,高浓度的银离子表现出对NOR生物降解较强的抑制作用。

图5 银离子浓度对NOR的去除效果影响
2.4 抗氧化行为分析
黄孢原毛平革菌细胞内的SOD和CAT酶活性对不同毒物胁迫响应随时间的变化情况如图6所示。从图6可以看出,当细胞只暴露于短时间(2 h)时,由于硝酸银和AgNPs的引入,SOD酶活性较对照组显著提高;暴露24 h后,硝酸银和高浓度AgNPs刺激下的SOD酶活性逐渐降低,而对照组和低浓度AgNPs的SOD酶活性逐渐升高。这表明硝酸银以及高浓度AgNPs释放出较多的银离子具有毒性,诱导细胞内的ROS水平急剧增加,促使细胞产生氧化应激,从而在短时间内可以产生较多的SOD。然而,24 h后SOD活性的下降被认为是一个消耗期。其抗氧化防御系统超载,抗氧化酶系无法消除大量产生的ROS,导致细胞结构严重损害甚至细胞死亡,SOD的进一步表达受限,从而表现出较低活性的SOD。相反,低浓度的AgNPs能刺激细胞内SOD的活性,催化细胞内超氧阴离子自由基歧化反应生成氧气和过氧化氢,对机体抗氧化平衡起重要作用。而CAT酶活性暴露于低浓度AgNPs后,表现出类似于SOD的变化,并逐渐增加,展现出较好的抗氧化应激能力。然而,与低浓度AgNPs胁迫后的变化相比,高浓度AgNPs和硝酸银刺激24 h后CAT酶活性要低得多。这可能是由于银离子抑制了CAT的生物合成或金属酶复合物的形成,从而导致CAT结构和酶活性的改变。
综上所述,银离子在短时间(2 h)内可以刺激细胞产生更多的SOD,但毒性作用或金属酶复合物的形成导致CAT酶生物合成受到抑制,造成抗氧化防御系统超载,导致慢性损伤甚至细胞死亡,对NOR生物去除产生抑制作用。相反,低浓度的AgNPs可以提高SOD和CAT的酶活性,而抗氧化酶活性的诱导是实现抗氧化应激的关键[19],即说明低浓度的AgNPs可以激活细胞诱导更多的抗氧化酶来增强抗氧化应激能力,从而实现了真菌对环境中NOR的生物去除。
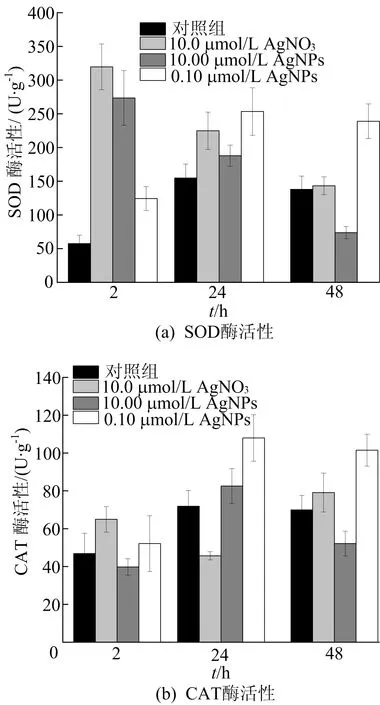
图6 抗氧化性酶随时间的变化
3 结 论
本实验探究了不同剂量AgNPs刺激黄孢原毛平革菌对NOR的去除效果。在0.10 μmol/L AgNPs的刺激下,NOR的生物去除率从对照组的56%提高至73%,而60.00 μmol/L AgNPs抑制NOR的生物去除,去除率仅为13%。AgNPs表现出高浓度抑制、低浓度促进的效果,而银离子仅表现出抑制作用。同时在0.12 μmol/L AgNPs的刺激下,76、48 nm AgNPs均能提高NOR的生物去除率,分别为75%、70%,尺寸较小的AgNPs对NOR的生物去除更有效率。通过抗氧化行为的分析,表明低浓度的AgNPs可以提高SOD和CAT的酶活性,可以增强抗氧化应激能力,从而实现了真菌对环境中抗生素的生物去除。
