经皮冠状动脉介入治疗联合经导管主动脉瓣置换术“一站式”手术在肝硬化失代偿期患者中的应用1 例
2022-05-06付源夏昆张智勇何冀芳徐立王乐丰
付源 夏昆 张智勇 何冀芳 徐立 王乐丰
1 临床资料
患者 男,66岁。因“劳累后胸闷气促5个月,加重伴双下肢肿胀1周”于2021年6月20日就诊于首都医科大学附属北京朝阳医院心内科。 5个月前活动后出现胸闷气促,伴咽部紧缩感,休息10 min左右症状可缓解,未进一步诊治。5个月来患者活动耐量逐渐下降,慢走约50 m即可出现上述不适。1周前患者双膝关节以下出现凹陷性水肿,夜间无法平卧,外院予口服利尿剂治疗,效果不佳,为进一步诊治收入我科。既往丙型肝炎肝硬化病史1年,口服肝爽颗粒(1袋/次,每日3次);2型糖尿病病史10余年,目前口服阿卡波糖(50 mg/次,每日3次)并应用胰岛素皮下注射,血糖控制尚可。入院查体:体温36.6℃,血压122/64 mmHg(1 mmHg=0.133 kPa),心率80次/分,神清,精神可,坐位,口唇无发绀,颈静脉无怒张,两肺呼吸音粗,双肺底可闻及少许湿啰音;心律齐,主动脉瓣听诊区可闻及4/6级收缩期吹风样杂音,向颈部传导;腹部查体无法配合,双膝以下可触及中度凹陷性水肿。入院心电图示:窦性心律,心室率约76次/分,Ⅰ、aVL、V2~V4导联T波倒置(图1)。经胸超声心动图(transthoracic echocardiography,TTE)示:左心室射血分数(left ventricular ejection fraction,LVEF)68%,主动脉瓣增厚、钙化伴重度狭窄(收缩期峰值流速476 cm/s,峰值压差90.6 mmHg,平均压差46 mmHg,瓣口面积1.0 cm2),左心房增大(前后径43 mm,左右径41 mm,上下径54 mm),左心室肥厚(室间隔厚度14 mm,后壁厚度14.4 mm),左心室舒张末期内径53 mm,三尖瓣轻度反流。冠状动脉CT血管造影(computed tomography angiography,CTA)示:冠状动脉粥样硬化改变,总钙化积分427分;左前降支(left anterior descending,LAD)近中段多发局限性轻度狭窄,局部管腔中重度狭窄,中远段多发局限性轻度狭窄;第二、三对角支管腔重度狭窄,起始部显著;左回旋支(left circumflex,LCX)局限性中重度狭窄;右冠状动脉远段管腔局限性轻中度狭窄;冠状动脉肺动脉瘘可能。实验室检查示:白细胞计数2.99×109/L[参考值:(3.5~9.5)×109/L],红细胞计数2.46×1012/L[参考值:(4.3~5.8)×1012/L],血红蛋白68 g/L(参考值:130~175 g/L),血小板计数60×109/L[参考值:(125~350)×109/L],白蛋白30.2 g/L(参考值:40~55 g/L),谷草转氨酶、谷丙转氨酶、血肌酐、动态红细胞沉降率和超敏C反应蛋白均未见明显异常,B型利钠肽(B-type natriuretic peptide,BNP)452 pg/ml(参考值:<100 pg/ml),心肌肌钙蛋白I(cardiac troponin I,cTnI)0.45 ng/ml(参考值:<0.04 ng/ml),活化部分凝血活酶时间31 s(参考值:23.3~32.5 s),凝血酶原时间14.9 s(参考值:9.6~13 s),国际标准化比值1.32(参考值:0.8~1.2),D-二聚体1.16 mg/L FEU(参考值:≤0.55 mg/L FEU)。入院诊断:重度主动脉瓣狭窄(aortic stenosis,AS),冠状动脉粥样硬化性心脏病(冠心病),纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅳ级,丙型肝炎肝硬化(失代偿期),脾功能亢进,白细胞减少,中度贫血,血小板减少,2型糖尿病。患者胸外科医师协会(Society of Thoracic Surgeons,STS)评分7.47%,考虑外科手术风险极高。经心脏团队与患者及其家属讨论后,决定行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)联合经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)“一站式”手术。术前主动脉CTA示:三叶式主动脉瓣轻度钙化, 主动脉瓣环内径22.1 mm×28.4 mm,周长78.9 mm(图2A),主动脉窦部内径31.6 mm×32.4 mm×32.0 mm(图2B),升主动脉内径28.9 mm×30.3 mm(图2C),左冠状动脉和右冠状动脉的高度分别为17.8 mm(图2D)和18.9 mm(图2E)。
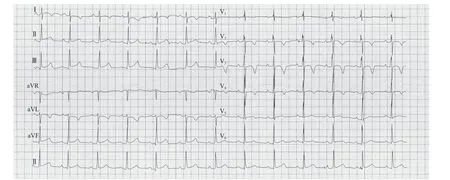
图1 入院心电图
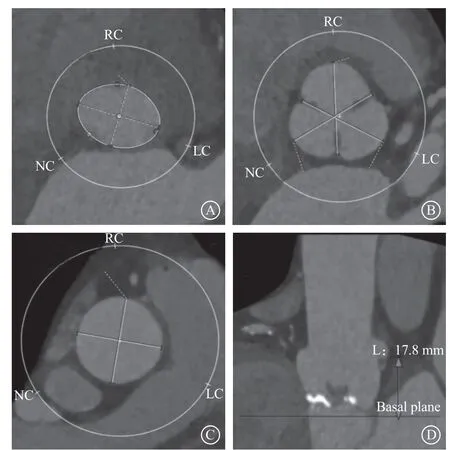
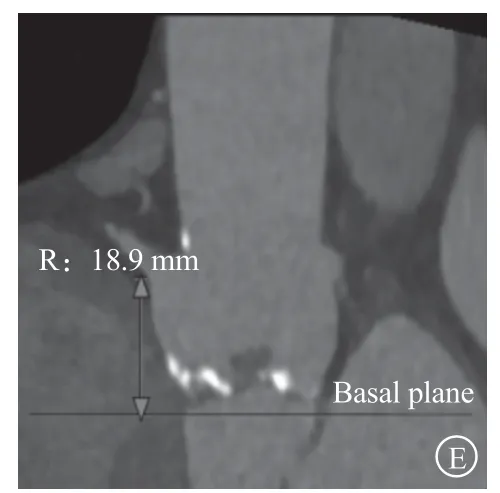
图2 术前主动脉CT 血管造影评估患者主动脉瓣解剖结构参数A.主动脉瓣环水平,呈椭圆形,内 径22.1 mm×28.4 mm, 周 长78.9 mm;B.主动脉窦部水平,内径31.6 mm×32.4 mm×32.0 mm;C.升主动脉水平,内径28.9 mm×30.3 mm;D.主动脉瓣轻度钙化,左冠状动脉高度17.8 mm;E.右冠状动脉高度18.9 mm
围术期给予患者阿司匹林(100 mg、每日1次)+氯吡格雷(75 mg、每日1次)双联抗血小板,普伐他汀(20 mg、每日1次)降脂,阿卡波糖(50 mg、每日3次)+皮下注射胰岛素控制血糖、泮托拉唑钠肠溶片(40 mg、每日1次)+吉法酯(50 mg、每日3次)预防消化道出血,以及纠正贫血和利尿等治疗。2021年7月8日患者于杂交手术室,在全身麻醉下,通过TTE引导行PCI联合TAVR “一站式”手术。经右颈内静脉路径植入临时起搏器至右心室心尖,穿刺左股动脉置入6 F股动脉鞘管,送入JL 4.0导管用于协助定位及血流动力学监测;经右股动脉路径先行置入2把Proglide血管缝合器进行预处理,后置入11 F股动脉鞘管。经左股动脉先后以5 F JL 4.0及JR 4.0导管行冠状动脉造影示:冠心病,三支病变,LAD近中段90%~95%弥漫性狭窄,第二对角支开口90%局限性狭窄,LCX中段90%节段性狭窄,左心室后支中段60%~70%节段性狭窄,冠状动脉肺动脉瘘(图3)。根据造影结果,决定先干预LAD及LCX病变。经左股动脉鞘管送EBU 3.5指引导管至左冠状动脉开口,先后于LAD近中段及LCX中段病变处置入GuReater 3.0 mm×36 mm和GuReater 2.75 mm×12 mm支架(乐普医疗器械股份有限公司)各1枚,支架 后扩张后多体位造影示支架膨胀完全,贴壁良好,无残余狭窄(图4)。冠状动脉病变处理结束后,同期行TAVR。沿右侧11 F股动脉鞘管送入5 F AL 2导管至主动脉窦底,测量升主动脉压力为120/55 mmHg,交换Roadrunner 0.035 in(1 in=2.45 cm)直头超滑导丝跨主动脉瓣至左心室,跟进AL 2导管至左心室,测量左心室内压力为140/8 mmHg,经AL 2导管交换Lunderquist超硬导丝至左心室,撤出AL 2导管,后撤出11 F股动脉鞘管,沿超硬导丝置入Gore 20 F长鞘,经左侧股动脉鞘管送6 F猪尾导管至升主动脉窦底,选工作体位,经右股动脉鞘管延超硬导丝送入MED Ⅱ 25 mm×40 mm球囊(NuMED公司)至主动脉瓣水平,快速起搏(130次/分)下行瓣膜预扩张,后退出球囊,沿超硬导丝送入Venus-AL 29瓣膜支架(杭州启明医疗器械有限公司)跨主动脉瓣,在猪尾导管主动脉造影指引下,快速起搏(150次/分)并逐步释放瓣膜支架(图5)。主动脉造影示瓣膜支架位置固定良好,未见冠状动脉堵塞(图6)。TTE示:瓣膜支架扩张完全,瓣膜启闭良好,无瓣膜反流及瓣周漏,收缩期主动脉瓣流速为210 cm/s,平均跨瓣压差19 mmHg。再次通过猪尾导管测量升主动脉及左心室内压力分别为130/56 mmHg和 119/10 mmHg。撤出导丝,Proglide缝合右股动脉,保留临时起搏器,术后转入冠心病重症监护室观察病情变化。术后24 h复查BNP为 101 pg/ml。复查TTE示: LVEF 70%,主动脉瓣收缩期峰值流速201 cm/s,峰值压差16.5 mmHg,左心室舒张末期内径42 mm,均较术前有明显改善。术后48 h内无束支传导阻滞及房室传导阻滞发生,拔除临时起搏器,转至普通病房,术后第4天平稳出院。出院后给予患者阿司匹林(100 mg、每日1次)+氯吡格雷(75 mg、每日1次)双联抗血小板治疗,由于患者同时合并肝硬化及三系减少,消化道出血风险较高,继续给予患者泮托拉唑钠肠溶片及胃黏膜保护剂1个月,并拟于6个月后改为予阿司匹林(100 mg、每日1次)单抗血小板治疗。术后2个月门诊随访,患者无明显不适主诉,查体可触及双侧足踝部和胫前轻度凹陷性水肿。实验室检查示:白细胞计数3.04×109/L,红细胞计数3.02×1012/L,血红蛋白82 g/L,血小板计数62×109/L,D-二聚体1.21 mg/L FEU。复查TTE示:左心室舒张末期内径46 mm ,LVEF 66%,主动脉瓣收缩期峰值流速216 cm/s,峰值压差18.2 mmHg。2022年1月5日患者门诊再次随访,无明显不适主诉,查体可闻及双肺底少许湿啰音,右足踝部和胫前轻度凹陷性水肿。实验室检查示:白细胞计数3.15×109/L,红细胞计数3.08×1012/L,血红蛋白90 g/L,血小板计数62×109/L,D-二聚体1.32 mg/L FEU,BNP 416 pg/ml,cTnI 0.36 ng/ml。复查TTE示:左心室舒张末期内径47 mm,LVEF 64%,主动脉瓣收缩期峰值流速218 cm/s,峰值压差18.7 mmHg。
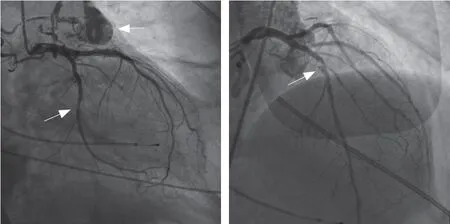
图3 冠状动脉造影示左前降支及左回旋支存在明显狭窄,可见冠状动脉肺动脉瘘(箭头所示)
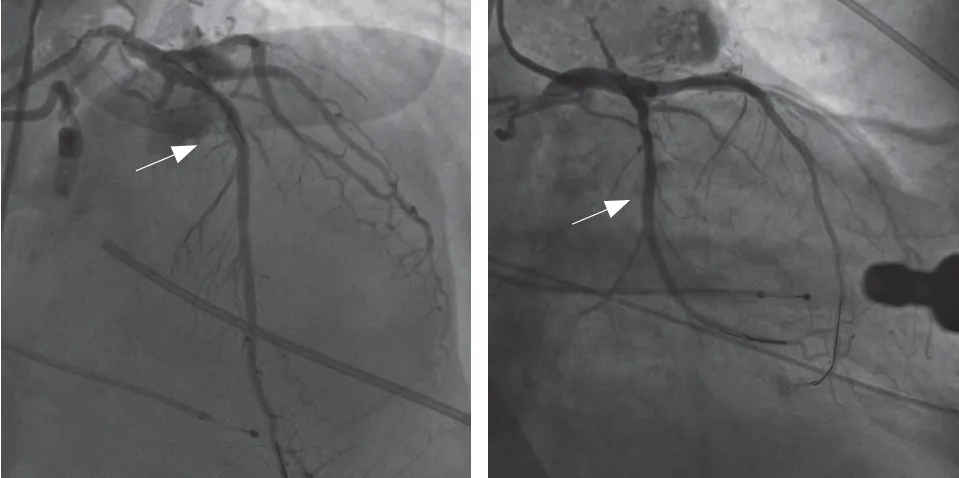
图4 冠状动脉支架置入后造影示支架膨胀完全,贴壁良好,无残余狭窄(箭头所示)
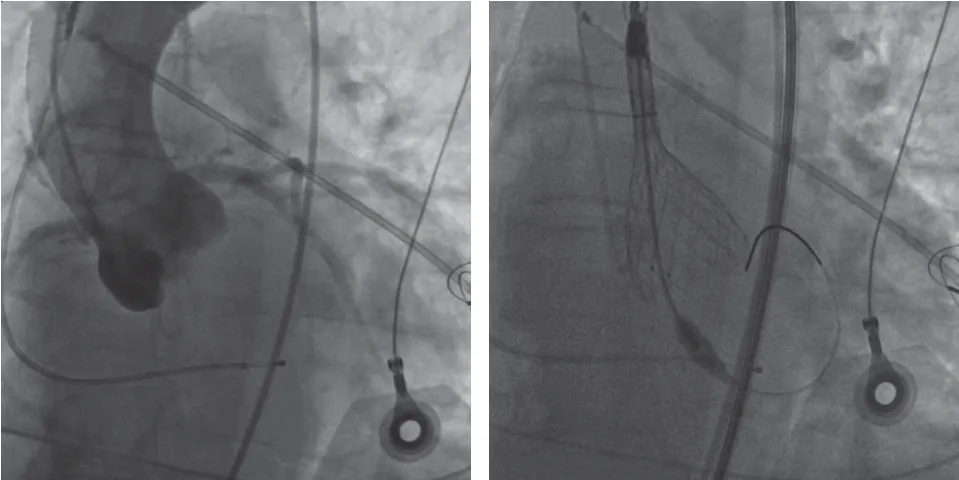
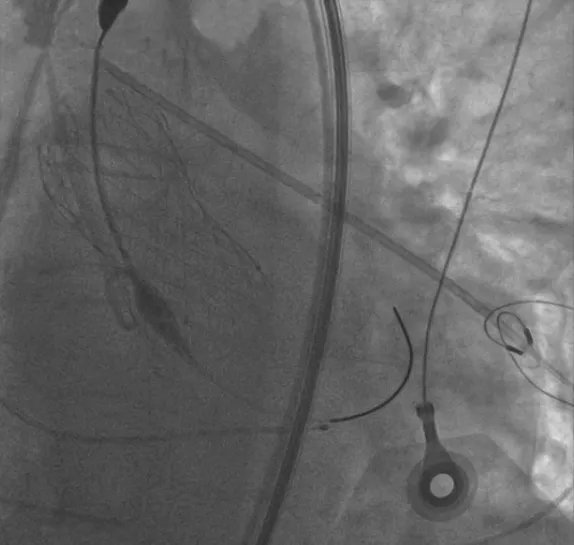
图5 猪尾导管主动脉造影指导下逐步释放Venus-A L29 瓣膜支架
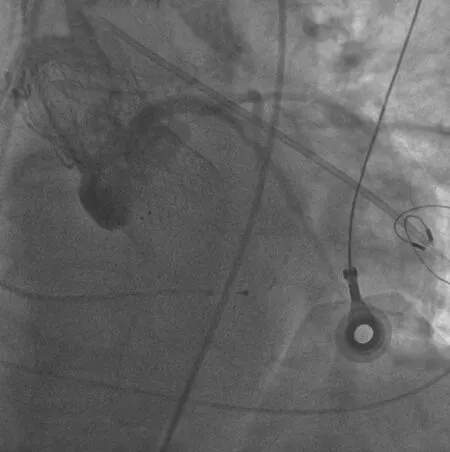
图6 瓣膜支架置入后主动脉造影示瓣膜支架位置固定良好,无冠状动脉闭塞
2 讨论
AS是老年人群最常见的心脏瓣膜病之一,其发病率随年龄的增长逐渐增高[1-2]。AS患者可多年无明显症状,但当重度AS患者出现心绞痛、心力衰竭以及晕厥等临床症状时,若采取保守治疗,患者2年死亡率可高达50%[3-4]。TAVR目前已成为存在外科手术禁忌或手术中、高风险的症状性重度AS患者的一线治疗方案[2,5-7]。既往研究显示,在接受TAVR治疗的人群中,15%~80%同时合并冠心病,且随着外科手术风险的升高(STS评分的升高),患者合并冠心病的概率也逐渐增加[6,8-10]。合并冠心病的AS人群中,有近50%的患者具有血运重建适应证。尽管观察性研究尚未证实PCI对合并冠心病的AS患者有明显临床获益,但Meta分析显示,合并复杂冠状动脉病变的AS患者,应用TAVR+药物保守治疗的方式会明显增加患者的远期死亡率[11-13]。因此,与单纯药物治疗相比,目前指南和共识更建议冠状动脉近段狭窄>70%的AS患者行PCI[1,5]。
合并冠心病的重度AS患者接受PCI的最佳时机目前仍存在争议。我国AS患者的主动脉瓣叶钙化较重,且二叶式主动脉瓣所占比例高,行TAVR时更多应用自膨胀式瓣膜,瓣膜的长度较长且释放位置较高,增加了TAVR术后再行PCI的难度[10,14-15]。与此同时,由于TAVR过程可能会增加冠状动脉病变的缺血风险,甚至造成血流动力学不稳定,因此TAVR术前先行PCI,或PCI联合TAVR“一站式”手术治疗更为业内所认可。多项研究也证实了此两种手术方式的安全性及可行性[10,14,16-17]。对于LVEF明显减低(<30%)或者STS评分>10%的患者而言,其接受PCI的风险明显增加,此时更建议行PCI联合TAVR“一站式”手术治疗[18]。然而,目前尚无肝硬化失代偿期患者接受PCI联合TAVR“一站式”手术治疗的相关报道。
我国的肝硬化患者人群超过700万,病毒性肝炎是其最主要的病因之一[19]。根据疾病的进展,肝硬化又可分为代偿期和失代偿期,一旦患者出现肝功能异常和门脉高压等表现,则提示肝硬化已进入失代偿期[20]。失代偿期是肝硬化患者的终末阶段,其5年生存率不足40%,而一旦发展为肝细胞癌,其1年内死亡率可高达33%[21-22]。本例患者年龄为66岁,且有接受肝移植等进一步治疗肝硬化的明确意愿,心脏团队充分评估患者病情后决定行PCI联合TAVR“一站式”手术。一方面可以减轻患者机体对多次手术操作的应激反应,减少消化道出血和心脑血管事件的发生率;另一方面又可以缓解患者心脏瓣膜及冠状动脉病变的严重程度,为其日后进一步接受肝移植等手术治疗排除相关禁忌,赢得机会。
PCI联合TAVR“一站式”手术的操作过程目前尚无统一顺序,可根据患者具体临床情况的不同,先行处理冠状动脉病变后再行TAVR,也可先行主动脉瓣跨瓣步骤,留置导丝于左心室,以便在处理冠状动脉病变时患者如发生血流动力学不稳定,可紧急行主动脉瓣球囊扩张甚至瓣膜置入术[1,8,17]。既往研究还提示,PCI联合TAVR“一站式”手术可先行主动脉瓣球囊扩张改善瓣膜狭窄及血流动力学再行PCI,以此降低冠状动脉缺血和手术风险[18,23],但操作前应注意患者主动脉瓣反流情况,避免扩张主动脉瓣后加重瓣膜反流,导致左心室前负荷增加,引发急性心力衰竭甚至循环崩溃[9,23]。本例患者冠状动脉造影结果示LAD和LCX的病变相对简单,于是采用第一种操作方式,即先快速完成PCI后再行TAVR的相关操作,患者的血流动力学在手术全程中始终保持平稳。
T T E 和经食管超声心动图(transeso phageal echocardiography,TEE)是TAVR术中及术后,评估置入瓣膜释放位置、效果及有无瓣周漏和瓣膜反流等并发症的重要参考[24-25]。由于TEE操作相对便利,TAVR术中更多采用TEE来指导手术的进行[1]。因本例患者同时合并肝硬化和脾功能亢进等临床情况,外院胃镜检查明确提示存在食管胃底静脉曲张,为了避免TEE损伤食管胃底静脉造成消化道大出血,术中选择TTE来指导TAVR的实施。与此同时,本例患者三系明显减低,出血风险较高,根据相关指南和共识[1,5,26],在围术期和术后给予患者阿司匹林(100 mg、每日1次)联合氯吡格雷(75 mg、每日1次)的双联抗栓方案,并拟于术后6个月后改为口服阿司匹林(100 mg、每日1次)单抗血小板治疗。除此之外,术中始终维持患者的收缩压在大约100 mmHg水平,活化凝血时间在250~300 s,保证手术抗栓需求的同时进一步减少患者的出血风险[27]。
本例手术为国内首次报道PCI联合TAVR“一站式”手术在肝硬化失代偿期,同时合并脾功能亢进及三系减低的高风险患者中的实施,术后6个月患者预后良好,无不良事件发生,更长期结局有待进一步随访观察。希望本例手术的成功可以为此类特殊高危患者的治疗提供一定的参考。利益冲突 所有作者均声明不存在利益冲突
