黑果枸杞高效植株再生与遗传转化体系的建立
2022-05-06安迎瑞郎思睿
张 虹 安迎瑞 张 君 郎思睿 陈 任
(宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室/宁夏优势特色作物现代分子育种重点实验室, 宁夏 银川 750021)
黑果枸杞(LyciumruthenicumMurray)为茄科枸杞属多棘刺灌木,多分布于干旱盐碱的荒漠与半荒漠地区,具有防治水土流失、防风固沙、盐碱地改良等生态防治作用[1-3]。在药用保健方面,黑果枸杞富含多糖、氨基酸、维生素、矿物质等多种营养成分[4-5]。此外,黑果枸杞含有天然原花青素,是一种能够有效消除人体内自由基的天然抗氧化剂,同时花色苷具有抗辐射及减少细胞凋亡作用[6-8]。黑果枸杞的药用和保健价值高于红枸杞,被誉为植物“软黄金”[9-10]。因此,黑果枸杞是具有环境保护、药用和经济价值的树种[11]。采用生物技术挖掘黑果枸杞种质资源库优良性状基因,并将其应用于品种改良是黑果枸杞产业链持续发展的源头工程,建立高效稳定的黑果枸杞转化体系可以为这一工程提供技术基础。
近年来,关于宁夏枸杞种内品种的遗传转化建立有较多的研究,并取得了相应的成果。如赵亚华等[12]采用根癌农杆菌介导法将外源基因转入枸杞幼茎,经分析检测,转基因植株中的锌含量是对照的2倍多。杜国利等[13]利用含有目的基因的农杆菌侵染枸杞叶片,经免疫细胞化学方法检测,初步建立了具有HIV壳体蛋白表达转基因系统。刘丹如等[14-15]对杜国利的研究进一步优化,建立了利用转基因枸杞毛状根进行外源HIV-1壳体蛋白表达的系统。虽然上述研究都获得了转基因宁夏枸杞,但阳性植株获得率极低,极大地限制了枸杞分子生物学的研究。王静等[16]以黑果枸杞下胚轴为外植体材料建立了农杆菌介导的遗传转化方法,对外源基因转化植株进行检测分析,阳性转化率为16%,但以植株下胚轴为实验材料,存在取材成本较高的限制。本试验以黑果枸杞叶片为材料,采用农杆菌介导转化法将外源绿色荧光选择标记(synthetic green-fluorescent protein with S65T mutation,sGFP)基因导入黑果枸杞,经愈伤组织、不定芽诱导和抗生素选拔以及生根培养,将获得的再生植株经PCR鉴定,确定阳性转基因植株导入外源基因的表达量,从而建立一套高效的黑果枸杞遗传转化体系,旨在为今后利用基因工程培育黑果枸杞新品种奠定技术基础。
1 材料与方法
1.1 试验材料
供试材料为宁夏大学生命科学学院基因工程实验室继代保存黑果枸杞无菌苗,根癌农杆菌(Agrobacteriumtumefaciens)菌株EHA105购自北京全式金,双元质粒载体pKAFCR21为本实验室构建用于外源基因过表达研究,携带有新霉素磷酸转移酶(neomycin phosphotransferase Ⅱ, NPT Ⅱ)、潮霉素(hygromycin phosphotransferase, HPT)2个抗生素耐性基因,以及β-葡萄糖醛酸苷酶(β-glucuronidase, GUS)、绿色荧光蛋白(synthetic green-fluorescent protein with S65T mutation, sGFP)2个标记基因,用于遗传转化时的选拔和条件优化[16]。
1.2 黑果枸杞再生体系的建立
1.2.1 外植体的选择 将黑果枸杞叶片切至0.5 cm×0.5 cm大小,茎段0.5 cm,茎节0.5 cm,分别接种到植物组织培养用基本培养基(Murashige and Skoog, MS)+ 0.2 mg·L-1萘乙酸(1-naphthaleneacetic acid, NAA)+ 0.5 mg·L-16-苄腺嘌呤(6-benzylaminopurine, BAP)的愈伤组织和不定芽诱导培养基上,每皿接种25个外植体,每种外植体接种3皿,25℃光照培养4周。
1.2.2 激素浓度的选择 将黑果枸杞叶片切至0.5 cm×0.5 cm大小,接种到不同激素浓度(见表3)组合的NAA和BAP的MS培养基上。25℃光照培养4周,观察愈伤组织及不定芽生长情况,并统计出愈率和出芽率。
1.2.3 生根培养 将愈伤组织分化的不定芽切下,接种到1/2 MS培养基上进行生根培养,15 d后根据生根植株数量计算生根率。
1.3 黑果枸杞遗传转化体系的建立
将黑果枸杞叶片切成0.5 cm×0.5 cm大小,置于OD600为0.25的农杆菌侵染液(MS + 20 mg·L-1sucrose + 0.5 mg·L-1NAA + 0.3 mg·L-1BAP + 20 mg·L-1acetosyringone, pH值5.8)中分别侵染5、10、15 min后,用无菌滤纸吸去多余菌液,将其放入共培养基(MS + 20 mg·L-1sucrose + 0.5 mg·L-1NAA+ 0.3 mg·L-1BAP + 20 mg·L-1acetosyringone + 7 g·L-1agar, pH值5.8)中共培养3 d;共培养结束将叶片转移至含有不同浓度组合的卡那霉素(kanamycin)和羧苄西林(carbenicillin)的愈伤组织和不定芽诱导选拔培养基(MS + 20 mg·L-1sucrose + 0.5 mg·L-1NAA + 0.3 mg·L-1BAP +7 g·L-1agar, pH值5.8)中,3周后经MZ10F荧光显微镜(Leica,德国)筛选,将有荧光的抗性愈伤组织及不定芽转移至相同成分的继代增殖培养基上,待抗性不定芽伸长后切成单株,转移至1/2 MS生根培养基上进行生根培养。观察愈伤组织及不定芽生长情况,并统计出愈率和出芽率。
出愈率=愈伤组织个数/每种供试外植体总数×100%
出芽率=长出不定芽的愈伤组织个数/愈伤组织总数×100%
阳性愈伤率=表达sGFP的愈伤组织个数/愈伤组织总数×100%
生根率=生根苗/不定芽总数×100%
转化率=阳性转基因植株数/总再生植株数×100%
1.4 黑果枸杞遗传转化植株的鉴定
1.4.1 转基因植株的PCR鉴定 转基因再生植株用AD301 TransDirect Plant Tissue PCR Kit(北京全式金生物技术)提取基因组DNA。利用PCR方法鉴定导入的基因片段,根据sGFP基因序列设计PCR特异引物(表1),扩增的目的片段大小为610 bp,扩增时以未转化植株叶片基因组DNA为阴性对照,质粒pKAFCR21为阳性对照。反应体系20 μL:DNA模版2 μL, 2×PCR Master Mix(with dye)10 μL,正反引物各1 μL,ddH2O 6 μL,所用试剂购自北京全式金生物技术有限公司;反应程序为:94℃预变性 5 min,94℃ 变性30 s,60℃退火30 s,72℃复性30 s,共32个循环,72℃延伸7 min,扩增产物经1%琼脂糖凝胶电泳。
1.4.2 转基因植株的sGFP表达量检测 利用RE-05021植物多糖多酚总RNA提取试剂盒(成都福际生物技术)分别提取转基因植株和未转基因植株RNA,为确保提取的RNA样品本无DNA污染,在提取过程中加入DNase Ⅰ处理步骤。通过NanoDrop 2000(Thermo Fisher Scientific)测定RNA浓度,各个样本RNA在确认提取检测纯度和完整性后稀释成40 ng·μL-1。同时取各个样本提的总RNA,混合后按4倍数稀释成200、50、12.50、3.13、0.78、0.20 ng·μL-16个浓度作为标准线材料。
利用各个样本提取的总RNA(40 ng·μL-1),使用HiScript Ⅱ 1st Stand cDNA Synthesis Kit(R212-01, 南京诺唯赞生物科技)试剂盒进行反转录合成cDNA,用于后续使用qTOWER3G实时荧光定量PCR仪(德国Analytik Jena)进行扩增。
以黑果枸杞甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)基因为内参,采用Primer Express 3.0(Premier Biosoft,美国)软件设计内参LrGADPH与sGFP荧光定量用引物序列(表1)。

表1 PCR扩增引物
实时荧光定量PCR结束后,根据程序给定的本底基准线PCR Baseline Subtracted(PCR增殖达对数阶段),从扩增曲线上读取每个基因在各个样本的循环阈值(cycle threshold, Ct),然后根据标准线,获得每个基因在各个样本的起始质量SQ值(starting quantity)。通过每个基因与内参基因SQ的比值,计算出目的基因在各个样本的质量(视为基因相对表达量)和标准差。
1.5 数据统计与分析
采用Excel 2016对数据均值及标准偏差进行分析,采用SPSS 16.0进行多重比较。
2 结果与分析
2.1 黑果枸杞再生体系的建立
2.1.1 不同外植体愈伤组织和不定芽的诱导 将黑果枸杞叶片、茎节、茎段接种到愈伤组织和不定芽诱导培养基上,4周后,不同外植体分化出的愈伤组织形态不同。由叶片分化而来的愈伤组织结构较为紧密;由茎段分化而来的愈伤组织结构较为疏松,易玻璃化;而茎节叶腋处不经愈伤组织的形成可直接分化出大量不定芽(图1)。不同外植体的愈伤组织形成效率不同,茎段的出愈率最高,其次为叶片,茎节出愈率最低。将不同外植体分化的愈伤组织进行继代培养,不同外植体来源的愈伤组织出芽效率不同,叶片愈伤组织出芽率最高,茎段愈伤组织出芽率次之,茎节愈伤组织出芽率最低(表2)。

注: A: 叶片分化; B: 茎段分化; C: 茎节分化; D: 愈伤组织增值; E: 不定芽; F: 不定芽生根。标尺:15 mm。

表2 不同外植体的再生效率
2.1.2 不同激素浓度组合对叶片愈伤组织及不定芽诱导的影响 将黑果枸杞叶片接种到不同浓度的NAA与不同浓度BAP配比的培养基上,进行愈伤组织和不定芽诱导培养基的优化,培养4周后,出愈率和出芽率最适宜的培养基为MS+0.5 mg·L-1NAA+0.3 mg·L-1BAP(表3)。

表3 不同激素浓度对叶片外植体再生的影响
2.1.3 生根诱导 将愈伤组织分化的不定芽切下,接种到1/2 MS + 20 mg·L-1蔗糖+ 7 g·L-1琼脂(pH值5.8)培养基上进行生根诱导,15 d后,生根率为95%(图1-F)。
2.2 黑果枸杞遗传转化体系的建立
2.2.1 农杆菌侵染时间的确定 将黑果枸杞叶片经5、10、15 min不同时间侵染,共培养3 d后,接种到含25 mg·L-1卡那霉素以及250 mg·L-1羧苄西林的愈伤组织和不定芽诱导选拔培养基上培养4周后,荧光显微镜检测sGFP基因表达情况,结果表明,不同侵染时间获得的转基因愈伤组织数量无显著差异(表4)。
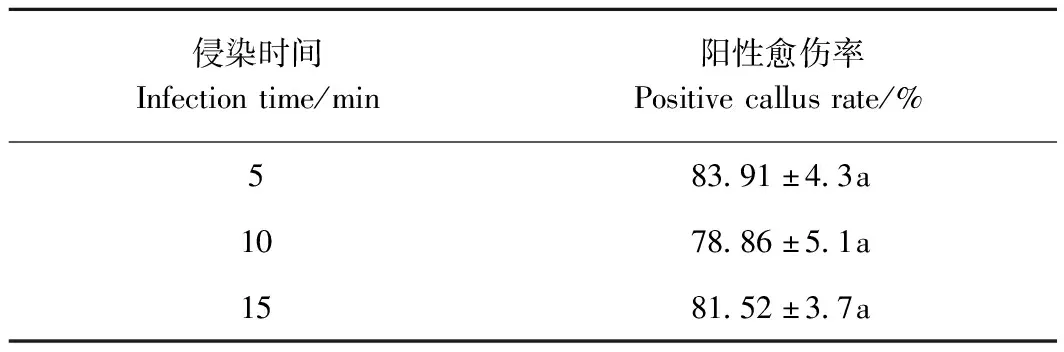
表4 侵染时间对转化效率的影响
2.2.2 抗生素浓度的筛选 经农杆菌侵染后的黑果枸杞叶片在脱分化过程中易受到农杆菌的污染,加入羧苄西林对农杆菌增殖有着明显的抑制作用,但较高浓度的羧苄西林会抑制不定生芽的分化。卡那霉素浓度过低不利于抗性组织的筛选,浓度过高不利于组织分化。本试验分别采用不同浓度的卡那霉素和羧苄西林联合使用对转基因植物材料进行筛选(表5),结果表明,在4种不同浓度的抗生素组合中,卡那霉素的浓度为25 mg·L-1以及羧苄西林为250 mg·L-1对农杆菌的抑制作用较好,且不定芽分化效率最高,为50.14%。

表5 抗生素浓度的筛选
2.3 黑果枸杞遗传转化植株的鉴定
2.3.1 转基因外植体分化过程中的GFP鉴定 因质粒pKAFCR21含有sGFP基因,编码绿色荧光蛋白。黑果枸杞叶片经农杆菌介导转染,在愈伤组织和不定芽诱导选拔培养基上培养4周后,采用荧光显微镜鉴定,能观察到部分愈伤组织有sGFP的表达(图2-A、D),10 d后,部分愈伤组织分化出大量不定芽,其中的部分不定芽也有sGFP的表达(图2-B、E),将有荧光的抗性愈伤组织及不定芽转移至含有抗生素的继代增殖培养基上,部分愈伤组织继续分化出大量不定芽,待抗性芽伸长后切成单株,转移至1/2 MS培养基上分化生根,形成完整的植株(图2-C、F)。
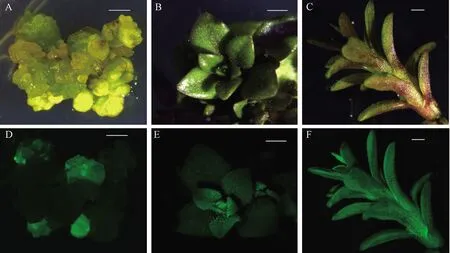
注: A:可见光下转基因愈伤;B:可见光下转基因不定芽;C:可见光下转基因幼苗;D: 荧光下转基因愈伤;E:荧光下转基因不定芽;F:荧光下转基因幼苗。标尺:2 mm。
2.3.2 转基因植株的PCR鉴定 提取转基因再生植株叶片基因组DNA,利用sGFP基因特异引物进行PCR扩增,经琼脂糖凝胶电泳分析,非转基因植株无目的条带,阳性对照pKAFCR21质粒和转基因植株在610 bp处有清晰的目的条带(图3),表明利用该遗传转化体系可成功获得阳性转基因植株。

注: M: DL2000; +: pKAFCR21质粒阳性对照;-: 非转基因植株阴性对照; S1~S9:转基因植株。
2.3.3 转基因植株的sGFP表达量检测 利用实时荧光定量PCR技术对上述PCR鉴定为阳性的转基因植株进行sGFP表达量检测(图4),结果表明,以LrGADPH为内参基因,5株转基因植株sGFP均有较高的表达水平,而非转基因植株无sGFP的表达。

注: 1, 4, 6, 10, 11:转基因植株;CK: 非转基因植株。
3 讨论
3.1 黑果枸杞再生培养外植体的选择
在植株再生培养过程中,合适的外植体选择至关重要。黑果枸杞再生培养多选择叶片、茎节或茎段,如李娜等[17]的研究,以无菌实生苗带1~2个节的茎段为材料,可诱导茎段与培养基接触的节处出现不定芽点,萌发出基茎丛生芽,其发生率可达100%,但是,此方法需要以大量的种子为基础,试验成本较高,且个体间差异较大,不适用于构建遗传转化用植株再生体系。王静等[16]以黑果枸杞下胚轴为外植体建立的农杆菌介导的遗传转化体系,阳性转化率为16%,同样,此方法存在着外植体取材数量受限,试验成本较高,且操作较为繁琐等缺点。与前人研究结果不同,本试验比较了不同外植体的再生效率,结果表明,继代培养40 d左右的黑果枸杞叶片具有较好的植株再生能力,可能由于幼嫩的叶片具有较强的脱分化和再分化能力。因此,可选择幼嫩的黑果枸杞叶片做为遗传转化用外植体,且在利用外植体进行植株再生培养的过程中,以黑果枸杞叶片为外植体,具有取材量大、易操作等优点。
3.2 黑果枸杞再生培养激素浓度的选择
外植体的脱分化与再分化受不同种类和不同浓度激素的影响,当NAA与BAP浓度配比合适时能相互协调的促进外植体的再分化与生长发育[18-19]。本试验中,BAP大于0.5 mg·L-1时,愈伤组织变得松软,易玻璃化,不利于芽的分化,这与戴逢斌等[20]利用BAP诱导黑果枸杞不定芽分化的结果基本一致,可能是由于高浓度的BAP处理使得细胞处于旺盛的脱分化状态,不利于愈伤组织再分化形成不定芽。此外,本试验中愈伤组织继代15 d后每个愈伤组织的不定芽分化个数在13~18个,这与高思丹等[21]的研究结果一致,可能是合适浓度的NAA与BAP配比能够促进黑果枸杞不定芽数量的增加。当生长素与细胞分裂素的比值小于1时,有利于愈伤组织分化出不定芽,与前人结果不同的是,本试验中,当NAA为0.5 mg·L-1和BAP为0.3 mg·L-1时,愈伤组织仍能分化出大量不定芽,且在不定芽伸长方面优于NAA 0.3 mg·L-1和BAP 0.5 mg·L-1,可能是黑果枸杞叶片含有较高浓度的内源性BAP,对外源BAP需求较少。因此,在黑果枸杞再生体系的建立中,可选择较低浓度的激素对外植体进行脱分化及再分化诱导,以促进愈伤组织及不定芽的分化。
3.3 黑果枸杞遗传转化体系的建立
在植物遗传转化操作过程中,有效筛选出阳性转化体至关重要,潮霉素、卡那霉素、除草剂是常用的抗性筛选剂,羧苄西林和头孢霉素是常用的杀菌剂[22-23]。在茄科植物遗传转化过程中,苏振华等[24]通过4个浓度的筛选,最终确定甜椒遗传转化最适的卡那霉素筛选浓度为50 mg·L-1,张明华等[25]在Btcry6A基因转化茄子的研究中发现,75 mg·L-1的卡那霉素可以有效地抑制非转基因外植体愈伤组织的产生;刘江娜等[26]建立的加工番茄新番72号遗传转化体系中,依次采用20、40和60 mg·L-1的卡那霉素对转基因外植体进行梯度筛选,其抗性愈伤组织诱导率为54.6%,抗性不定芽分化率达24.67%。刘雪霞等[27]对AtCKX2转基因番茄进行筛选时,卡那霉素的使用浓度高达80 mg·L-1,且对不定芽分化无影响。与前人结果不同,本试验将抗性筛选剂卡那霉素与抑菌剂羧苄西林共同使用对转基因外植体进行选拔,当卡那霉素浓度为50 mg·L-1、羧苄西林浓度为250 mg·L-1时,能抑制农杆菌增殖,减少对抗性不定芽分化的抑制。可能由于茄科不同种属植物对抗生素的敏感程度不同,尤其黑果枸杞属西北干旱耐盐碱灌木,具有较高的抗逆性,因此叶片外植体可耐受较高浓度的抗生素。
农杆菌菌液浓度同样是遗传转化成功的关键,王静等[16]建立的遗传转化体系中农杆菌侵染液OD600=0.5,在此高浓度下,外植体在后续分化过程中易增殖大量农杆菌。与前人结果不同,本试验采用较低浓度的农杆菌侵染液,即OD600=0.25的菌液侵染黑果枸杞叶片,共培养结束时未出现农杆菌大量增殖,可能是较低浓度的侵染液中菌体数量较少,不易附着在外植体上,且在抗性筛选培养基上少量的菌体易被抗生素抑制。
在遗传转化获得阳性转基因植株的过程中,转基因组织的早期筛选可降低试验工作量,冯路路等[28]以GFP为报告基因,采用体式荧光显微镜从 2 978 个转化外植体中鉴定得到3株表达GFP的再生苗,极大提高了转基因植株的筛选效率。同样地,本试验采用绿色荧光标记sGFP的表达为抗性组织的筛选标记,可在愈伤组织的形成时期筛选出阳性转基因材料。不同的是,本试验在获得转基因不定芽及再生植株时,又利用sGFP基因的表达对阳性植株进行分子生物学的鉴定,进一步验证了sGFP基因转入后的高水平表达。因此,本试验建立的黑果枸杞遗传转化体系可降低试验操作过程中的工作量、提高转化效率,为黑果枸杞种质资源功能基因的挖掘奠定技术基础。
4 结论
为建立高效的黑果枸杞遗传转化体系,本试验对植株再生体系及遗传转化体系中的关键因素进行了探讨,结果表明,最佳的植株再生用外植体为叶片,在MS + 30 mg·L-1sucrose + 0.5 mg·L-1NAA + 0.3 mg·L-1BAP培养基中,愈伤组织诱导率为88.56%,不定芽诱导率为54.54%,在1/2 MS培养基中,不定芽生根率为95%;遗传转化时,农杆菌侵染液浓度为OD600=0.25,在卡那霉素和羧苄西林分别为25和250 mg·L-1的筛选作用下,阳性愈伤率为85.47%,阳性植株转化率为29%,与非转基因植株相比,转基因植株中的sGFP均有较高的表达水平。
