玉米赤霉烯酮降解酶基因zlhy-6在枯草芽孢杆菌中的表达
2022-05-06符浩东张晨曦李奕霏郑永权
符浩东 张晨曦 李奕霏 郑永权 刘 阳,2,*
(1 中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193;2 佛山科学技术学院生命科学与工程学院,广东 佛山 528231;3 中国农业科学院植物保护研究所,北京 100193)
玉米赤霉烯酮(zearalenone, ZEN)是由镰刀菌属(Fusarium)合成的次级代谢产物间苯二酚酸内酯,主要由禾谷镰刀菌和黄色镰刀菌合成[1]。ZEN因广泛污染玉米、大麦、小麦等作物及副产物而备受关注。最近在我国进行的一项调查显示,超过70%的玉米样品被ZEN污染[2]。ZEN在哺乳动物中表现出雌激素活性,可激活雌激素受体,导致动物出现生殖障碍,偶尔会导致人类的高雌激素综合症,危害动物和人体健康[3]。因此,为了解决食品安全问题,减少ZEN造成的经济损失,采用物理法、化学法或生物学方法来降解被污染饲料或谷物中的ZEN[4-6]。但在脱毒过程中,理化脱毒往往会改变食物和饲料的营养结构,同时脱毒剂的使用可能对环境造成二次污染[7]。相比之下,生物脱毒具有很高的特异性,能对产品进行无害脱毒,甚至在适宜的条件下达到完全脱毒[8]。
生物技术在食品和饲料工业发展中具有巨大的潜力[9-10]。微生物产生的酶能更有效地转化和降解天然食品中的ZEN,在食品加工中也有广泛的应用[9]。目前有3种酶被认为可以降解ZEN:内脂酶[11]、过氧化物酶[12]和漆酶[13],其中过氧化物酶对ZEN的降解机制尚不清楚。漆酶主要用于去除黄曲霉毒素,但只有在正丁醇甲酯存在的条件下才能降解ZEN,极大限制了其工业应用的广泛度[14]。漆酶具有高ZEN降解能力和明确的解毒机理。在2002年,Kakeya等[15]发现真菌粉红黏帚霉(Clonostachysrosea)能够降解ZEN。同年,Takahashi-Ando等[16]从粉红黏帚霉Clonostachysrosea(别名Gliocladiumroseum)IFO7063中分离出ZEN解毒基因ZHD101。目前来自粉红黏帚霉的ZEN降解酶基因zhd101、zlhy-6、ZEN-jjm等被成功克隆表达,重组蛋白均表现出较强的ZEN水解能力。zlhy-6降解酶基因与ZHD101有11个碱基的差异,由zlhy-6基因表达的重组降解酶对ZEN具有良好的降解能力,且降解后无ZEN残留[17]。ZEN降解酶基因已在大肠杆菌[18]、啤酒酵母[16]、巴斯德毕赤酵母[17]和罗伊氏乳杆菌[19]中表达,然而目前有关ZEN降解酶在枯草芽孢杆菌中表达的研究报道较少。与大肠杆菌和毕赤酵母相比较,革兰氏阳性菌枯草芽孢杆菌是一种非致病性微生物,具有悠久的食品发酵历史,并被公认为安全菌株(generally recognized as safe, GRAS)[20]。此外,芽孢杆菌还具有孢子多、抗逆性强、生产成本低、生长快以及分泌异源酶和蛋白质的能力强,易于遗传操作等优点[21]。
因此,为了实现玉米赤霉烯酮降解酶基因zlhy-6在枯草芽孢杆菌中的表达,同时提高zlhy-6的表达,将枯草芽孢杆菌内源性启动子P43插入原质粒启动子下游,以期获得双启动子表达质粒;此外,为了克服质粒不稳定性和抗生素等不安全因素,利用同源重组的方法探索zlhy-6在枯草芽孢杆菌中的整合表达,旨在为实现玉米赤霉烯酮降解酶的工业化生产奠定理论基础,也为安全解决粮食储藏和饲料生产中的ZEN污染提供思路。
1 材料与方法
1.1 试验材料
1.1.1 质粒、菌株和引物E.coliJM109 感受态细胞,购自北京全式金生物技术有限公司;本试验所用所有引物均由北京华大基因合成(表1);枯草芽孢杆菌168菌株、pMA5质粒、p7s6质粒、pTSC质粒,由江南大学江波老师课题组惠赠。

表1 本研究中使用的引物
1.1.2 试验试剂 限制性内切酶(BamHⅠ)、DL5000 DNA标记、DL2000 DNA标记、Prime STAR Max、蛋白质上样缓冲液和DNA上样缓冲液均购自日本TaKaRa公司;Blue Plus®蛋白标记(14~100 kDa)购自北京全式金生物技术有限公司;质粒提取试剂盒、细菌基因组DNA提取试剂盒和DNA胶回收试剂盒购自北京天根公司;His-tag蛋白纯化试剂盒(抗变性)购自北京碧云天公司;ClonExpress® Ultra One Step Cloning Kit购自北京诺唯赞公司;氨苄青霉素、壮观霉素、卡那霉素购自北京索莱宝。ZEN 标准品购自美国Sigma公司;乙腈、甲醇(色谱级)购自美国 Fisher 公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
DU800 紫外/可见分光光度计仪,美国Beckman Coulter公司;T100 PCR仪,美国Bio-Rad公司;1260 高效液相色谱仪,美国Agilent公司;SCIENTZ-950 超声波细胞破碎仪,宁波新芝生物科技有限公司;凝胶电泳仪,北京百晶生物技术有限公司;高速冷冻离心机,德国Eppendorf公司;恒温振荡摇床,上海智诚公司。
1.3 试验方法
1.3.1 玉米赤霉烯酮降解酶重组枯草芽孢杆菌的构建 编码粉红黏帚霉G.roseum玉米赤霉烯酮降解酶基因zlhy-6(NCBI GenBank 登录号:HQ825318)进行化学合成后,利用引物P1和P2进行PCR扩增。利用引物P3和P4从枯草杆菌168条染色体上扩增出枯草杆菌内源性启动子P43。利用引物P3和P2,通过重叠延伸PCR将P43启动子和zlhy-6融合为表达盒。利用BamHⅠ对pMA5质粒进行酶切,将酶切胶回收纯化的载体和目的基因片段,通过一步克隆的方法进行酶连接,反应参照ClonExpress® Ultra One Step Cloning Kit说明书进行。转化大肠杆菌JM109感受态,用氨苄青霉素(50 μg·mL-1)筛选阳性克隆,测序获得了含有单启动子的表达载体pMA5-zlhy-6和含有双启动子的表达载体pMA5-P43-zlhy。
基于感受态细胞法[22],将两种重组质粒导入枯草芽孢杆菌168,分别获得两种不同的重组枯草芽孢杆菌菌株168/pMA5-zlhy-6和168/pMA5-P43-zlhy。在含卡那霉素30 μg·mL-1的LB平板上筛选转化子,用菌落PCR方法鉴定阳性克隆。用菌落PCR方法鉴定阳性克隆,用无菌牙签挑取单个菌落到PCR管中,加入20 μL水,100℃煮沸5 min。然后吸取2 μL上清作为模板进行PCR反应。体系为25 μL:Green Taq max 10 μL,上下游引物各1 μL,上清液2 μL,ddH2O 11 μL。菌落PCR反应条件:95℃预变性10 min;95℃解链30 s,56℃退火30 s,72℃延伸3 min,共28个循环;72℃终延伸5 min。
1.3.2 重组质粒的分离稳定性测定 重组质粒的稳定性根据Nguyen等[23]的方法进行评估。将含有重组质粒的细胞在LB培养基中培养约100代,包括多次传代培养。将特定世代接种在LB平板(平板C)上,并将复制品接种在含30 μg·mL-1卡那霉素的LB平板(平板D)上。C板上的菌落数计为CC,D板上菌落数计为CD。CD/CC值表示重组质粒在每一代培养中的稳定性。2个平板均接种来自同一原代培养物的100个相同菌落。
1.3.3 玉米赤霉烯酮降解酶基因在枯草芽孢杆菌的整合表达 按照Shevchuk等[24]的方法,使用引物对P5/P6,通过PCR从p7S6载体中扩增出lox71-spc-lox66抗性基因表达盒。以枯草芽孢杆菌168条染色体为模板,以P7/P8 和P9/P10为引物,扩增淀粉酶同源臂片段amyE-back和amyE-front。此外,利用引物P2和P3从载体pMA5-P43-zlhy中扩增目标基因P43-zlhy,PCR产物按SanPrep柱式DNA胶回收试剂盒的要求进行凝胶纯化和提取。随后,用Phusion高保真DNA聚合酶将4个DNA片段融合成一个完整的敲除片段,线性化的DNA片段转化为枯草杆菌168的感受态细胞。用50 μg·mL-1壮观霉素筛选,利用P11/P12引物进行菌落PCR鉴定,获得阳性转化子。并通过两步法(GM I,GM II)[25],将筛选出的阳性重组子制备成感受态细胞。将质粒pTSC转化到上述感受态细胞中,然后利用IPTG(200 μmoL)诱导质粒pTSC表达Cre重组酶。通过Cre重组酶诱导lox71位点和lox66位点之间发生同源重组,删除壮观霉素抗性标记。将温度升高至51℃过夜,消除温度敏感质粒pTSC,从而获得重组整合菌株BZ-zlhy。
1.3.4 ZEN降解酶的表达 采用摇瓶发酵法在枯草杆菌中表达ZEN降解酶。将重组菌株168/pMA5-zlhy-6、168/pMA5-P43-zlhy和BZ-zlhy接种至100 mL锥形瓶(10 mL LB +10 μL卡那霉素),37℃、200 r·min-1条件下过夜。第二天按3%接种量转接至500 mL锥形瓶(100 mL LB+100 μL卡那霉素)。放入摇床中,37℃、200 r·min-1条件下进行扩大培养。在此过程中,测定OD600并绘制生长曲线。
1.3.5 ZEN降解酶的纯化 在4℃条件下以8 000 r·min-1离心15 min后收获重组细胞,洗涤2次,然后用含有100 mmol·L-1NaCl的50 mmol·L-1Tris/HCl(pH值7.5)重新悬浮。之后,在37℃条件下用20 mg·mL-1溶菌酶孵育细胞30 min,用超声波破碎15 min(脉冲开启2 s,脉冲关闭3 s)。以12 000×g离心20 min,除去未破碎的细胞和细胞碎片,并通过0.45 μm过滤器过滤上清液,得到粗酶溶液。粗酶溶液用His-tag 蛋白纯化试剂盒纯化,具体步骤按照His-tag蛋白纯化试剂盒说明书进行。用12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和分子量标记(14~100 kDa)测定粗酶和纯化酶的分子量。
1.3.6 重组蛋白ZEN降解活性测定 将40 μL酶溶液、920 μL 50 mmol·L-1Tris-HCl缓冲液(pH值9.5)和40 μL ZEN标准储备液(0.1 mg·mL-1)混合并在37℃下培养30 min,然后加入1 mL甲醇终止反应。用乙腈制备浓度为10、20、50、70和100 μg·mL-1的ZEN储备标准溶液。ZEN的保留时间约为7 min。其他ZEN标准溶液也通过高效液相色谱法(high performance liguid chromatography, HPLC)检测。记录峰面积。以标准浓度为横坐标,测得的峰面积为纵坐标,绘制标准曲线,得到的标准曲线符合y=5x的线性回归方程,结果表明,ZEN浓度与色谱峰面积之间存在良好的线性关系。用ZEN标准曲线计算样品中的ZEN含量。
ZEN降解率=[空白对照组ZEN浓度(μg·mL-1)-残留ZEN浓度(μg·mL-1)]/空白对照组ZEN浓度(μg·mL-1)×100%。
酶活性定义:在37℃、pH值7.5条件下,以每分钟降解1 μg ZEN所需的酶量为一个单位(U)。
1.3.7 ZEN的 HPLC 检测条件 利用HPLC-FLD检测ZEN毒素[17,25],具体检测条件为:安捷伦ZorbaxSB-C18柱(4.6 mm×250.0 mm,5 μm),乙腈∶水(70∶30,v/v)作为流动相;流速1 mL·min-1,进样体积 20 μL;激发波长274 nm,发射波长440 nm。
1.3.8 数据处理 所有处理均设3次重复,使用Microsoft Excel 2019软件进行数据整理与分析,应用Origin 2019b软件完成制图及方差分析。
2 结果与分析
2.1 单启动子和双启动子表达质粒的构建
构建质粒的流程图如图1所示。本研究利用所描述的材料和方法构建了目的质粒,选择大肠杆菌-枯草杆菌穿梭载体pMA5作为原载体。在原载体的基础上,分别构建了含有单启动子的质粒pMA5-zlhy-6和含有双启动子的质粒pMA5-P43-zlhy。质粒pMA5-zlhy-6含有1个强启动子HapII,可以表达zlhy-6 基因。质粒pMA5-P43-zlhy含有强启动子HapII和枯草杆菌内源性启动子P43,其表达水平高于单启动子质粒。将获得的重组质粒转化到枯草杆菌168感受态细胞中,用卡那霉素在LB琼脂上筛选重组菌株168/pMA5-zlhy-6 和168/pMA5-P43-zlhy阳性克隆。最后,对筛选得到的阳性克隆进行克隆PCR鉴定,结果显示重组菌株构建成功。
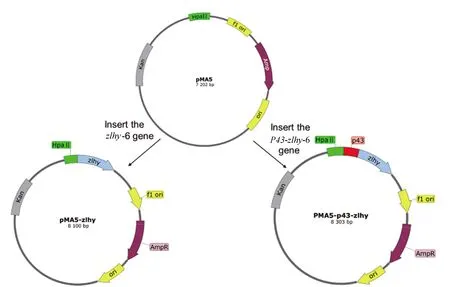
图1 单启动子重组质粒pMA5-zlhy和双启动子重组质粒pMA5-P43-zlhy构建示意图
2.2 玉米赤霉烯酮降解酶基因在枯草芽孢杆菌的整合表达
枯草芽孢杆菌玉米赤霉烯酮降解酶基因染色体整合流程图如图2所示。在本研究中,P43-zlhy表达盒和lox71-spc-lox66标记盒夹在2个淀粉酶同源臂之间。将线性DNA片段直接转化到枯草芽孢杆菌168个感受态细胞中,并用壮观霉素筛选转化子。由于zlhy-6基因表达盒和lox71-spc-lox66抗性基因表达盒被插入到染色体的淀粉酶位点中,通过双交换事件发生染色体整合的重组菌将在带有壮观霉素的LB平板上生长。其他非复制性片段将随宿主细胞的繁殖而丢失[26]。最后,通过Cre/Lox特异性重组系统敲除壮观霉素抗性标记盒[27],获得无抗生素菌株BZ-zlhy。复制质粒的分离不稳定性是枯草杆菌表达系统的主要问题之一,使用整合质粒可以有效避免这一问题。
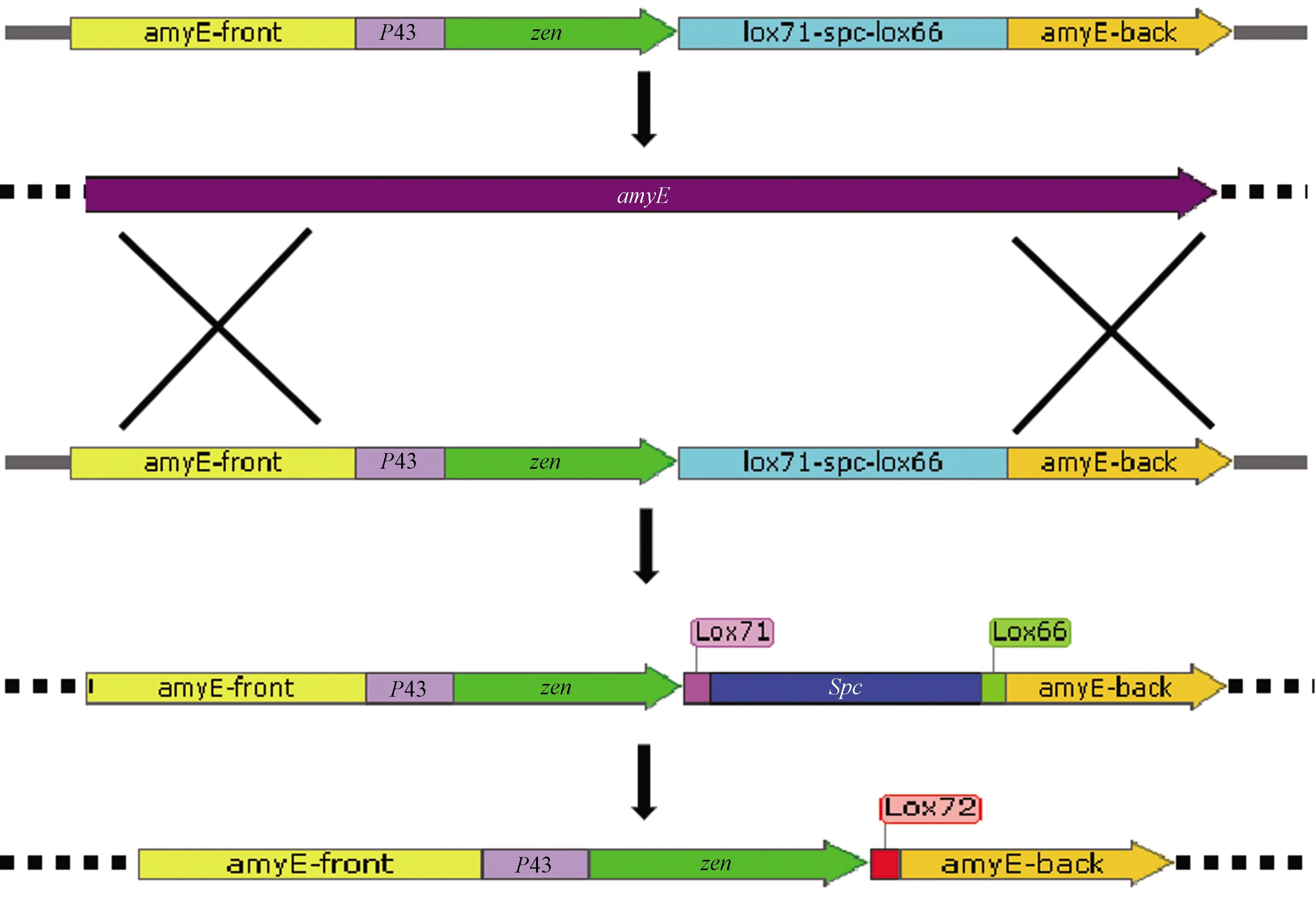
注:实线为PCR产物,虚线为枯草芽孢杆菌染色体DNA。
2.3 重组菌株的发酵培养
设置不同的时间梯度,测量野生型菌株和重组菌株的OD600值和酶活性(图3)。以野生型作为阴性对照,每次试验一式3份。结果表明,3株重组菌株生长趋势一致(图3-A),但菌株168/pMA5-P43-zlhy具有较强的降解酶活性,尤其在18 h,168/pMA5-P43-zlhy酶活最高(2.2 U·mL-1),而pMA5-zlhy-6和BZ-zlhy酶活分别为1.8 U·mL-1和0.4 U·mL-1(图3-B)。结果表明两个串联的强启动子,即在pMA5原始启动子Hpa Ⅱ之后添加另一个强启动子P43,可提高zlhy-6基因的表达水平和降解ZEN的酶活性。可知,重组枯草芽孢杆菌168/pMA5-P43-zlhy更适合表达zlhy-6基因。
2.4 zlhy-6的酶法测定和SDS-PAGE分析
通过SDS-PAGE分析由168/pMA5-zlhy-6、168/pMA5-P43-zlhy 和BZ-zlhy菌株表达的重组酶(图4-A)。使用SDS-PAGE进行检测,发现粗制酶和纯化酶在约32 kDa处显示出明显的条带,这和酶的理论分子量大小一致。同时发现,168/pMA5-P43-zlhy菌株表达的重组酶条带最宽。说明3种菌株均可表达重组酶,并且168/pMA5-P43-zlhy菌株表达量最高。根据峰面积与ZEN浓度的关系计算,由168/pMA5-P43-zlhy菌株表达的ZLHY-6具有最高的ZEN降解率,为65.1%;BZ-zlhy菌株表达的ZLHY-6对 ZEN降解率最低,为12.8%;在168/pMA5-P43-zlhy中表达的ZLHY-6的酶活性为2.2 U·mL-1。

注:泳道M:预染蛋白梯(100、70、50、40、30、25和14 kDa);泳道1:枯草芽孢杆菌168野生型(阴性对照)培养14 h后的上清液;泳道2:重组菌株168/pMA5-zlhy-6培养14 h后上清液;泳道3:重组菌株168/pMA5-P43-zlhy培养14 h后的上清液;泳道4:重组菌株BZ-zlhy培养14 h后上清液;泳道5:纯化的酶。HPLC色谱法用于评估针对ZEN的zlhy-6酶活性。a:枯草芽孢杆菌168野生型细胞破碎后,将上清液与ZEN标准液孵育30 min,然后进行液相检测。b:将BZ-zlhy细胞破碎后,将上清液与ZEN标准液孵育30 min,然后进行液相检测。c:将 pMA5-zlhy-6细胞破碎后,将上清液与ZEN标准液孵育30 min,然后进行液相检测。d:将pMA5-P43-zlhy细胞破碎后,将上清液与ZEN标准液孵育30 min,然后进行液相检测。e:将纯化的ZLHY-6蛋白与ZEN标准品孵育30 min,然后进行液相检测。
2.5 重组质粒稳定性评价
原始的pMA5质粒是一个分离不稳定的质粒,当质粒以滚动圈复制时,产生单链DNA作为中间产物。表中的每个值都是三次独立测试的平均值。表2显示,含有该质粒的重组菌株168/pMA5-zlhy-6在60代时质粒稳定性为87%,在第100代,质粒的稳定性为72%。随着传代次数的增加,重组质粒分离稳定值逐渐减小,说明质粒在复制过程中丢失。而对于基因组整合表达的菌株BZ-zlhy,其遗传信息在100代内是完全稳定的。
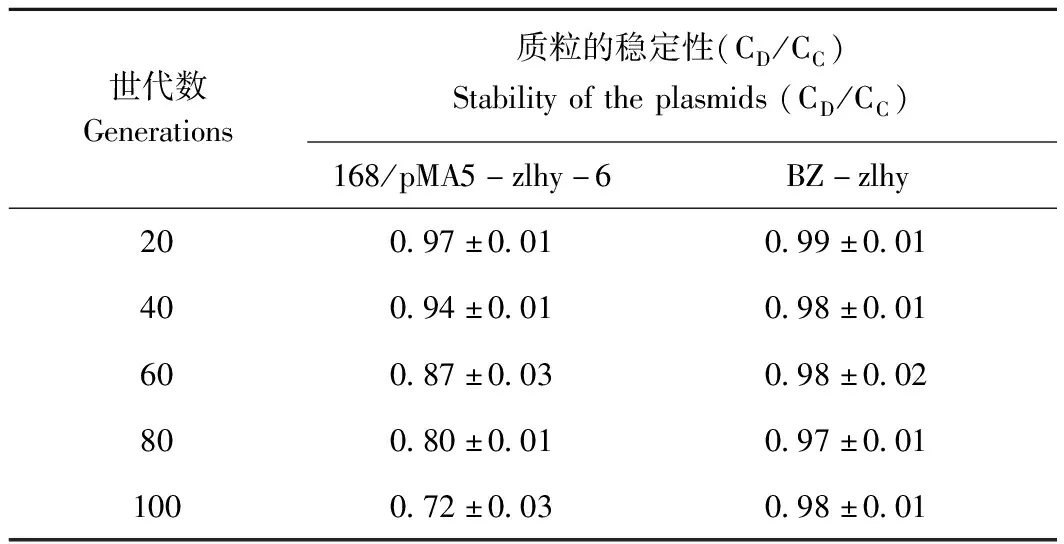
表2 重组质粒的分离稳定性
3 讨论
真菌毒素严重危害人畜健康,造成巨大的经济损失和不良社会影响[28]。为了解决真菌毒素污染,目前正在开发可以从农产品中去除真菌毒素的方法[29]。物理和化学脱毒方法虽然取得了一定的成功,但存在操作困难、饲料营养品质和适口性降低等缺点。与物理和化学脱毒方法相比,生物脱毒方法具有作用条件温和、对原料感官特性和适口性影响最小、提高原料营养价值等优点[30]。从技术角度看,酶催化方法具有特异性高、效率高的特点,在将真菌毒素转化为低毒产品方面具有独特的地位,保证了人类食品和动物饲料的最低污染和安全[31]。因此,生物技术方法在降低真菌毒素危害方面显示出巨大潜力[9]。此外,前人对内脂水解酶(如ZHD101、ZLHY-6、ZHD518、ZHDC和ZHDG)进行了充分的研究,分析了上述内脂水解酶降解ZEN的能力,并证实了其化学结构和代谢物的毒性较小[31]。
由于目前关于ZEN降解酶在枯草杆菌中表达的研究相对较少。因此,本研究旨在以ZLHY-6为例,探讨高效表达脱毒酶的可行性。结果表明,ZLHY-6在发酵上清中的酶活为1.8 U·mL-1,低于文献报道。例如,Xiang等[3]在毕赤酵母中表达ZHD时,酶活性为22.5 U·mL-1;王义春等[17]在毕赤酵母中表达了zlhy-6,酶活性达到10 U·mL-1。高蛋白表达水平通常可以通过强启动子、目的基因的多拷贝、转录终止子和各种翻译/分泌信号的最佳组合来实现[32],其中启动子是实现枯草芽孢杆菌外源基因高效表达的关键,研究人员在启动子筛选方面进行了多次尝试,许多研究表明双启动子可以显著提高异源基因的表达水平[33]。张玲等[34]选用组成型启动子PamyQ与PHpaII构成的双启动子,有效地将胞外活性提高至31.24 U·mL-1,是单启动子PHpaII的3.4倍。Kang等[35]在PHpaII启动子下游串联1个amyR2,用来表达4-α-糖基转移酶,与含单个PHpaII的枯草芽孢杆菌系统相比,含串联启动子的表达系统目的产物的产量分别提高11和12倍。本试验为了提高表达水平,以枯草芽孢杆菌常用的强启动子P43启动子[36]和pMA5自身的启动子HapII构建双启动子。与单启动子表达载体相比,酶活性提高了1.2倍。在37℃条件下,ZLHY-6对4 μg·mL-1ZEN的降解率在30 min内达到65.1%,本研究对后续真菌毒素降解研究有一定的参考价值,为该酶在枯草芽孢杆菌中表达时,启动子的选择提供了一定的参考。
转基因微生物及其转化产品在食品工业中的安全性日益引起人们的关注。但常用的克隆和表达质粒含有抗生素耐药基因,需要在培养基中添加抗生素来维持质粒稳定性。虽然该方法在实验室规模上可行,但由于高成本和生态限制,不适用于大规模的工业栽培。此外,即使在培养过程中添加了抗生素,质粒仍可能不稳定[37]。染色体整合表达是克服质粒不稳定性和表达系统中不安全因素的有效方法[20],因此,为了更好地应用于食品和饲料生产,本试验还探索了zlhy-6在枯草杆菌中的整合表达,其酶活性为0.4 U·mL-1,低于质粒表达的酶活性。原因可能是拷贝数相对较低,可以通过构造多拷贝表达载体来解决[38]。枯草芽孢杆菌染色体整合表达的最关键步骤是通过2次交换将含有表达盒的P43-zlhy聚合物整合到枯草芽孢杆菌染色体的基因组中。在枯草杆菌中,amyE、lacA、gltA、pyrD、sacA、thrC等非必需基因已应用于基于同源重组的异位染色体整合[39],最常用的是amyE基因座,因此,本试验也选择了这个位点。zlhy-6 在枯草杆菌中表达后,通过Cre/lox系统删除抗生素抗性基因[26],并通过该方法获得了不含抗生素抗性基因表达玉米赤霉烯酮降解酶的重组枯草芽孢杆菌,该菌株可用于降解玉米、小麦等粮食在贮藏过程中霉菌产生的ZEN。同时,由于枯草芽孢杆菌本身在环境中具有很强的稳定性,通过饲料造粒过程,其降解效率基本不降低,可知枯草芽孢杆菌能够耐受动物胃肠道各节段的pH值[40-41],并能够直接应用于饲料中。本研究为在枯草芽孢杆菌中表达真菌毒素降解酶提供了参考,也为安全解决粮食储藏和饲料生产中的ZEN污染提供了思路。
4 结论
本研究以全基因合成的方法获得玉米赤霉烯酮降解酶基因zlhy-6,并在枯草芽孢杆菌中进行表达。利用含有双启动子表述载体的枯草芽孢杆菌表达玉米赤霉烯酮降解酶基因zlhy-6时,其表达量最高,对ZEN的降解效果最好。同时,为了克服质粒表达的不稳定性,去除抗生素抗性基因,本研究进行了枯草芽孢杆菌的整合表达,解决了蛋白表达过程中质粒不稳定现象。但是,与质粒表达相比,表达量较低,有必要通过多拷贝表达、多整合位点表达等手段进一步提高表达量。
