生长素内流载体基因CkLAX3参与柠条锦鸡儿干旱胁迫响应的分析
2022-05-06李佳阳崔金浩任洁洁龚春梅
李佳阳 崔金浩 任洁洁 龚春梅,*
(1 西北农林科技大学生命科学学院,陕西 杨凌 712100;2 西北农林科技大学园艺学院,陕西 杨凌 712100)
柠条锦鸡儿(Caraganakorshinskii),豆科(Leguminosae)锦鸡儿属(Caragana)植物,是广泛分布在我国西北荒漠地区的兼具生态和经济效益的灌木。目前世界上约有100余种锦鸡儿属植物,主要生长于欧亚大陆的干旱及半干旱地区。其中我国现存锦鸡儿属植物66种,主要分布在我国西北干旱及半干旱地区[1-2]。在长期的干旱适应性过程中,植物表现出诸多抗旱特性,包括形态结构的改变,而生长素(auxin)在植物生长和发育中发挥着不可替代的作用,涵盖植物顶端生长、腋芽形成、花器官发育、根发育等方面[3-6]。除此之外,近年研究表明,生长素还参与干旱胁迫下的响应[7]。在逆境胁迫下,编码吲哚乙酸(indole-3-acetic acid, IAA)氨基酸化合成酶的GH3家族基因WES1被上调,催化IAA与氨基酸结合失活,从而降低内源生长素水平并激活胁迫相关基因PR-1和CBF的表达[8]。AUX/IAA和生长素响应因子(auxin response-factor, ARF)是介导生长素响应的两个重要蛋白家族,直接调控生长素早期响应基因的表达。在水稻(Oryzasativa)中已鉴定出31个OsIAA和25个OsARF基因,其中高盐条件下水稻中OsIAA2和OsIAA20被上调[9]。水稻GH3.13家族基因TLD1在正常生长条件下的地上组织中表达量受到抑制,但在干旱胁迫条件下被显著诱导。水稻tld1-D功能获得性突变体中TLD1基因的激活表达,导致IAA浓度的降低和株型的改变,有利于减少植株水分的散失,提高存活率[10]。
生长素的功能除与其含量相关外,还依赖其运输载体介导的极性运输。在拟南芥中,生长素内流载体AUX/LAX家族由4个基因AUX1、LAX1、LAX2和LAX3组成[11]。在这些基因中,AUX1调控根的向重力性、侧根及根毛发育、叶序和顶端弯钩的扩展[12];LAX1是叶片叶序样式所必需的[13];LAX2调控子叶的维管构型[11]和叶脉样式[14];而LAX3与侧根的发生以及根尖钩的发育密切相关[12]。近年也有研究表明,拟南芥LAX3在茎秆重力应答下促使木质部更加发达[15]。发达的木质部又为植物提供了更强的机械支撑,增强其水分的运输。
柠条锦鸡儿的逆境适应机制引人关注,但目前相关报道较少。目前对柠条锦鸡儿的研究主要集中于形态解剖、生理生态、植物进化分类及饲料营养学等方面,对其非生物胁迫应答下的分子调控机制有待深入研究[16]。生长素对植物生长发育活动的调节具有重要作用,近来已经有一些研究显示生长素可能对植物抗旱特征的形成具有调控作用[15],提供了重要的启示与借鉴。本研究就生长素极性运输增强植物抗旱性展开系统研究,旨在为丰富柠条锦鸡儿抗旱机制提供数据支撑。
1 材料与方法
1.1 试验材料
柠条锦鸡儿样品取自西北农林科技大学试验田。挑选健康饱满的柠条锦鸡儿种子用清水冲洗干净,湿润纱布包裹后置于黑暗环境中室温萌发3~5 d,待种子萌发后移栽入盆。取正常生长30 d左右的幼苗叶片,用于后续RNA提取及染色体步移等试验。
1.2 试验试剂
Cat# 082002植物总RNA提取试剂盒,郑州贝贝生物科技有限公司;RR047A去基因组cDNA反转录试剂盒、RR820A荧光定量试剂盒、2641A普通反转录酶MMLV、R045B高保真酶PrimeSTAR Max DNA Polymerase,宝日医生物技术北京有限公司;DP320植物基因组提取试剂盒、DP209通用型DNA凝胶回收试剂盒,天根生化科技北京有限公司;TOPO载体(007VS)及琼脂糖购自北京擎科新业生物技术有限公司。
1.3 柠条锦鸡儿基因组提取
选取生长30 d左右的幼嫩柠条锦鸡儿叶片,具体步骤参照植物基因组提取试剂盒说明书进行,提取完成后测定基因组DNA浓度,选用OD260/280值为1.7~1.9、OD260/230值大于2的基因组DNA,用于启动子序列的扩增。
1.4 柠条锦鸡儿RNA提取及反转录
1.4.1 RNA提取 选取生长30 d左右的幼嫩柠条锦鸡儿叶片,具体步骤参照植物总RNA提取试剂盒说明书,提取完成后测定RNA浓度,选用OD260/280值为1.9~2.0,OD260/230值大于2的RNA。之后吸取1~2 μL的RNA溶液与核酸上样缓冲液混匀,用浓度为1%的琼脂糖凝胶电泳检测RNA质量,高质量RNA应为3条带,且28S RNA亮度约为18S RNA的2倍。
1.4.2 去基因组反转录 参照不同处理及不同重复之间的RNA提取浓度,计算每个样品准确吸取1 μg所需的RNA体积,加入去基因组cDNA反转录试剂盒中提供的gDNA Clean Reagent,进行去基因组反应,防止基因组DNA对结果的干扰。之后按照步骤依次加入反转录体系组分,参照说明书指定程序进行反转录。使用时将cDNA溶液稀释3~5倍作为实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)的模板。
1.4.3 普通MMLV反转录单酶反转录 本试验使用时与说明书不同,将反转录RNA的总量由1 μg提升为3 μg,减少无酶水的体积,增加MMLV单酶的用量,但不增加总反应体系,使cDNA浓度增加,有利于微量或复杂基因的克隆。具体反应体系及程序为:RNA总量3 μg,oligo dT(18T)(50 μmol·L-1)3 μL,无酶水补充至12 μL。70℃10 min,冰浴2 min后添加缓冲液4 μL,dNTP 1 μL,RNA酶抑制剂0.5 μL,MMLV单酶 2 μL,无酶水补充至20 μL。42℃ 1 h,70℃灭活15 min。
1.5 柠条CkLAX3实时荧光定量PCR
对萌发后正常生长30 d左右的柠条锦鸡儿幼苗自然干旱处理15 d,提取其叶片总RNA反转录为cDNA作为定量检测的模板。利用Premier Primer 5.0设计柠条CkLAX3及Ckβ-actin的定量引物(表1),反应体系参照荧光定量试剂盒说明书体系进行。qRT-PCR条件如下:95℃预变性30 s,95℃变性5 s,56℃退火30 s,72℃延伸30 s,共40个循环。使用Ct值确定参考基因的表达水平,并使用2-ΔΔCt方法进行计算[17]。每个样品设置3个生物学重复和3个技术重复。
1.6 柠条CkLAX3全长cDNA克隆
以MMLV反转录单酶反转录产物为模板,设计扩增引物CkLAX3-F及CkLAX3-R(表1),使用高保真酶PrimeSTAR Max 按照54℃、56℃、58℃梯度退火扩增。具体反应扩增条件:98℃预变性2 min,98℃变性15 s,温度梯度退火10 s,72℃延伸30 s,72℃后延伸5 min,共35个循环。胶回收产物连接TOPO载体测序。
1.7 柠条CkLAX3亚细胞定位
设计引物,将CkLAX3序列与pCambia-1300载体通过无缝克隆的方法连接,将连接产物转入大肠杆菌EPI300中进行筛选,测序结果无误后取菌液大摇,提取质粒,转化农杆菌GV3101。通过注射法分别将p35S:CkLAX3-eGFP和pCambia 1300空载体瞬时转化到生长28 d的烟草叶片中,使用荧光显微镜进行亚细胞定位观察。
1.8 柠条CkLAX3启动子染色体步移
依据cDNA测序结果,设计3条特异性R引物SP1、SP2、SP3(表1),SP2的位置应设计在SP1的内侧,SP3位于SP2的内侧。每两个引物之间的距离没有严格规定,以60~100 bp为宜。染色体步移所使用的通用引物序列AP1~AP4(表1)通过查阅文献获得[18]。
染色体步移由3次扩增反应组成。第1次PCR反应分为4组,特异性引物均为SP1,通用引物分别为AP1~AP4。第1次PCR反应由5次高特异性反应、1次低特异性反应再加15个大循环30次高特异性反应和15次低特异性反应构成的超级循环。具体反应程序参照染色体步移试剂盒说明书进行。第2次反应则首先使用第一轮PCR产物母液作为模板,特异性引物使用SP2,通用引物使用与第一轮模板相同的通用引物,如果扩增效果不好,将第一级PCR产物稀释10~1 000 倍作为模板。通过15次热不对称的超级PCR循环,使特异性目的基因被选择性地扩增,非特异性PCR扩增减少,具体反应程序参照染色体步移试剂盒说明书进行。第3次反应特异性引物使用SP3,其余参数均与第2轮相同。
1.9 柠条CkLAX3启动子高效热不对称交错PCR(HiTail-PCR)
HiTail-PCR的特异引物设计方法与上述染色体步移相同,通用引物序列LAD1-LAD4和AC1参考文献[18],具体序列参见表1。第一次反应将LAD引物两两组合,共计6组,与特异性SP1引物配对,通过热不对称交错PCR的方法,在低退火温度循环促进LAD引物与模板结合扩增,在高退火温度循环促进特异引物SP1与模板结合扩增。第二次反应以稀释10倍或者50倍的第一次反应产物作为模板,以AC1与特异引物SP2配对进行扩增反应,相关扩增程序及体系参考文献[19]。

表1 克隆柠条CkLAX3基因所用引物
1.10 柠条CkLAX3蛋白及启动子序列生物信息学分析
通过pfam(http://pfam.xfam.org/)对其蛋白保守结构域进行分析;利用Mega[20-21]进行系统进化分析,算法采用邻接法,Bootstrap值设置为1 000;通过ExPasy在线工具ProParam(https://web.expasy.org/protparam/)分析CkLAX3蛋白的理论分子量、稳定性以及等电点等理化参数;利用网站(http://www.cbs.dtu.dk/services/TMHMM/)对其跨膜结构域进行分析;通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对其二级结构进行解析,同时使用Swiss-model(https://swissmodel.expasy.org/interactive)对其蛋白的三维结构进行模拟构建[22-23];通过PredictProtein(https://www.predictprotein.org/)对其蛋白亚细胞定位进行预测分析;使用PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其启动子区顺式作用元件进行分析;最后通过PlantTFDB(http://planttfdb.gao-lab.org/)对可能与其启动子区存在调控作用的转录因子进行分析预测。
2 结果与分析
2.1 柠条CkLAX3基因的克隆及特性分析
以柠条幼嫩叶片提取出来的RNA经MMLV单酶反转录得到的cDNA为模板,通过PrimeSTAR Max高保真酶设计温度梯度进行PCR扩增,得到大小为1 400 bp 左右的DNA片段(图1)。不同温度之间扩增效率没有明显差异,回收后连接TOPO载体转化大肠杆菌EPI300筛选阳性克隆送测序。测序结果显示,柠条CkLAX3全长1 398 bp,编码465个氨基酸,蛋白分子量为52.27 kDa,理论等电点(pI)为8.64。其中带负电荷氨基酸残基(Asp+Glu)26 个,带有正电荷残基(Arg+Lys)31个,含量最高的亮氨酸共有56个,占氨基酸总数的12%(表2)。经计算,其亲水性的平均值(GRAVY)为0.491,编码1个疏水蛋白,且不稳定性指数(Ⅱ)为28.10,远小于40阈值,可知CkLAX3蛋白质较为稳定。

表2 CkLAX3蛋白氨基酸含量

注:M为D2000 DNA maker条带;1~3泳道为CkLAX3基因片段扩增时3个温度梯度。
2.2 柠条CkLAX3基因保守结构域分析及亲缘关系分析
Pfam的保守结构域分析(http://pfam.xfam.org/)显示,柠条CkLAX3具有与其余物种LAX3相同的Aa_trans 结构域(图2-A)。同时通过MEGA软件对各物种的LAX3基因包括鹰嘴豆(Cicerarietinum)CaLAX3[登录号:A0A1S2Y7I2]、蔓花生(Arachisduranensis)AdLAX3[登录号:A0A6P4B1S4]、葡萄(Vitisvinifera)VvLAX3[登录号:A0A438F8Q9]、红三叶(Trifoliumpratense)TpLAX3[登录号:A0A2K3PD37]、木豆(Cajanuscajan)CcLAX3[登录号:A0A151R1W0]、拟南芥(Arabidopsisthaliana)AtLAX3[登录号:NP_177892]、野大豆(Glycinesoja)GsLAX3[登录号:A0A445K7X9]、大豆(Glycinemax)GmLAX3[登录号:I1KA67]、刺毛黎豆(Mucunapruriens)MpLAX3[登录号:A0A371FEG4]、柠条锦鸡儿CkLAX3进行系统进化分析(图2-B)。从图中可以看出柠条CkLAX3与红三叶及鹰嘴豆LAX3基因亲缘关系较近。

注:A: 不同物种LAX3基因的保守结构域分析结果;B: 不同植物LAX3系统进化树分析;拟南芥AtLAX3序列从Genebank获得,其余物种LAX3序列均从Uniprot获得。
2.3 柠条CkLAX3蛋白结构分析与定位验证
对CkLAX3的二级结构进行分析发现,该蛋白主要由α-螺旋和无规则卷曲组成(图3-A)。其中α-螺旋占比42.80%(竖线最长表示);β-折叠占比18.92%(竖线次长表示);β-转角占比3.01%(绿色竖线表示);无规则卷曲35.27%(竖线最短表示)。通过SWISS-MODEL在线网站(https://swissmodel.expasy.org/interactive)对其蛋白三级结构进行构建(图3-B),发现存在大量跨膜结构。后续对其跨膜结构域进行进一步的分析,结果表明柠条CkLAX3存在10重跨膜结构域(图3-C),为其功能发挥提供了基础。最后对其亚细胞定位进行预测,结果显示其为细胞质膜定位(图3-D),后续对上述预测结果进行了亚细胞定位验证,结果证明CkLAX3确实定位于细胞膜(图3-E)。
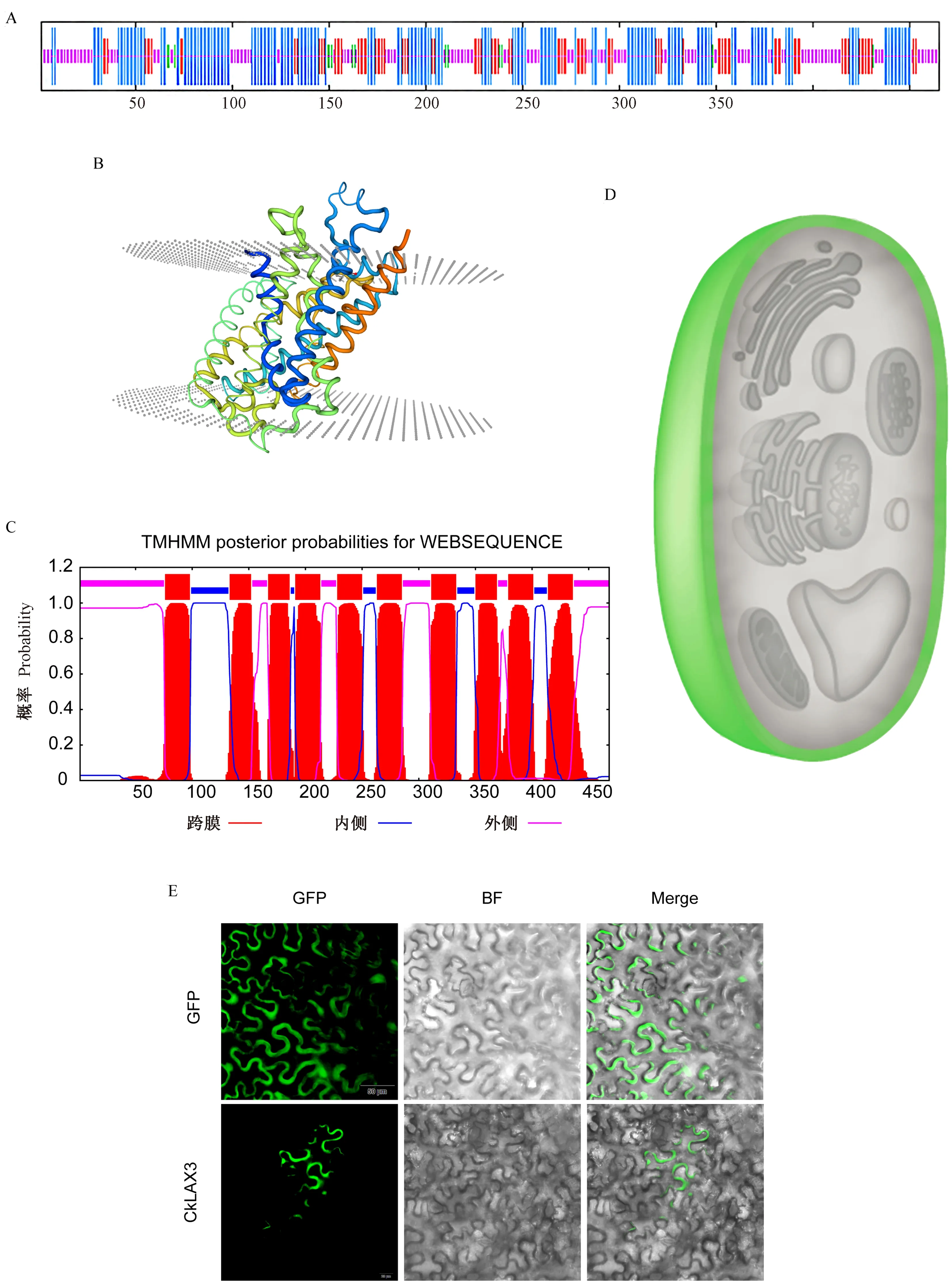
注:A: 柠条CkLAX3蛋白质二级结构分析,数字表示蛋白序列长度;B: 柠条CkLAX3三维结构分析,灰色部分为细胞膜;C: 柠条CkLAX3跨膜结构域分析,红色部分为跨膜区;D: 亚细胞定位预测结果,绿色为预测指示的信号区域,本图中绿色区域为细胞质膜;E: 亚细胞定位结果,GFP表示荧光场,BF表示明场,Merge表示通道叠加结果。
2.4 染色体步移及HiTail-PCR联用扩增CkLAX3基因未知启动子序列
依据已经获得的编码区序列,设计3条特异性R引物,通过染色体步移的方法对柠条CkLAX3的启动子区进行克隆(图4-A、B)。尽管特异性不足,但仍能够看到在600~800 bp之间有一条较亮的条带(图4-B)。将其连同附近难以分离的条带一起切胶回收,连接TOPO载体转化大肠杆菌使用双通用引物PCR鉴定,将不同大小片段均送去测序。经测序,第一次染色体步移得到ATG上游600 bp左右的启动子序列。在此基础上,进一步设计了3条特异性R引物,进行第二次步移(图4-C、D),并改为HiTail-PCR的方法。与普通染色体步移不同,相对较长的LAD引物导致HiTail-PCR第一轮并未有明显条带出现。以第一轮PCR产物原液为模板,使用AC1与CkLAX3-SP2′进行第二轮扩增,得到较为理想的单一条带(图4-D)。切胶回收连接TOPO载体送测序,在第一轮步移的基础上再次获得了800 bp左右的启动子序列,总计获得ATG上游启动子序列1 352 bp。
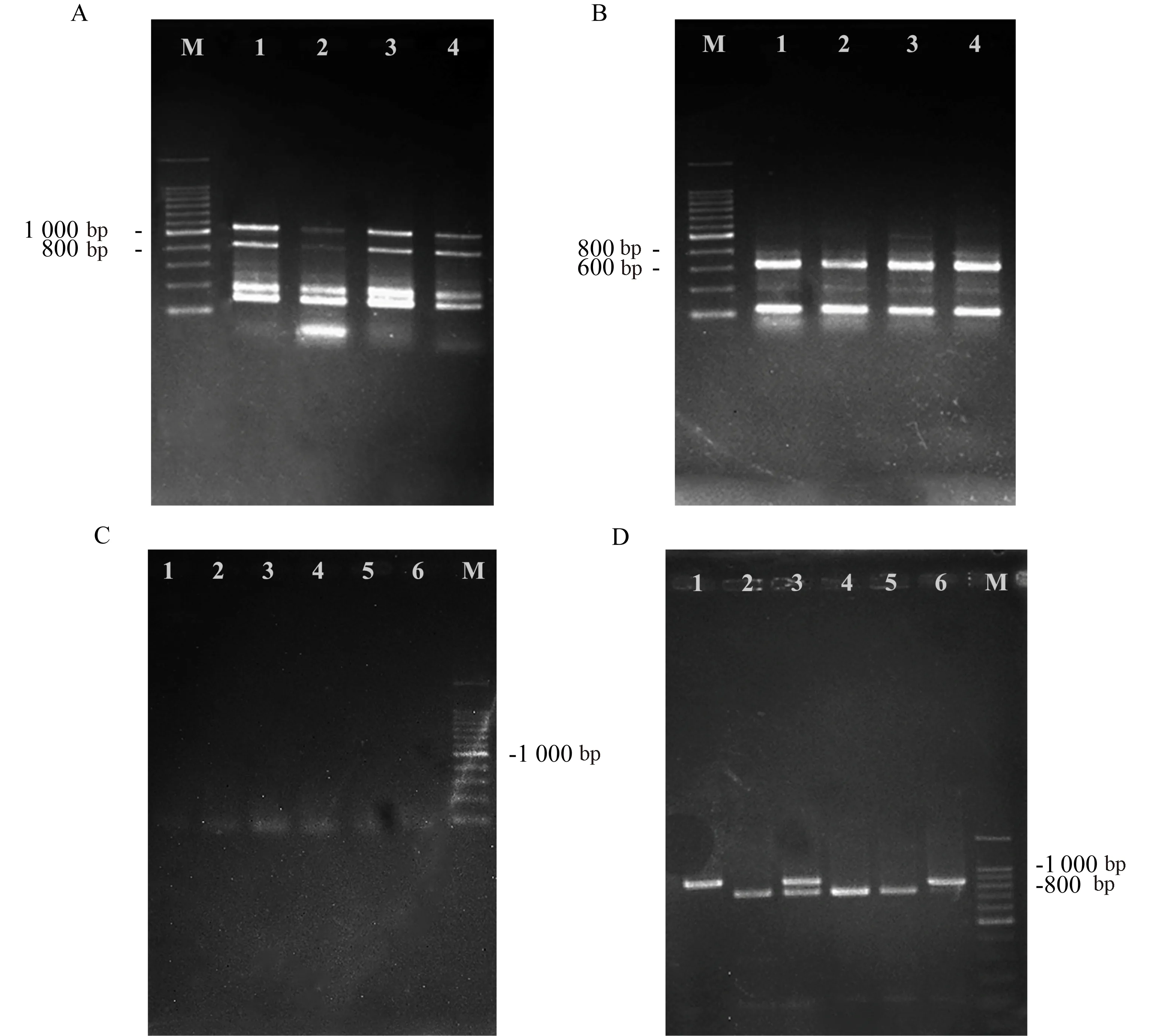
注:A: 柠条CkLAX3第一次染色体步移第一轮结果,1~4泳道分别为引物AP1~AP4;B: 柠条CkLAX3第一次染色体步移第二轮结果,1~4泳道分别为引物AP1~AP4;C: 柠条CkLAX3第二次染色体步移第一轮结果,1~6泳道分别为4条LAD引物两两组合的六种结果;D: 柠条CkLAX3第二次染色体步移第二轮结果,1~6泳道分别为4条LAD引物两两组合的六种结果;图A、B、C中M为200 bp ladder,图D中M为100 bp ladder。
2.5 柠条CkLAX3启动子顺式作用元件分析
通过PlantCARE在线分析启动子上顺式作用元件,该序列中存在大量的响应元件。与光响应相关的元件如G-box、LAMP-element、GT1-motif、TCCC-motif和TCT-motif等,以及激素响应与胁迫响应相关元件,如ABA信号响应元件ABRE、赤霉素响应元件GARE-motif、干旱诱导相关MYB结合位点MBS等(图5)。

图5 柠条CkLAX3启动子上干旱相关响应元件分析
同时使用在线网站PlantTFDB进行的转录因子结合位点预测发现,共有32个家族的365个转录因子可能与CkLAX3的启动子区域结合,其中bHLH家族、ERF家族、MYB家族的成员最多,分别为54、46和29个,说明CkLAX3的功能发挥依赖于上述家族成员的调节(表3)。其中bHLH家族、ERF家族、MYB家族、Dof家族等广泛参与激素信号调控,对生物和非生物胁迫的响应、代谢调节、植物防御机制、植物生长素反应和气孔保卫细胞特异性基因调控等各种植物发育过程。

表3 利用plantTFDB预测CkLAX3启动子区结合的转录因子
2.6 柠条CkLAX3基因干旱响应分析
通过对网站预测结果的分析,发现柠条CkLAX3基因启动子区存在与干旱胁迫响应相关的顺式作用元件。为了明确柠条CkLAX3基因的响应模式,取生长约30 d的柠条锦鸡儿健康幼苗,在最后一次浇水后,自然干旱处理10 d,收集处理组及对照组叶片进行定量分析(图6)。相比于对照组,干旱处理后柠条锦鸡儿中CkLAX3基因的表达量显著上调,表明柠条CkLAX3的表达受干旱胁迫的诱导。
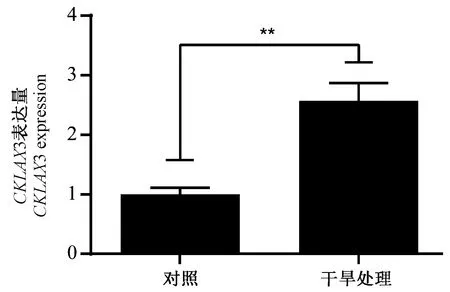
注:**表示在P<0.01水平差异显著。
3 讨论
生长素的功能发挥与其运输载体极性运输形成的生长素梯度密切相关。生长素对于植物生长发育具有双重调节作用,包括植物维管系统发育、顶端生长、衰老调控、生物胁迫等方面[24-27]。上述功能的发挥依赖于生长素从生物合成中心到作用部位的直接运输,形成适宜的生长素流梯度。生长素外排载体(PIN-formed, PIN)蛋白是生长素极性运输的重要调节者,作为生长素外流载体发挥作用[25-27]。拟南芥AtAUX1是首个被发现的生长素内流载体,是生长素氨基酸渗透酶(auxin amino acid permease, AAAP)家族中质子驱动转运蛋白家族的成员[28-29]。在拟南芥中,AUX/LAX家族由4个基因AUX1、LAX1、LAX2和LAX3组成。AUX1在细胞内的分布可能是非对称局部化的,促使生长素流向单列细胞[30]。LAX2和LAX3与AUX1功能相同,因不同的组织水平表达模式,从而调控了不同的发育进程及环境响应。
本研究结果克隆得到了柠条锦鸡儿生长素内流载体CkLAX3基因全长,系统发育分析结果表明CkLAX3与TpLAX3亲缘关系较近。同时亚细胞定位结果表明CkLAX3定位于细胞质膜,与前人研究结果一致[30]。后续通过Genome Walking及HiTail-PCR联用,克隆得到了柠条锦鸡儿CkLAX3基因5′上游未知启动子区序列1 352 bp。经Plantcare网站分析发现CkLAX3基因启动子区存在大量ABA响应元件、干旱响应元件、光响应元件、赤霉素响应元件等,由此可推测其可能通过激素信号和光信号以及干旱响应传递逆境胁迫响应。
近年来越来越多的研究结果表明,植物干旱胁迫过程不仅有脱落酸、水杨酸、乙烯等激素的参与,还有生长素的参与[8, 31]。生长素的含量在干旱条件下被下调,植物通过减缓自身生长速率来减少对水分的需求,增加其在干旱胁迫下的存活率。但生长素的生物合成量减少并不影响植物体内已经合成的生长素通过极性运输发挥功能。对自然干旱处理后的柠条锦鸡儿定量分析发现,CkLAX3的表达量受到干旱胁迫的诱导。LAX3与AUX1功能相似,在植物体内以生长素内流载体的形式在生长素的极性运输过程中发挥着重要的调控作用,由于LAX3发现较晚,目前的研究相对较少,但有研究表明其参与了重力应答下的茎木质部次生发育[15],发达的木质部可以为植物提供更强的机械支撑以及水分运输,有利于植物抵御干旱。本试验以柠条CkLAX3为研究对象,对其蛋白结构、理化性质以及调控模式做了初步探究,推测CkLAX3在促进柠条锦鸡儿叶脉发育从而提高抗旱性中发挥重要作用,但具体的调控机制还有待进一步的研究。
4 结论
本研究通过设计引物扩增得到柠条CkLAX3全长序列1 398 bp,编码465个氨基酸的疏水性蛋白。系统发育分析表明CkLAX3与红三叶及鹰嘴豆的LAX3亲缘关系较近,其中与红三叶TpLAX3最为相似。生信分析发现CkLAX3蛋白具有10重跨膜结构域且亚细胞定位试验证明其定位于细胞质膜。通过染色体步移克隆得到柠条CkLAX3基因未知启动子序列1 352 bp,其启动子区存在大量ABA响应元件、干旱响应元件、光响应元件等,推测其在干旱响应中发挥作用。因此对柠条锦鸡儿进行干旱处理验证,定量分析结果证明CkLAX3的表达受干旱胁迫的诱导,说明该基因在柠条锦鸡儿应对干旱胁迫中发挥重要作用。
