19例合并2型糖尿病的干眼症患者干眼症症状、角膜神经病变观察及相关性分析
2022-05-05金梅罗晓燕曲利利
金梅,罗晓燕,曲利利
1 广东省中西医结合医院眼科,广东佛山528200;2 南方科技大学医院眼科
2 型糖尿病(T2DM)是全球高发的慢性疾病,国际糖尿病联盟报道程全球糖尿病患病人数从2000年的1.51亿上升到2019年的4.63亿,其中420万人死于糖尿病,占全球死亡人数的11.3%[1]。T2DM 是干眼症的危险因素之一,与健康受试者相比,T2DM患者中干眼症的患病率明显增加[2]。据统计社区2型糖尿病干眼症的发病率为17.5%~33.7%,且随着年龄的增加和糖尿病病程的延长,干眼症发病率逐渐增加[3-4]。干眼症可导致泪膜不稳定、眼表炎症和角膜神经病变,角膜神经病变主要表现为角膜神经长度或密度显著减少以及神经迂曲等形态异常,角膜神经损伤尤其是神经纤维密度降低严重影响干眼症患者主观视觉质量[5]。角膜共聚焦显微镜是目前可以无创拍摄基底下神经丛图像的惟一方法,可在细胞水平上观察活角膜神经改变[6]。本研究观察了合并T2DM 的干眼症患者干眼症症状、角膜神经病变情况,并分析两者的相关性。
1 资料与方法
1.1 临床资料 选择2019 年1 月—2021 年9 月广东省中西医结合医院收治的T2DM 患者65 例。T2DM 诊断标准[7]:任意时间血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L,餐后2 小时血糖≥11.1 mmol/L。干眼症诊断标准[8]:主诉眼部干涩感、异物感、烧灼感、疲劳感、不适感、眼红、视力波动等主观症状,且非接触式泪膜破裂时间(NIBUT)≤5 s或无眼表麻醉状态下泪液分泌试验(Schiemer Ⅰ试验)≤5 mm/5 min;或有主观症状,5 s<NIBUT≤10 s,5 mm/5 min<Schiemer Ⅰ试验≤10 mm/5 min,同时角结膜荧光素染色阳性。纳入标准:①符合《中国2型糖尿病防治指南(2017年版)》诊断标准[7];②年龄18周岁以上;③患者及其家属均知情同意签署同意书。排除标准:①患有结膜炎、角膜炎等眼表炎性疾病;②既往有眼外伤史或近3月有眼部手术史;③过去3 个月内佩戴隐形眼镜者;④最佳矫正视力<20/20;⑤恶性肿瘤、风湿免疫疾病。所有患者根据是否发生干眼症将患者分为两组。干眼症组19 例,男8例,女11 例;年龄51~72(60.32 ± 6.09)岁;BMI 20~26(23.05 ± 1.35)kg/m2;T2DM 病 程4~8(6.59± 1.52)a;合并疾病:高血压7 例,高脂血症4例;视网膜病变3例。糖尿病组46例,男19例,女27例;年 龄52~73(60.75 ± 6.21)岁;BMI 20~26(23.11 ± 1.42)kg/m2;T2DM 病 程2~5(4.02 ±1.17)a;合并疾病:高血压15例,高脂血症9例;视网膜病变6 例。视网膜病变参考糖尿病视网膜病变国际临床分级标准(2002 年)[9]。另选择38 例同期于我院体检的志愿者作对照(对照组),男15 例,女23例;年 龄52~75(60.98 ± 6.12)岁;BMI 21~27(23.24±1.41)kg/m2;排除眼表和眼底疾病、T2DM、多发性硬化、原发性干燥综合征等。各组一般资料无统计学差异,具有可比性。本研究已经获得广东省中西医结合医院伦理委员会批准,入选对象均签述知情同意书。
1.2 干眼症症状评估方法 采用标准干眼症状评估(SPEED)问卷[10]从眼部干涩感、异物感、疼痛、烧灼感或流泪4 个维度进行评分,满分0~24 分。NIBUT:采用荧光素钠眼科检测试纸条前段圆形部分浸入患者下睑结膜,嘱缓慢眨眼3~4次,计算自最后1 次瞬目至泪膜出现第1 个黑斑的时间。Schirmer Ⅰ实验:无眼球表面麻醉,采用40 mm×5 mm带毫米刻度的泪液检测滤纸置入眼下结膜囊中外1/3处,5 min后取出滤纸,记录滤纸浸湿的长度。1.3 角膜神经病变评估方法 采用角膜共聚焦显微镜检查,选取HRT-Ⅲ角膜模块,参数设置:氦氖二极管激光器激光波长670 nm,放大倍数800倍,视野400 μm×400 μm,图像分辨率384×384 像素,轴向分辨率0.5~1 μm,深度分辨率为1~2 μm。患者取端坐位,0.5%盐酸丁卡因滴于眼球表面,麻醉受检眼,卡波姆凝胶(德国博士伦公司)涂于镜头表面,安装一次性角膜接触帽,嘱患者前额和下颌分别固定于前额架及下颌托,调整镜片位置和焦点以获得清晰图像,拍摄期间患者保持静止,每张图片采集从角膜中央浅表上皮开始直到内皮,每只眼睛拍摄30~40 张图像。从与角膜表面平行、角膜基底上皮和鲍曼层之间的基底层中选择图像,排除强烈伪影图像。Image J半自动图像处理软件和Neuron J插件描记基底膜下神经密度,测量每平方微米主干神经数量、主干神经长度、主干神经起止相连直线长度,计算主干神经弯曲度=主干神经长度/起止相连直线长度。以上测量工作由我院眼科2 名主治医师完成,两者误差超过10%时由副主任医师参与分析,取两个最相近结果平均值。
1.4 统计学方法 采用SPSS25.0统计软件。符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析和独立样本t检验;相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组SPEED 评分、NIBUT 泪膜破裂时间、Schiemer Ⅰ滤纸浸湿长度比较 SPEED评分、NIBUT泪膜破裂时间、Schiemer Ⅰ滤纸浸湿长度比较见表1。
表1 各组SPEED评分、NIBUT泪膜破裂时间、Schiemer Ⅰ滤纸浸湿长度比较(±s)
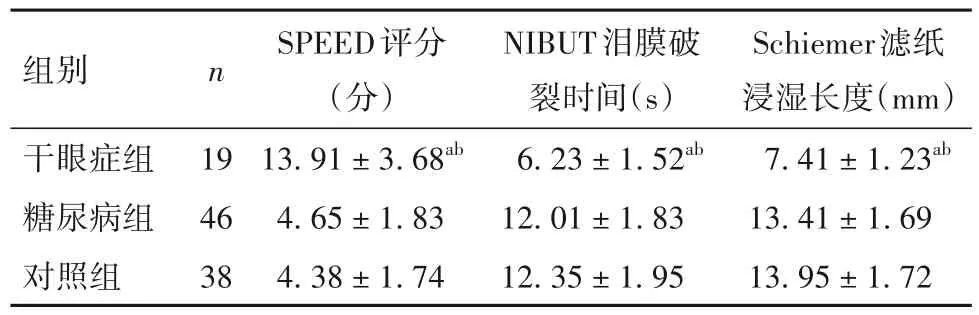
表1 各组SPEED评分、NIBUT泪膜破裂时间、Schiemer Ⅰ滤纸浸湿长度比较(±s)
注:与对照组比较,aP<0.05;与糖尿病组比较,bP<0.05。
组别干眼症组糖尿病组对照组n 19 46 38 SPEED评分(分)13.91±3.68ab 4.65±1.83 4.38±1.74 NIBUT泪膜破裂时间(s)6.23±1.52ab 12.01±1.83 12.35±1.95 Schiemer滤纸浸湿长度(mm)7.41±1.23ab 13.41±1.69 13.95±1.72
2.2 各组神经密度、主干神经长度、主干神经数量、主干神经弯曲度比较 神经密度、主干神经长度、主干神经数量、主干神经弯曲度比较见表2。
表2 各组神经密度、主干神经长度、主干神经数量、主干神经弯曲度比较(±s)
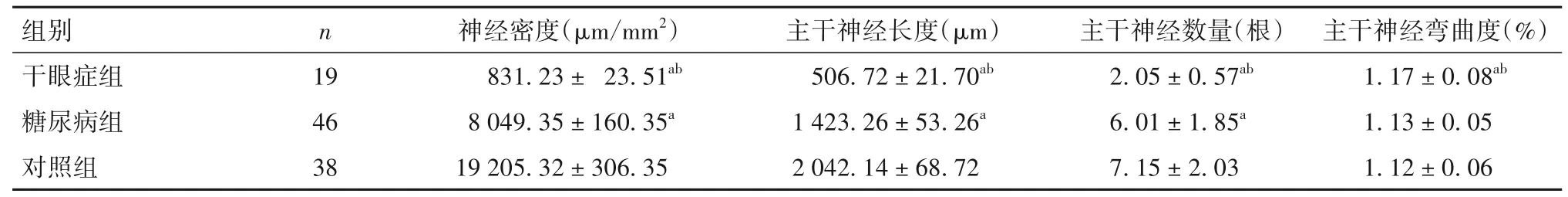
表2 各组神经密度、主干神经长度、主干神经数量、主干神经弯曲度比较(±s)
注:与对照组比较,aP<0.05;与糖尿病组比较,bP<0.05。
组别干眼症组糖尿病组对照组n 19 46 38神经密度(μm/mm2)831.23± 23.51ab 8 049.35±160.35a 19 205.32±306.35主干神经长度(μm)506.72±21.70ab 1 423.26±53.26a 2 042.14±68.72主干神经数量(根)2.05±0.57ab 6.01±1.85a 7.15±2.03主干神经弯曲度(%)1.17±0.08ab 1.13±0.05 1.12±0.06
2.3 干眼症组干眼症症状指标与角膜神经病变指标的相关性 干眼症组SPEED 评分与神经密度、主干神经长度、主干神经数量呈负相关(r分别为-0.376、-0.293、-0.307,P均<0.05),与主干神经弯曲度呈正相关(r为0.257,P<0.05);NIBUT 泪膜破裂时间与神经密度、主干神经长度、主干神经数量呈正相关(r分别为0.402、0.302、0.367,P均<0.05),与主干神经弯曲度呈负相关(r为-0.253,P<0.05);Schiemer Ⅰ滤纸浸湿长度与神经密度、主干神经长度、主干神经数量呈正相关(r分别为0.406、0.317、0.278,P均<0.05),与主干神经弯曲度呈负相关(r为-0.225,P<0.05)。
3 讨论
干眼症指因任何原因引起的泪液质量或数量或泪液动力学异常,继而导致的眼部不适、视力障碍、泪膜稳定性下降以及潜在眼表损害等综合征。长期高血糖引起眼表细胞内葡萄糖含量增加,葡萄糖通过还原反应生成山梨醇,山梨醇积聚可引起渗透压增高和细胞水肿,丧失正常生理功能,导致泪腺结构和功能异常,泪液分泌量减少[11]。角膜是人体内神经支配最多的组织,其神经密度是皮肤的300~600倍,角膜神经可感知触觉、疼痛和温度,并在眨眼反射、伤口愈合和泪液分泌中起重要作用。角膜神经在角膜感染、角膜损伤、手术以及三叉神经损伤等各种眼部疾病中减少,除些之外干眼症患者角膜神经长度也显著缩短,角膜神经受损导致眨眼和泪液反射减弱,影响泪膜稳定性[12]。
角膜共聚焦显微镜是一种简单快捷、无创、可重复操作的视神经小纤维损伤定量评估技术,目前已用于多发性硬化、甲状腺相关性眼病、干燥综合征等多种疾病的角膜神经病变评估。汪美奂等[13]采用角膜共聚焦显微镜观察系统性红斑狼疮所致干眼患者角膜神经发现其角膜神经纤维密度、角膜神经纤维分支密度、角膜神经纤维长度较未合并干眼症患者降低,角膜神经纤维迂曲度较未合并干眼症患者增加。GUERRERO-MORENO 等[12]在继发于原发性睑板腺功能障碍或自身免疫性干眼症的神经性角膜疼痛患者中也发现角膜神经结构异常,表现为神经迂曲度增加,神经密度降低。但是目前较少报道T2DM干眼症患者角膜神经病变情况。本研究发现,干眼症组角膜基底膜下神经密度、主干神经长度、主干神经数量均较对照组降低,说明T2DM 干眼症可引起角膜神经数量减少,密度降低,长度缩短以及形态改变。长期高血糖促使晚期糖基化终末产物(AGEs)在角膜上皮基底膜中沉积,影响角膜黏附和移行,导致角膜上皮愈合延迟,AGEs与其受体RAGE 相互作用促使细胞内活性氧产生,诱导氧化应激反应,促使角膜神经细胞凋亡[14-15]。本研究还显示,与对照组比较,干眼组、糖尿病组均存在不同程度角膜神经损伤,说明T2DM 可引起角膜神经损伤;与糖尿病组比较,干眼症组角膜神经损伤更为明显,表明T2DM 和干眼症同时存在能加速角膜神经形态和结构改变,提示T2DM 可能诱导角膜神经损伤,促使干眼症发生和进展。
角膜神经是控制眼表稳态的关键组成部分,主要起源于三叉神经的眼支,负责角膜、眼睑和结膜的感觉信号传导,并控制眨眼运动以及泪液分泌,在维持泪液体积和成分方面发挥着不可或缺的作用,角膜神经形态、数量、敏感性改变均可影响泪腺功能,诱发干眼病[16]。本研究显示,干眼症组SPEED 评分与神经密度、主干神经长度、主干神经数量呈负相关,与主干神经弯曲度呈正相关,NIBUT、Schiemer Ⅰ则相反,表明T2DM 患者角膜神经病变越重,干眼症状越明显。LIU 等[17]分析结果显示,角膜神经长度与干眼症患者对光敏感度呈负相关,神经迂曲度与对光敏感度呈正相关,神经宽度与眼表疾病指数、疼痛和视力模糊程度呈正相关,说明角膜神经长度缩短、宽度和迂曲度增加可能导致干眼程度加重以及视觉质量下降。角膜神经调控泪液分泌主要通过刺激三叉神经—副交感神经反射来实现,来自角膜神经的感觉信息传入大脑泪核,反过来刺激面神经的传出交感神经和副交感神经纤维,并向泪腺发出信号以分泌泪液。角膜神经病变可导致神经通路中断以及眼表和泪腺之间的神经反馈回路异常,导致泪液分泌减少,泪膜稳定性下降[18]。
总之,T2DM 患者存在不同程度的角膜神经病变,当发生干眼症时,角膜神经病变更为严重,角膜神经数量、密度、长度明显减少,迂曲度明显增加,与干眼症严重程度密切相关。
