丁香不同部位挥发油的GC-MS成分分析和抗氧化活性比较
2022-05-01左遨勋刘积光高玉梅刘平怀
左遨勋,刘积光,高玉梅,刘平怀
(海南大学,海南 海口 570228)
丁香(Eugenia caryophyllata Thunb.)属桃金娘科植物,是原产于印度尼西亚的一种香料[1]。现已在世界各地广泛种植,主要有印度尼西亚、桑给巴尔和马达加斯加岛[2]。丁香是中国的传统进口“南药”之一,我国从20世纪50年代开始引种,目前在海南、广东、云南等地均有栽培[3]。植物挥发油,也叫植物精油,是一种次生代谢物质,通常从芳香植物中提取[4]。在我国传统中医实践中,医食同源的理念一直贯穿于其中,现在研究表明,丁香花蕾含有挥发油,油中主要含丁香酚、丁香油酸、乙酰丁香油酸及丁香烯、甲基正戊酮、甲基正庚酮、香荚兰醛等成分。
目前国内外对丁香挥发油的研究多集中于丁香花蕾,缺乏对丁香其他部位的挥发油的研究。为了全面开发丁香全植株,本文通过水蒸气蒸馏法提取丁香4个不同部位的挥发油,并通过气相色谱-质谱(gas chromatography mass spectrometry,GC-MS)法鉴定丁香花蕾、丁香果实、丁香叶和丁香枝挥发油的化学成分,并研究丁香4个不同部位挥发油的抗氧化活性,填补了丁香全株挥发油抗氧化活性研究方面的空白,为后续综合利用丁香全植株挥发油提供理论依据。
1 材料与方法
1.1 材料与试剂
丁香花蕾:中国广西省药材市场;丁香果实:中国海南省三亚市药材市场;丁香枝、丁香叶:采自海南省兴隆热带植物园,采集的样品为带叶小枝,随后枝叶分离,自然风干。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、过硫酸钾、三氯乙酸:上海麦克林生化科技有限公司;无水乙醇、三氯化铁:西陇化工股份有限公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS)、铁氰化钾:上海源叶生物科技有限公司;2,4,6-三(2-吡啶基)三嗪[2,4,6-tris(2-pyridyl)-striazine,TPTZ]:上海阿拉丁生化科技有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
气相色谱质谱联用仪(Thermo Trace 1300):美国赛默飞世尔公司;紫外可见分光光度计(TU-1810PC):北京普析通用仪器有限责任公司;实验室超纯水机(Smart S-15):上海和泰仪器有限公司;酶标仪(xMark):BIO-RAD 公司;旋转蒸发仪(RV10plus):艾卡仪器设备有限公司。
1.3 方法
1.3.1 挥发油的制备
丁香4个部位挥发油采用重挥发油提取装置[5-6],经水蒸汽蒸馏法提取,料液比为1∶8(g/mL),各部位提取的挥发油具有浓郁的香气,由花蕾部位得到占样品总质量12%的淡黄色透明挥发油,由果实部位得到占样品总质量2%的黄色透明挥发油,由枝部位得到占样品总质量0.9%的黄色透明挥发油,由叶部位得到占样品总质量2.8%的黄色透明挥发油。
1.3.2 化学分析
1.3.2.1 气相色谱条件
气相色谱检测条件:色谱柱Agilent 122-5532UI,DB-5ms Ultra Inert,30 m×250 μm×0.25 μm;进样口温度250 ℃,柱前压 48.27 kPa,进样量 1 μL,载气(He)流量1 mL/min,分流15 mL/min。程序升温:起始温度40℃,保持1min,以40℃/min升温至120℃,以5℃/min升温至240℃,最后以12℃/min升温至300℃,保持6min。
1.3.2.2 质谱条件
质谱检测条件:电子轰击离子源电离方式,电子能量70 eV,接口温度280℃,离子源温度250℃,质量扫描范围m/z 35~350。
1.3.3 体外抗氧化活性的测定
1.3.3.1 DPPH·清除能力测定
根据文献[7],稍作修改。配制质量浓度为60μmol/L DPPH-乙醇溶液,加入0.5 mL丁香不同部位挥发油,置于阴暗处反应30 min,乙醇调零后在波长517 nm处测量吸光度,阳性对照为VC,DPPH·清除率计算公式如下。

式中:A0为0.5 mL乙醇+4.5 mL DPPH的吸光度;A1为0.5 mL供试品+4.5 mL乙醇的吸光度;A2为0.5 mL供试品+4.5 mL DPPH的吸光度。
1.3.3.2 ABTS+·清除能力测定
参照文献[8-9],取质量浓度为7 mmol/L的ABTS溶液和质量浓度为2.45 mmol/L的过硫酸钾溶液,按相同体积混合,避置于阴暗处反应24 h,稀释后使ABTS混合液吸光值为0.700±0.050;取1.9 mL ABTS混合液加入50 μL乙醇稀释的不同浓度的丁香挥发油,置于暗处反应6 min,在波长734 nm处测量吸光度,阳性对照为VC,ABTS+·清除率计算公式如下。
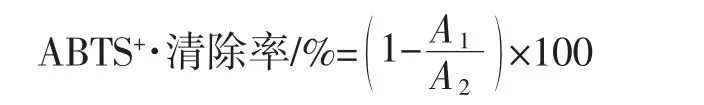
式中:A1为样品组吸光度;A2为对照组吸光度。
1.3.3.3 还原力测定
参照文献[10-11],取0.5 mL样品,依次加入2.5 mL 0.2 mol/L PBS溶液(pH6.6)、2.5 mL 1%铁氰化钾溶液,充分混合。将混合后的溶液放置在50℃水浴锅中反应25 min,再向离心管中加入2.5 mL三氯乙酸溶液,充分混合后离心;吸取上层澄清液体2.5 mL加入2.5 mL蒸馏水、0.5mL 0.1%三氯化铁溶液,摇匀后反应10 min;最后在700nm波长处测定其吸光度,以此表征还原力。
1.3.3.4 铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定
参照文献[12],取2.5 mL 20 mmol/L的FeCl3溶液、10 mmol/L TPTZ溶液与300 mmol/L醋酸-醋酸钠缓冲液(pH3.6)按照体积比 1∶1∶10 混合;吸取各浓度混合液于593 nm下测定吸光度A1;加入20 μL稀释到适宜浓度的提取液,反应10 min,测定吸光度A2。计算反应后吸光度减去反应前的吸光度的数值A0,在标准曲线上找到该提取液吸光值A0对应的FeSO4浓度,此浓度即FRAP值。标准曲线回归方程为y=0.000 6x+0.099 8,线性范围 0~3 000 μmol/L(R2=0.999 8)。
1.4 数据处理
运用IBM SPSS Statistics 22.0和Origin 9.64软件进行数据处理,结果表示为平均值±标准差,所有数据均重复试验3次。
2 结果与分析
2.1 挥发油GC-MS分析
表1比较了经GC-MS测定的丁香不同部位挥发油的成分及含量。
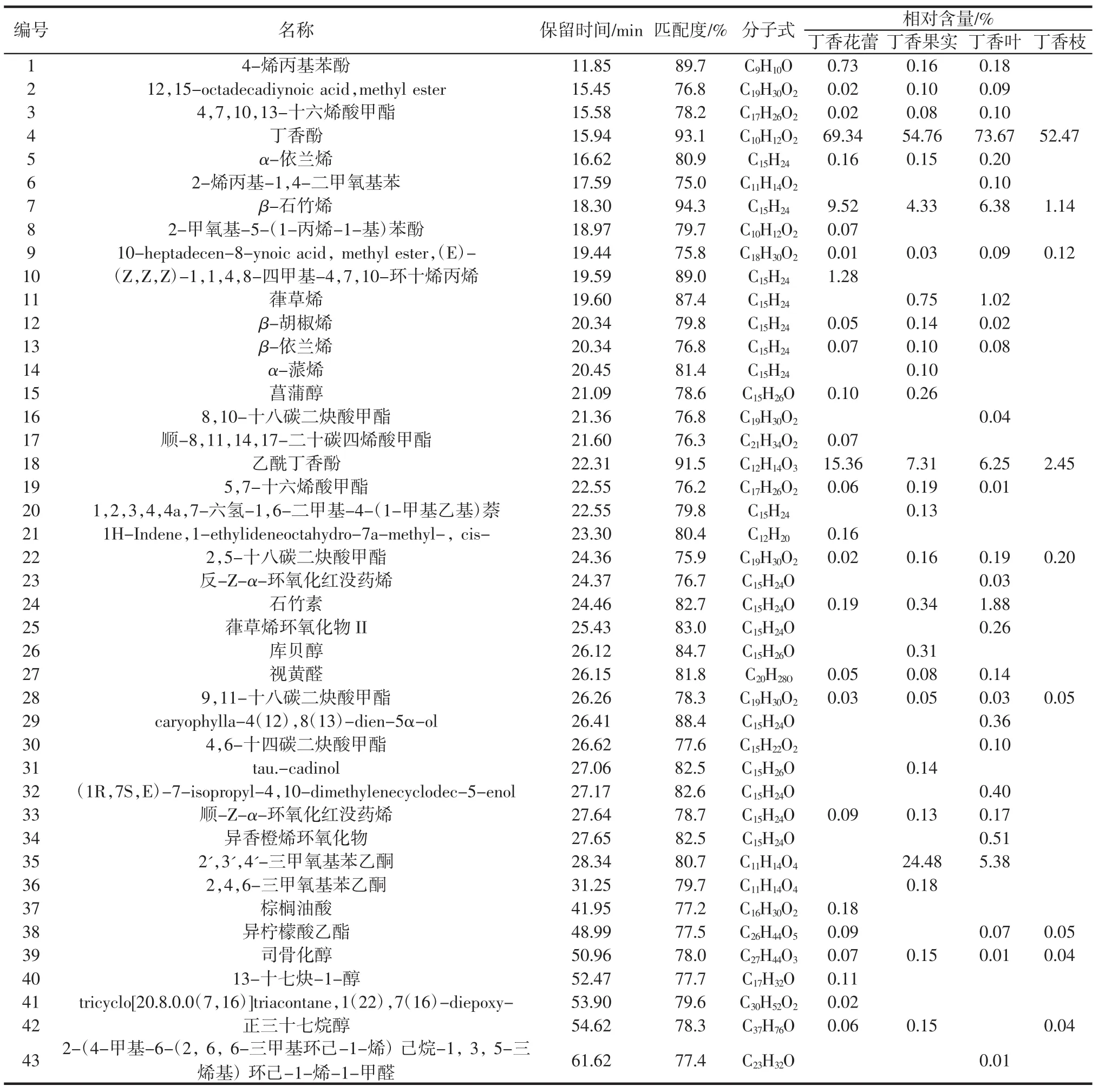
表1 丁香不同部位挥发油成分GC-MS分析Table 1 GC-MS analysis of volatile oil of different parts of clove
从丁香花蕾、果实、叶、枝中得到含量为12%、2%、2.8%、0.9%的浅黄色透明挥发油,皆具有浓香味。由表1可知,丁香4个不同部位挥发油共鉴定出43种化学成分,其中倍半萜类为 α-依兰烯、β-石竹烯、(Z,Z,Z)-1,1,4,8-四甲基-4,7,10-环十烯丙烯、葎草烯、β-胡椒烯、β-依兰烯、菖蒲醇、1,2,3,4,4a,7-六氢-1,6-二甲基-4-(1-甲基乙基)萘、反-Z-α-环氧化红没药烯、石竹素、葎草烯环氧化物II、库贝醇、顺-Z-α-环氧化红没药烯、caryophylla-4(12),8(13)-dien-5α-ol、α-蒎 烯、tau.-cadinol、(1R,7S,E)-7-isopropyl-4,10-dimethylenecyclodec-5-enol、异香橙烯环氧化物;炔酯类有 12,15-octadecadiynoic acid,methyl ester、10-heptadecen-8-ynoic acid,methyl ester,(E)-、8,10-十八碳二炔酸甲酯、5,7-十六烯酸甲酯、2,5-十八碳二炔酸甲酯、9,11-十八碳二炔酸甲酯、4,6-十四碳二炔酸甲酯;烯酯类为 4,7,10,13-十六烯酸甲酯、顺-8,11,14,17-二十碳四烯酸甲酯;酚类有4-烯丙基苯酚、丁香酚、2-甲氧基-5-(1-丙烯-1-基)苯酚;醚类为2-烯丙基-1,4-二甲氧基苯、tricyclo[20.8.0.0(7,16)]triacontane,1(22),7(16)-diepoxy-;此外还有少量的酚酯、烯烃、二萜、芳香酮、脂肪酸、醇类等物质。其中丁香酚、β-石竹烯、乙酰丁香酚、2,5-十八碳二炔酸甲酯、9,11-十八碳二炔酸甲酯、司骨化醇、10-heptadecen-8-ynoic acid,methyl ester,(E)-为丁香不同部位挥发油的7个共有成分。
丁香酚、β-石竹烯、乙酰丁香酚作为丁香不同挥发油的共有成分,这3种成分在丁香花蕾中的总比例为94.22%,在丁香果实中的总比例为66.40%,在丁香叶中的总比例为86.30%,在丁香枝中的总比例为56.06%,相对含量均达到50%以上,且在丁香叶中的含量与丁香花蕾中的含量比较接近。但丁香叶和丁香果实的主要成分种类更接近,都含有较高比例的2',3',4'-三甲氧基苯乙酮,而丁香花蕾和丁香枝中则没有此成分。丁香枝挥发油检出的成分种类最少,但其中的异柠檬酸乙酯是丁香果实不具有的,正三十七烷醇是丁香叶挥发油不具有的。
2.2 抗氧化活性评价
2.2.1 DPPH·清除能力
图1比较了丁香不同部位挥发油与VC的DPPH·清除能力。

图1 丁香不同部位挥发油与VC的DPPH·清除能力Fig.1 DPPH·scavenging ability of volatile oil of different parts of clove and VC
由图1可知,在一定范围内,DPPH·的清除率与浓度有良好的量效关系。随着丁香挥发油浓度的增加,DPPH·清除率也随之增加。根据拟合曲线,VC、丁香叶、丁香花蕾、丁香果实和丁香枝的DPPH自由基清除能 力的 IC50值分别为 (2.51±0.12)、(21.37±0.32)、(37.35±0.82)、(98.18±0.50)、(28.14±0.46)μg/mL。在0~64.23 μg/mL,丁香枝的DPPH·清除率高于丁香花蕾;在 64.23 μg/mL~700 μg/mL,丁香花蕾的 DPPH·清除率高于丁香枝。丁香叶的DPPH·清除率最高但低于VC,丁香果实的DPPH·清除率最低。
2.2.2 ABTS+·清除活性
丁香不同部位挥发油与VC的ABTS+·清除能力见图2。

图2 丁香不同部位挥发油与VC的ABTS+·清除能力Fig.2 ABTS+·scavenging ability of volatile oil of different parts of clove and VC
由图2可知,ABTS+·清除率随着丁香挥发油浓度的增加而增加。VC、丁香叶、丁香花蕾、丁香果实和丁香枝 ABTS+·清除率的 IC50值分别为 (47.77±0.87)、(117.32±0.63)、(139.48±0.76)、(244.99±1.21)、(141.61±0.84)μg/mL。在较低的浓度下,丁香花蕾和丁香枝ABTS+·清除率接近。整体上,ABTS+·清除率大小顺序依次为VC>丁香叶>丁香花蕾>丁香枝>丁香果实,说明丁香不同部位挥发油均具有良好的ABTS+·清除活性。
2.2.3 还原力
图3比较了丁香不同部位挥发油与VC的还原力。

图3 丁香不同部位挥发油与VC的还原力Fig.3 Reducing power of volatile oil of different parts of clove and VC
还原力常被用作供电子活性的标准,这是测试酚类化合物抗氧化作用的重要机制[13]。还原力也被用作检测中药材抗氧化活性的重要指标[14-15]。由图3可知,丁香叶、丁香花蕾、丁香果实、丁香枝和VC的还原力都随着浓度的增加而增大,大小顺序依次为VC>丁香叶>丁香花蕾≈丁香枝>丁香果实,表明丁香的这些部位都有较好的还原力。
2.2.4 FRAP值
丁香不同部位挥发油与VC的FRAP值见图4。

图4 丁香不同部位挥发油与VC的FRAP值Fig.4 FRAP values of volatile oil of different parts of clove and VC
研究发现,生物活性化合物的供电子与抗氧化活性有关[16-17]。化合物的还原力可以作为其潜在抗氧化活性的一个重要指标。在有还原剂(如抗氧化剂)存在的情况下,Fe3+/铁氰化物复合物会被还原成亚铁形式的抗氧化剂[18]。图4显示,FRAP值随着浓度的增加而增大。VC的FRAP值最大,其次是丁香叶,而丁香花蕾和丁香枝表现出近似的FRAP值,丁香果实最低。在测量的浓度范围内,FRAP值与质量浓度有良好的量效关系,表明丁香不同部位挥发油具有较强的铁离子还原能力。
3 结论
总的来说,丁香不同部位挥发油含有多种相同的成分,丁香酚、β-石竹烯、乙酰丁香酚3种主要成分的总含量都在50%以上,表明了丁香各部位挥发油均具有较高的研究价值,而丁香枝挥发油成分种类与其他3个部位有较大的差异。
抗氧化试验结果表明,丁香挥发油具有显著的抗氧化活性,这可能与丁香酚和乙酰丁香酚等酚类化合物的含量较高有关。通过与对照组VC的比较可以得出,丁香叶、丁香花蕾、丁香果实和丁香枝的挥发油均具有良好的抗氧化性能。因此,从丁香不同部位中提取的挥发油可以作为一种天然抗氧化剂,在食品、药品的长期储存等方面具有潜在应用价值。
