提取方式对十字花科蔬菜中异硫氰酸酯的影响
2022-05-01张尧NyashaMakaza吕城枝孙娟宋新杰SabirNishanbaev吴元锋毛建卫
张尧,Nyasha Makaza,吕城枝,孙娟,宋新杰,Sabir Z Nishanbaev,吴元锋*,毛建卫
(1.浙江科技学院生物与化学工程学院,浙江 杭州 310023;2.浙江省农业生物资源生化制造协同创新中心(2011协同创新中心),浙江 杭州 310023;3.乌兹别克斯坦科学院植物化学研究所,乌兹别克斯坦 塔什干 100170)
现代流行病学研究表明,经常食用西兰花、甘蓝、花菜、羽衣甘蓝、萝卜等十字花科蔬菜可有效降低癌症、心血管疾病、糖尿病、阿兹海默症等疾病的发生率。这是由于这些蔬菜含有丰富的抗坏血酸、膳食纤维、黄酮、类胡萝卜素、硫代葡萄糖苷等活性成分[1-2]。硫代葡萄糖苷是一类含硫的次生代谢产物,基于衍生氨基酸的差异可将其分为脂肪族、芳香族和吲哚族硫苷三类[3]。当十字花科蔬菜被切割或啃食时,细胞中储存的内源性黑芥子酶将硫代葡萄糖苷水解为异硫氰酸酯(isothiocyanate,ITC)。但在 Fe2+或上皮硫特异蛋白(epithiospecifier protein,ESP)催化作用下,会转化为腈类物质[4](图1)。

图1 黑芥子酶对硫代葡萄糖苷的水解作用Fig.1 The hydrolysis effects of myrosinase on glucosinolate
研究表明,ITC具有抑制I型酶、激活II型酶、激活Keap1-Nrf2-ARE通路等多种活性,可显著降低肝癌、胃癌、肺癌、乳腺癌、宫颈癌等癌症的发生率。同时其还具有抗氧化、提高免疫力、抗氧化等多种功能[1,5-6]。常见的脂肪族ITC包括萝卜硫素(又名莱菔硫烷,sulforaphane,SF)、莱菔素(sulforaphene,SFE)、芝麻菜素(erucin,ER)、庭荠素(alyssin)、3-甲基亚磺酰丙基异硫氰酸酯(iberin)、3-(甲硫基)丙基异硫氰酸酯(iberverin)等,芳香族ITC主要有异硫氰酸苯甲酯(phenyl benzyl isothiocyanate,BITC)、异硫氰酸苯乙酯(phenyl ethyl isothiocyanate,PEITC)等[1,3,7]。在这些 ITC 中,SF 活性最强[8],SFE、ER、PEITC 等也具有较强的活性[9-12]。
目前对ITC已有一定研究,主要集中于提取工艺的优化[13-17]。程立等[18]使用纯化并固定化后的黑芥子酶生产SFE,使底物转化率提高2.7~8.0倍。但关于提取剂添加方式的研究尚未见报道。提取ITC的传统方法是先酶解后提取(hydrolysis followed by extraction,HFE),即先加入缓冲液,使硫代葡萄糖苷酶解为ITC,再用有机溶剂提取[19]。本文采用同时加入缓冲液和有机溶剂,即酶解和提取同时进行(simultaneous hydrolysis and extraction,SHE)的方式提取ITC,缩短了提取工艺。进而比较不同提取方式(SHE和HFE)对6种常见的十字花科蔬菜(萝卜、芥菜、榨菜、甘蓝、花菜和西兰花)种子中ITC种类和含量的影响,以期从蔬菜中获得高含量和高活性的ITC。
1 材料与方法
1.1 材料与试剂
石油醚、乙酸乙酯、甲醇、氯化钠、无水硫酸钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、1,2-苯二硫醇乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均为分析纯):上海凌峰化学试剂有限公司;NAD(P)H:醌氧化还原酶 1[NAD(P)H:quinone oxidoreductase 1,NQO1]酶活性检测试剂盒:美国Sigma公司;小鼠黑色素瘤细胞B16、1640培养液、胎牛血清:杭州诺扬生物有限公司;胰蛋白酶、青霉素-链霉素溶液:上海生工生物有限公司。
1.2 仪器与设备
RE-200型旋转蒸发仪:上海亚荣生化仪器厂;高速冷冻离心机:美国Beckman公司;SCIENTZ-II D超声波细胞粉碎机:宁波新芝生物科技股份有限公司;Spectra Max酶标仪:美国Molecular Devices公司;高效液相色谱仪、7890A气质联用高效色谱仪:美国Agilent Technologies公司;WondaCractODS-2柱:日本岛津公司。
1.3 方法
1.3.1 ITC提取方式
根据Wu等[20]的方法,分别破碎并称取100 g萝卜、芥菜、榨菜、甘蓝、花菜、西兰花种子的粉末,加入700 mL石油醚,振荡摇匀2 h,过滤除去石油醚,滤渣用相同体积的石油醚继续脱脂2次。滤渣置于通风干燥橱中过夜,得到脱脂种子。
先提取后酶解方式(HFE)[19]:30 g脱脂种子加入15 mL 磷酸盐缓冲液(0.1 mol/L,pH7.0),振荡摇匀 2 h,再加入35 mL乙酸乙酯,振荡摇匀4 h,随后继续加入2 g氯化钠,充分混匀15 min后过滤,滤渣用乙酸乙酯再洗涤2次。在乙酸乙酯相中加入10.0 g无水硫酸钠并过滤,通过旋转蒸发(45℃)将滤液浓缩并加入5 mL甲醇用于残留物的溶解定容,储存于-20℃冰箱中。
同时酶解和提取方式(SHE)[19]:30 g脱脂种子同时加入15 mL磷酸盐缓冲液(0.1 mol/L,pH7.0)和35 mL乙酸乙酯,振荡摇匀4 h,后续步骤与HFE相同。
1.3.2 ITC含量测定
根据Liu等[21]的方法,运用环缩合法测定ITC含量。将200μL样品与300μL磷酸钾缓冲液(50mmol/L,pH8.5)和 400 μL 1,2-苯二硫醇(10 mmol/L)混匀,于65℃孵育2 h,随后冷却至25℃。将反应液于12 000×g离心10 min,取上清液过0.22 μm微滤膜并检测ITC含量。液相检测条件为流动相:甲醇和水分别为80%和 20%;流速:1.0 mL/min;进样量:10 μL;检测波长:365 nm。色谱柱为 4.6 mm×250 mm,5 μm WondaCract ODS-2柱。
1.3.3 气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析
各种子中ITC种类和含量按照吴元锋等[22]的方法测定,通过GC-MS进行检测。色谱柱为HP-5MS的UI毛细管柱(0.25 μm,30 m×0.25 mm)。1 μL 的上样量,300℃的气化室温度。柱升温程序为50℃(2 min),升温至190℃(10℃/min),再升温至300℃(20℃/min),保持5 min。超高纯氦气作为载气(分流比为10∶1)。质谱的接口温度为220℃,电离方式为电子离子化(electronic ionization,EI),电离能量为70 eV,质量范围为35 amu~500 amu[19]。内标物为环己酮。
1.3.4 提取液对B16细胞的抑制作用
提取液对小鼠B16细胞的抑制作用根据Chiang等[23]的方法,采用噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法检测。取对数生长期的B16细胞,用含EDTA的胰蛋白酶溶液进行消化,制备成单细胞悬液,接种于 96 孔板中,每孔 100 μL,2×104个细胞/孔,置于37℃和5% CO2的培养箱中培养。待细胞贴壁,加入含有纯SF或提取液的培养液,使纯SF和HFE组提取液最终浓度为30 μmol/L,每个浓度设置5个复孔;SHE组提取液与HFE组稀释倍数相同,仅含有培养液的作为空白组。随后将细胞置于培养箱中,培养24 h,条件为37℃并含有5% CO2。分别加入20 μL无菌MTT溶液(5 mg/mL),反应4 h。除去培养液,分别加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO)。反应10 min后在570 nm条件下检测其OD值,计算24 h后B16细胞的存活率。
1.3.5 提取液对B16细胞NQO1的影响
在24孔板中,分别加入1 mL(含有约2×105个B16细胞)细胞悬液并传代培养至细胞稳定后加入含有纯SF或提取液的培养液(浓度为5 μmol/L),培养24 h。用无菌磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗去除培养液的B16细胞3次,随后进行胰蛋白酶消化。1 000×g离心细胞悬液5 min后去除上清液,在沉淀中加入细胞裂解液、1 mol/L二硫苏糖醇(dithiothreitol,DTT)和蛋白酶抑制剂(体积比为200∶1∶2),冰上裂解 30 min,每隔 10 min 用旋涡混匀器混匀,重复3次,再于12 000×g下离心30 min,取上清液,分装于-80℃保存备用[19]。
根据Liu等[21]的方法对NQO1活性进行测定。工作液:25 mmol/L Tris-HCl缓冲液、0.67 mg/mL牛血清白蛋白(bovine albumin,BSA)、0.72 mmol/L MTT、0.01%(体积分数)吐温-20和0.03mmol/L烟酰胺腺嘌呤二核苷酸磷酸(oxidized form of nicotinamide adenine dinucleotide phosphate,NADP+)(体积比为 827∶13∶133∶7∶20);混合液:50 μmol/L甲萘醌、2 U/mL葡萄糖-6-磷酸脱氢酶和工作液(体积比为 1∶20∶1 000);现用现配,避光。按体积比1∶4混匀样品溶液与混合液,每隔1 min检测OD610,检测7 min后加入25 μL浓度为0.3 mmol/L的双香豆素以停止反应,每隔1 min检测610 nm处的吸光度(OD610),检测7 min。MTT的还原量通过斜率计算。通过蛋白质检测试剂盒测定蛋白质含量,以BSA为标准蛋白质。NQO1活性以还原MTT的量表示,单位为nmol/(min·mg)。
1.4 数据统计分析
每项试验进行3次以上,试验结果以平均值±标准差来表示,数据用SPSS 22.0进行单因素方差分析。统计学显著性为P<0.05。
2 结果与分析
2.1 提取方式对ITC含量的影响
通过环缩合法测定了SHE和HFE对ITC含量的影响,结果如表1所示。

表1 两种提取方式对不同种子中ITC含量的影响Table 1 Effects of two extraction methods on ITC content in different seeds
由表1可知,采用SHE提取时,萝卜种子的ITC含量最高,其次是西兰花、甘蓝和花菜种子,芥菜和榨菜种子的ITC含量较低。提取方式对萝卜种子和西兰花种子中ITC含量有显著影响(P<0.05),SHE组比HFE组分别提高了2.98倍和0.40倍。而对于芥菜、榨菜、甘蓝和花菜种子,SHE组ITC含量略高于HFE组,但是无显著差异(P>0.05)。
2.2 提取方式对ITC种类和含量的影响
通过GC-MS分析了不同种子提取液中ITC的种类和含量,结果如表2所示。
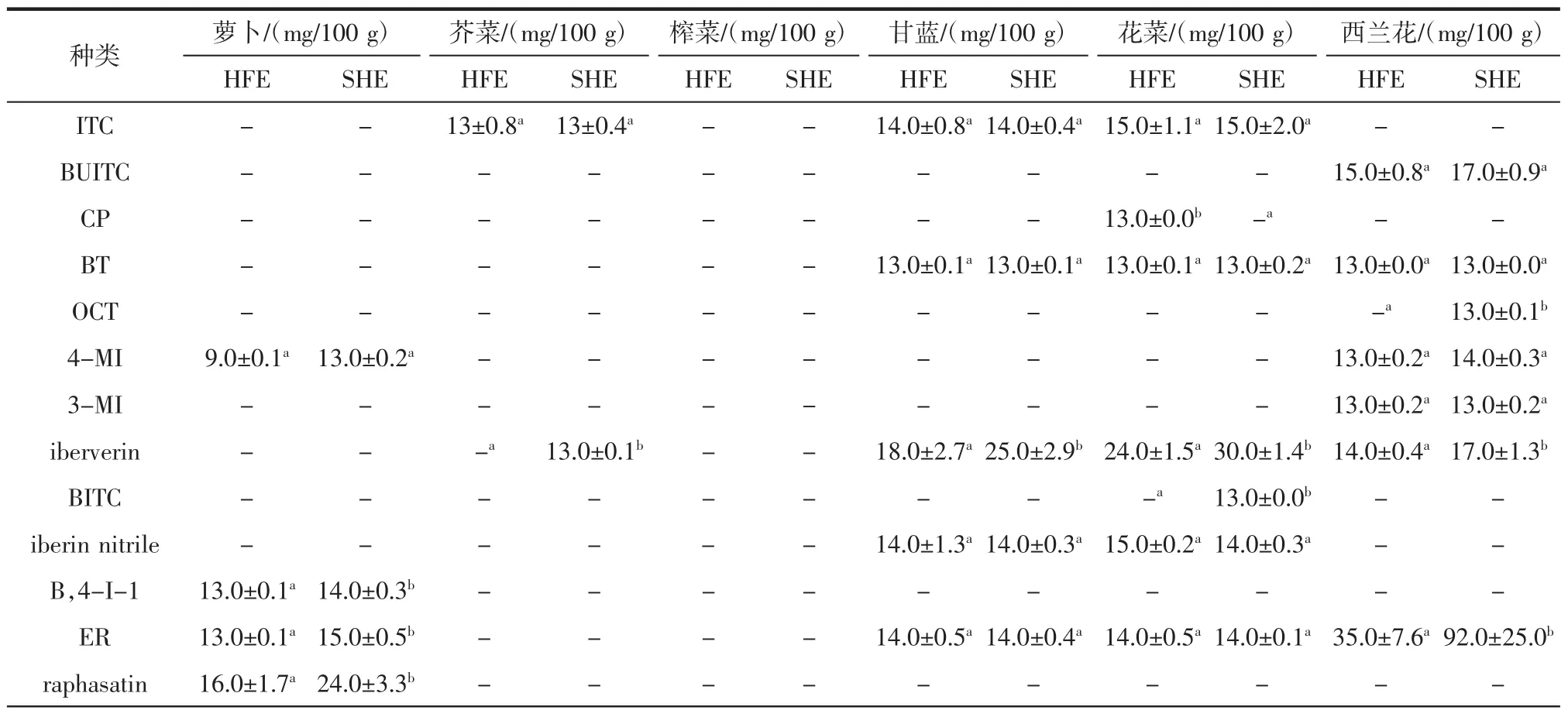
表2 两种提取方式对不同种子中ITC的种类和含量Table 2 Effects of two extraction methods on the kinds and content of ITC in different seeds
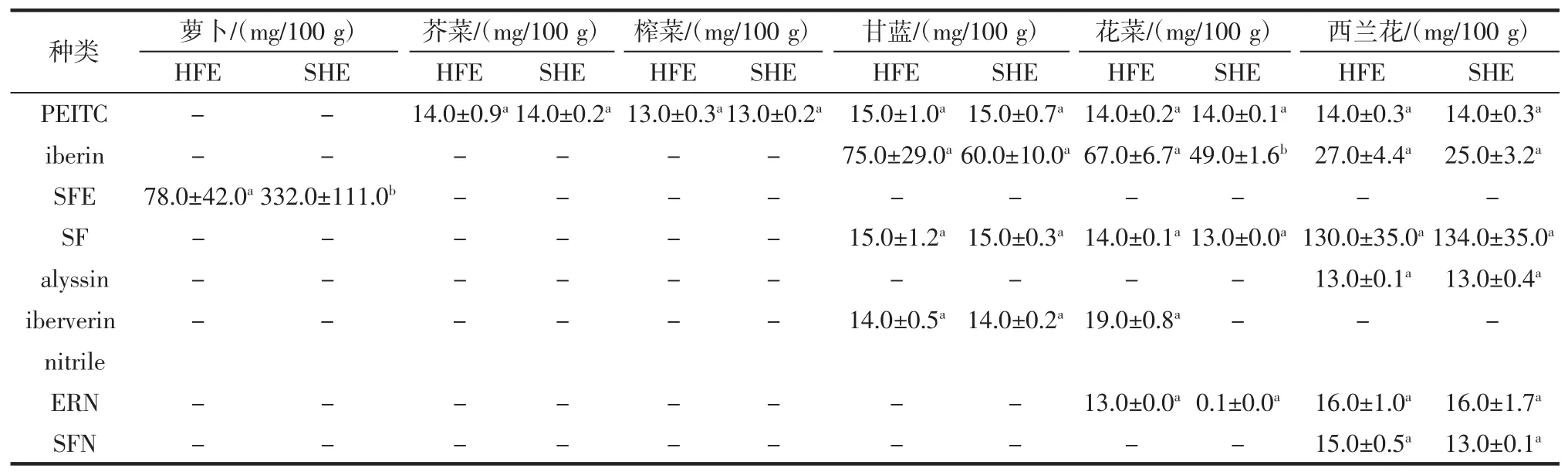
续表2 两种提取方式对不同种子中ITC的种类和含量Continue table 2 Effects of two extraction methods on the kinds and content of ITC in different seeds
在不同种子中,西兰花种子中ITC的种类最丰富,共13种。其次为花菜、甘蓝、萝卜、芥菜和榨菜种子。作为一种抗癌活性较高的活性物,SF的含量和提取方式一直受到人们的关注。SF在西兰花种子中的含量最高,采用SHE时可达(134±35)mg/100 g。花菜和甘蓝种子中也含有SF,但西兰花种子中SF的含量显著高于这些种子。从表2可看出,alyssin和raphasatin分别只存在于西兰花和萝卜种子中。ER、iberverin和iberin在甘蓝、花菜和西兰花种子中均存在,但这3种ITC在不同蔬菜种子中含量有差异。甘蓝和花菜种子中iberverin和iberin的含量均高于西兰花,其中采用SHE时,甘蓝和花菜种子中iberverin的含量分别是西兰花种子的1.47倍和1.76倍。除萝卜种子外,PEITC存在于其他各种所测蔬菜种子中,但是含量均不高。
与HFE相比,SHE使萝卜种子中SFE含量提高了3.26倍并使西兰花种子中ER含量增加了1.63倍。采用SHE时,萝卜种子中的ER、raphasatin、B,4-I-1和SFE,以及芥菜、甘蓝、花菜和西兰花种子中的iberverin含量有显著提高(P<0.05)。但SHE对BUITC、BT、3-MI、iberin nitrile、PEITC、alyssin 和 ERN 的影响较小。在西兰花种子中,ER可以在双氧水作用下转化为其结构类似物SF[24],SF也可以被肠道微生物或酶类代谢为ER[25-26]。但有机溶剂对黑介子酶的影响尚未研究,也没有关于SF被有机溶剂催化为ER的报道。试验表明西兰花中SF含量不受SHE和HFE影响。因此,采用SHE可以提高ER含量的原因还需进一步探究。除ITC外,研究分析了各种腈类物质,如iberin nitrile、iberverin nitrile、ERN、SFN 等,但含量均较低。与ITC不同,腈类物质没有生物学活性[27]。腈类物质含量不受SHE和HFE影响(P>0.05),这说明ESP活性不受有机溶剂影响。
2.3 不同种子提取液对B16细胞活性的影响
萝卜、甘蓝、花菜和西兰花种子提取液对B16细胞活性的影响如图2所示,通过SHE和HFE获得的种子提取液稀释至其ITC浓度等于SF标准品浓度。由于芥菜和榨菜种子提取液中ITC含量较低,未进行分析比较。
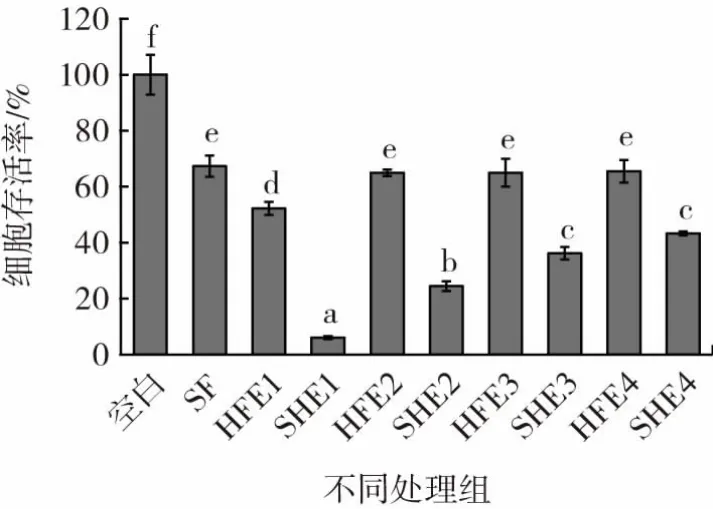
图2 不同提取方式和种子提取液对B16细胞存活率的影响Fig.2 Effects of different extraction methods and seed extracts on the survival rate of B16 cells
由图2可以看出,SHE组种子提取液细胞抑制率均显著高于HFE组(P<0.05),特别是萝卜种子,这与表1中SHE组ITC含量较高的结果一致。作为阳性对照,30 μmol/L的SF标准品可以使B16细胞的存活率降低至67%,说明SF对B16细胞有很强的抑制作用,与文献[28]研究结果一致。采用HFE获得的萝卜种子提取液对B16细胞的抑制作用不同于阳性对照(P<0.05),而其他种子提取液对B16细胞的影响与阳性对照相似(P>0.05)。
2.4 不同种子提取液对B16细胞NQO1活性影响
NQO1是一种黄素蛋白酶,它以NADP(H)为受体,催化醌类及其衍生物失去两个电子,从而保护细胞免受醌类物质代谢过程中产生的活性氧及亲电物质的损伤[29]。因此,检测NQO1活性,是评价提取液抗氧化活性的重要手段,。不同提取方式和种子提取液对B16细胞NQO1活性的影响见图3。
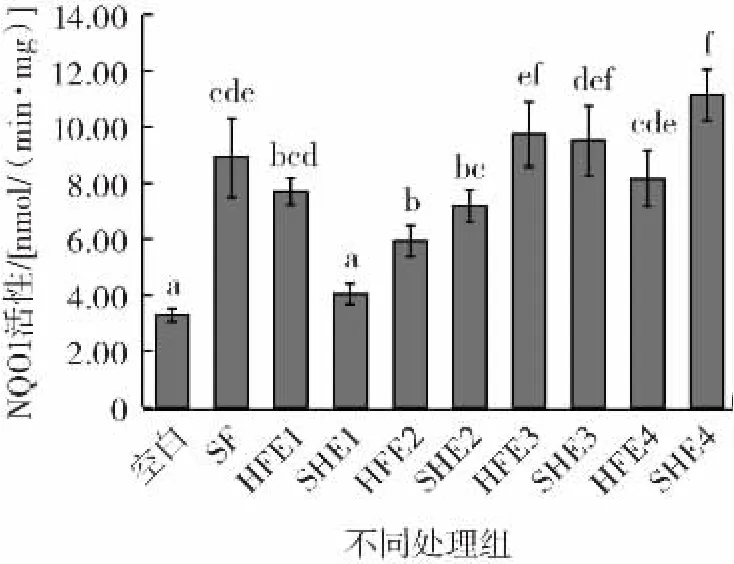
图3 不同提取方式和种子提取液对B16细胞NQO1活性的影响Fig.3 Effects of different extraction methods and seed extracts on the NQO1 activity of B16 cells
由图3可知,各种子提取液对B16细胞的NQO1活性有不同的影响。HFE组的西兰花种子提取液对NQO1诱导活性与纯SF无显著差异(P>0.05),而SHE组则显著高于SF(P<0.05),这是由于SHE组产生了更多的ER,从而提高了总ITC的含量。两组花菜种子提取液对NQO1的诱导活性均高于纯SF,而甘蓝种子提取液诱导活性则低于纯SF。SHE组甘蓝种子提取液对NQO1活性诱导作用高于HFE组提取液,但是无显著差异(P>0.05)。HFE组萝卜种子提取液诱导作用低于纯SF,但是无显著差异(P>0.05),但是SHE组萝卜种子提取液的诱导作用则显著低于HFE组(P<0.05),这有可能是因为SHE组中ITC的含量过高导致细胞大量死亡,从而导致酶活性反而下降。
3 结论
不同提取方式对十字花科蔬菜中ITC种类和含量有不同的影响。SHE提取的ITC含量要高于HFE,特别是萝卜和西兰花种子,分别提高了2.98倍和0.40倍。与HFE相比,SHE使萝卜种子中SFE含量提高了3.26倍并使西兰花种子中ER含量增加了1.63倍。对于萝卜、甘蓝、花菜和西兰花种子,SHE提取液对B16细胞的抑制率高于HFE提取液。SHE组西兰花种子提取液的NQO1诱导活性高于HFE组,但萝卜种子的诱导活性却相反。
本研究为从蔬菜中获得高含量和高活性的ITC奠定基础,也为蔬菜中天然活性成分的分析提供依据。
