植物乳杆菌P9对头孢曲松钠作用小鼠肠道菌群的影响
2022-05-01陈苗苗李可文熊雪梅吴梦琦刘小溪郑秋生
陈苗苗,李可文,熊雪梅,吴梦琦,刘小溪,郑秋生*
(1.石河子大学药学院,新疆 石河子 832000;2.东北农业大学生命科学学院,黑龙江 哈尔滨 150030;3.北京联合大学生物化学工程学院,北京 100023)
肠道菌群是寄居在人或动物肠道内的正常微生物,这些微生物种类繁多且数量庞大,不同菌种之间相互制约又相互依存,形成了一种动态平衡。随着人类微生物组项目以及肠道宏基因组学的发展,肠道菌群被认为是一种新的多细胞“器官”,是维持宿主各种生命活动平衡的重要因素[1],具有参与营养和代谢、抗菌保护、维持肠道黏膜的完整性、调节免疫反应等功能[2]。肠道菌群可以激活肠道免疫系统,在肠道屏障功能中发挥重要作用,同时还可以利用多种天然多糖,将其转化为有益的代谢物,维持肠道微生态系统的平衡[3]。然而,当宿主或外界环境发生变化,尤其是滥用抗生素时,会导致肠道菌群失调[4],使肠道内益生菌的丰度降低,干扰有益代谢物的转化。研究发现,肠道菌群失调与消化系统、代谢系统、中枢神经系统、内分泌系统等一系列疾病有着密切的相关性[5],因此对肠道菌群失调的调节可能降低这些系统疾病的发生率,对维持机体健康有着重要意义。
益生菌是一种食用后对宿主健康有益的活性微生物,能够通过改变微生物群的组成或活性的方式产生促进健康作用[6]。植物乳杆菌(Lactobacillus plantarum,L.plantarum)是广泛分布于各种生态环境中的一种益生菌,它具有高度的耐酸性,在发酵后期占据主要地位,被广泛应用于食品和健康行业[7]。研究发现L.plantarum的基因组可以根据生态位的需要,获取、组装、替换或删除利用碳水化合物的基因盒,因此又被称为“天然代谢工程师”[8],具有预防和治疗炎症性肠病、冠心病、肠易激综合征,以及调节粪便菌群组成等功能[9-10]。植物乳杆菌P9是由Li等[11]从自然发酵酸粥中分离出来的一株菌株,研究显示它具有降解有机磷农药的作用,而且其在胃肠液和胆汁中有很强的耐受性,因此可能对肠道菌群具有调节作用。
抗生素是一类由生物、微生物在生命活动过程中产生的具有抗病原体、干扰细胞生长发育的化学物质,但在使用过程中容易产生抗生素滥用,从而导致菌群失调、二重感染、超级细菌产生等危害机体健康的情况。在肠道中,抗生素通过改变细菌代谢产物和肠道微环境,从而影响肠道固有免疫功能,降低宿主肠道菌群的定植能力[12],导致肠道菌群失调。目前选用头孢曲松钠建立菌群失调模型的方法被大多数研究所采用[3],本研究主要通过灌胃头孢曲松钠的方式建立小鼠肠道菌群失调模型,探究L.plantarum P9对小鼠肠道菌群的影响,为益生菌制剂的研制与开发提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
60只健康雄性balb/c小鼠(4周龄,体重18g~20g):北京华阜康生物科技股份有限公司,许可证号为SYXK(京)2017-0038。所有动物饲养于北京联合大学应用文理学院SPF级动物实验中心,给予每天12 h光照/黑暗交替条件,室内温度为(20±2)℃,相对湿度为45%~60%。本次动物研究实验设计及实验方案通过了北京联合大学伦理委员会审核和批准,伦理委员会意见书编号:20210601。
1.1.2 试剂
植物乳杆菌P9菌粉(活菌数≥2.0×1011CFU/g):北京鸿测科技开发股份有限公司;头孢曲松钠(纯度≥98%):上海阿拉丁公司;白介素-1β(interleukin-1β,IL-1β)试剂盒、白介素-2(interleukin-2,IL-2)试剂盒、白介素-6(interleukin-6,IL-6)试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒:武汉华美公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒:南京建成生物工程研究所;伊红美蓝琼脂培养基、叠氮钠-结晶紫-七叶苷琼脂培养基、双歧杆菌选择性琼脂培养基、乳酸杆菌选择性琼脂培养基:北京陆桥生物技术有限责任公司;胶回收试剂盒(qiagen aquick gel extraction kit):德国凯杰生物技术有限公司;DNA纯化试剂盒(gene JETTM gel extraction kit):日本赛默飞世尔科技公司;DNA 建库试剂盒(TruSeq DNA PCR-Free):美国因美纳公司;无水乙醇、二甲苯、中性树胶:国药集团化学试剂有限公司;苏木精-伊红(hematoxylin-eosin,HE)染色液套装:武汉赛维尔生物科技有限公司。
1.2 仪器设备
TECAN酶标仪(Inifinite M NANO):广州深华公司;低温超速离心机(Centrifuge 5702 RH):德国艾本德有限公司;实验室超纯水机(Mili-Q EQ 7000):美国密理博公司;紫外可见分光光度计(UV-4802):尤尼柯仪器有限公司;电子分析天平(CPA225D):德国赛多利斯公司;漩涡振荡仪(Hula Dancer basic):德国艾卡公司。
1.3 实验方法
1.3.1 动物分组及给药
60只小鼠在SPF级动物实验室适应性喂养一周,温度为18℃~22℃,湿度为45%~60%,自由饮食和饮水。1周后,随机取48只小鼠,每只小鼠灌胃0.2 mL头孢曲松钠(200 mg/mL),1次/d,连续 5 d,建立小鼠肠道菌群失调模型。然后将这48只小鼠随机分为4组,每组12只,分别为模型组和低、中、高3个剂量组,L.plantarum P9配方推荐剂量为2×109CFU/60 kg,本实验采用等效换算的方法,分别以人体推荐剂量的5倍、10倍、30倍为3个剂量组,即低剂量组(L.plantarum P9 1×108CFU/kg)、中剂量组(L.plantarum P9 2×108CFU/kg)、高剂量组(L.plantarum P9 6×108CFU/kg)灌胃给药,对照组和模型组灌胃生理盐水,连续23 d。每天同一时间测小鼠体重,并记录小鼠的状态、摄食情况等。
1.3.2 样品采集
L.plantarum P9灌胃23 d后,采集小鼠无菌粪便用于活菌计数和16S rDNA测序。小鼠摘眼球取血,置于1.5 mL离心管中,4℃静置15 min,4 000 r/min离心15 min,吸取上清液,分装后于-80℃储存备用。将小鼠麻醉后断颈处死,解剖出心脏、肝脏、脾脏、肺脏、肾脏、胸腺用离心管分装好,置于冰中备用。小肠用生理盐水冲洗,进行称重并测量小肠长度,将空肠放入组织固定液中,按顺序编号,留作病理切片。
1.3.3 脏器系数测定
将解剖出的各组小鼠的心脏、肝脏、脾脏、肺脏、肾脏、胸腺分别进行称重,按以下公式计算脏器系数。
脏器系数/%=小鼠脏器质量(g)/小鼠体质量(g)×100
1.3.4 血清炎症因子测定
采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)分别测定小鼠血清中白细胞介素1β(IL-1β)、白细胞介素 2(IL-2)、白细胞介素 6(IL-6)等炎症因子的含量,以及肿瘤坏死因子(TNF-α)的水平,操作步骤依据相应试剂盒说明书进行。
1.3.5 肝脏及肠道抗氧化指标测定
取每只小鼠相同位置的肝脏和小肠组织,以1∶9的质量比加入生理盐水,冰浴下匀浆,再于4℃、4000r/min离心15min后取上清液,分装后放置于-80℃冻存,用于抗氧化指标测定。抗氧化指标包括T-SOD、MDA、GSH以及GSH-Px。测定方法按照相应的试剂盒说明书进行。
1.3.6 小肠病理切片形态学观察
将选取的空肠组织用石蜡包埋,用切片机切片。石蜡切片依次用二甲苯、无水乙醇、85%和75%酒精脱蜡至水。先后用苏木素和伊红染色,再将切片脱水处理,用中性树胶封片。于显微镜下观察,进行图像采集分析。结果图像中细胞核呈现蓝色,细胞质呈现红色。
1.3.7 肠道典型微生物含量测定
用抗生素造成小鼠肠道菌群失调模型,分别采集小鼠给予受试物(L.plantarum P9菌粉)前以及最后一次给予受试物后的无菌新鲜粪便,对粪便中的肠球菌、肠杆菌、双歧杆菌、乳杆菌和产气荚膜梭菌进行计数。粪便样品用稀释液稀释至合适浓度,分别接种于相应选择培养基中,于(36±1)℃下培养。肠球菌在叠氮钠-结晶紫-七叶苷琼脂培养基中培养48 h,肠杆菌在伊红美蓝琼脂培养基中培养24 h,双歧杆菌在双歧杆菌选择性培养基中厌氧培养48 h,乳杆菌用乳杆菌选择性培养基培养48 h,产气荚膜梭菌用产气荚膜梭菌选择性培养基厌氧培养24 h。计算出每克粪便中的菌落数(cfu/g),再取对数进行计算。
1.3.8 肠道菌群结构16s rDNA高通量测序
灌胃结束后,收集各组小鼠的无菌新鲜粪便,采用十六烷基三甲基溴化铵/十二烷基磺酸钠(cetyltrimethylammonium bromide/sodium dodecyl sulfate,CTAB/SDS)法提取样本中微生物DNA,检测浓度及纯度后,用无菌水将DNA稀释成1 ng/μL,使用特异性引物 515F(5'-CCTAYGGGRBGCASCAG-3')和806R(3'-GGACTACNNGGGTATCTAAT-5') 对细菌16S rRNA的V3~V4区进行PCR扩增,产物用2%琼脂凝胶进行电泳检测,再用Qiagen试剂盒纯化。使用TruSeq ®DNApcr无样品制备试剂盒生成测序文库,用Qubit@2.0荧光计和安捷伦生物分析仪2100系统评估文库质量,在Illumina NovaSeq平台上对文库进行双末端测序。测序原始数据经拼接、过滤后得到有效数据,在有效数据的基础上进行OTUs(operational taxonomic units)聚类和物种注释及丰度分析,再经T检验得到样本间群落结构差异特征。
1.4 数据分析处理
测量所得的各种数据采用SPSS 19.0软件进行统计分析。小鼠细胞炎症因子、抗氧化指标、脏器系数均采用平均值±标准差的形式表示,除肠道菌群计数采用独立样本T检验分析组间差异,其余数据均采用单因素方差分析LSD法分析组间差异,当P<0.05时则认为数据有显著性差异。
2 结果与分析
2.1 植物乳杆菌P9对小鼠体质量和摄食量的影响
各组小鼠的体质量和摄食量随时间的变化如图1所示。

图1 植物乳杆菌P9对小鼠体质重及摄食量的影响(n=12)Fig.1 Effect of L.plantarum P9 on body weight and food intake level of mice(n=12)
由图1可知,体质量曲线和摄食量曲线都呈缓慢上升的趋势,但各组之间差别不明显。一方面,由于小鼠处于身体发育阶段,随着周龄的增长,体质量和摄食量都有所增长;另一方面,说明本实验所灌胃的头孢曲松钠和L.plantarum P9菌粉对小鼠的体质量和摄食量无明显影响。
2.2 植物乳杆菌P9对小鼠脏器系数的影响
脏器系数是反映药物对动物机体各器官作用的参数,其变化可提示脏器的形态病理学改变,脏器系数降低提示可能有萎缩或退行性病变,脏器系数升高则可能有水肿、增生或充血[13]。本次实验中,各组小鼠的脏器系数如表1所示。
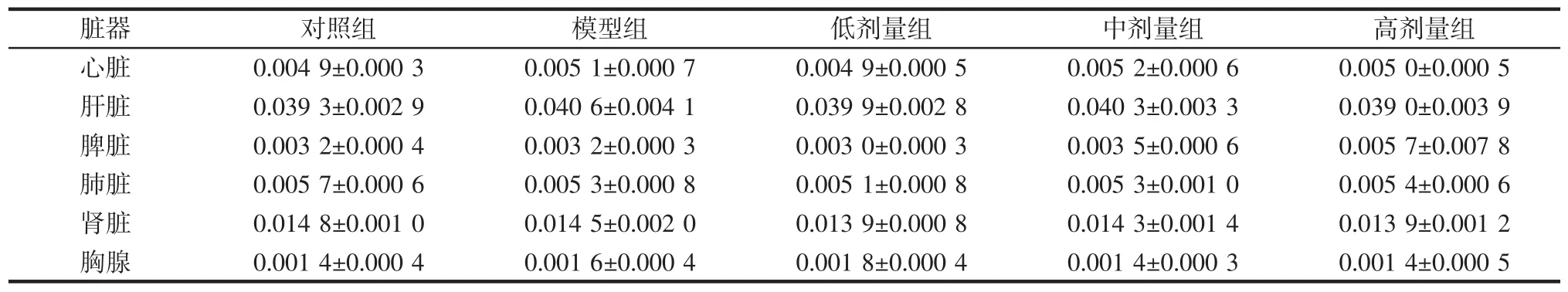
表1 植物乳杆菌P9对小鼠各脏器系数的影响(n=12)Table 1 Effect of L.plantarum P9 on organ coefficient in mice(n=12)%
由表1可知,无论是模型组与对照组,还是低剂量组、中剂量组、高剂量组与模型组相比较,小鼠的心脏、肝脏、脾脏、肺脏、肾脏、胸腺的脏器系数均无明显差异,说明头孢曲松钠和L.plantarum P9灌胃对小鼠的脏器无明显影响。吴思谋等[14]的研究中通过高脂饮食和灌胃头孢曲松的方式能检测到小鼠脏器系数的明显差异,而本实验中脏器系数无显著差异,说明小鼠脏器系数可能与饮食因素、抗生素灌胃剂量和灌胃持续时间有关系。
2.3 植物乳杆菌P9对小肠长度和质量的影响
各组小鼠小肠的长度和质量如图2所示。
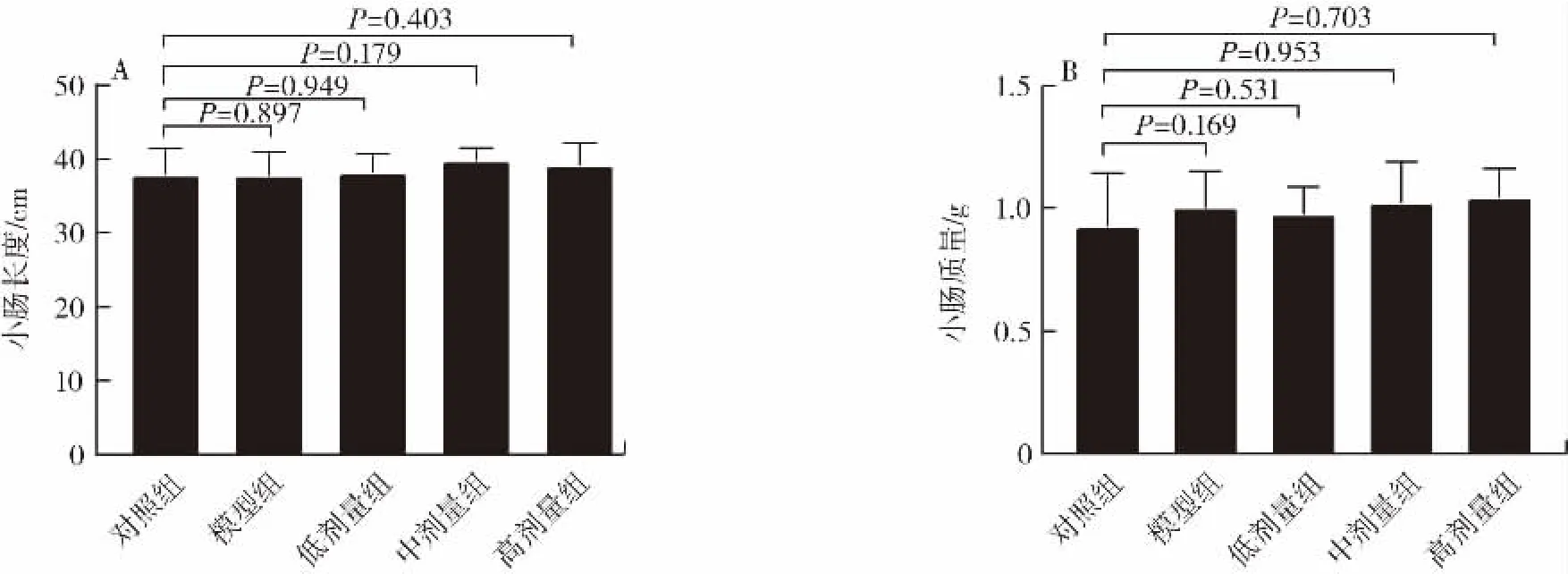
图2 植物乳杆菌P9对小鼠小肠长度和质量的影响(n=12)Fig.2 Effect of L.plantarum P9 on length and weight of intestine in mice(n=12)
由图2可知,小肠长度无显著差异,3个剂量组和模型组的小肠质量比对照组稍有提高,但无显著差异(P>0.05),说明头孢曲松钠和L.plantarum P9未对小鼠的小肠造成器质性改变。
2.4 植物乳杆菌P9对小鼠血清中炎症因子的影响
炎症是机体受到外界刺激时的一种防御反应[15],IL-1β、IL-2、IL-6、TNF-α 是机体常见的炎症因子。IL-1β由活化巨噬细胞产生;IL-2由T辅助细胞产生,又称T细胞生长因子;IL-6是由多种淋巴细胞或非淋巴细胞产生;TNF-α是由单核-巨噬细胞产生,这4种均为促炎细胞因子[16],其水平的高低对反应机体的炎症有重要价值。肠道菌群的失调则通常会促进全身炎症反应,导致多种疾病发生[17],所以本次实验中测定了各组小鼠这4种炎症因子含量变化,结果见表2。

表2 小鼠血清中炎症因子水平Table 2 The level of inflammatory factor in mice serum
由表2可知,与对照组相比,模型组的IL-1β、IL-2、IL-6及 TNF-α 含量极显著升高(P<0.01);与模型组相比,低、中、高 3 个剂量组的 IL-2、IL-6、TNF-α 含量极显著降低(P<0.01),中剂量组和高剂量组的IL-1β含量极显著降低(P<0.01),说明灌胃头孢曲松钠导致小鼠机体产生明显的炎症反应,而L.plantarum P9可以减轻小鼠由头孢曲松钠造成的炎症反应,中剂量组和高剂量组效果更为明显。
2.5 植物乳杆菌P9对小鼠肝脏及小肠抗氧化指标的影响
机体的抗氧化系统是一个复杂而完善的整体[18],当小鼠肠道菌群失调时,会破坏这个整体的平衡性。SOD是一种广泛存在于生物机体的抗氧化金属酶,能够催化超氧阴离子歧化生成过氧化氢和氧,其活力值越高代表抗氧化的能力越强[19]。MDA是氧自由基攻击生物膜后形成的脂质氧化代谢物,其含量反映了体内脂质的过氧化程度[20],含量越高提示机体的抗氧化能力越弱。GSH是体内重要的还原剂,参与多种生物氧化过程,对蛋白质合成、DNA修复、细胞膜转运以及细胞增殖、分化、凋亡等多种生物过程具有重要意义[21],低水平的GSH还会导致氧化应激,进而影响免疫系统的功能。GSH-Px是一种过氧化物分解酶,其作用是消除机体产生的过氧化氢和有机氢过氧化物,降低活性氧对机体的破坏[22],此外它还参与细胞信号转导、前列腺素合成的调节、蛋白质相互作用等过程。本实验中测定的各组小鼠肝脏和肠道组织MDA、GSH含量和T-SOD、GSH-Px活性如表3。
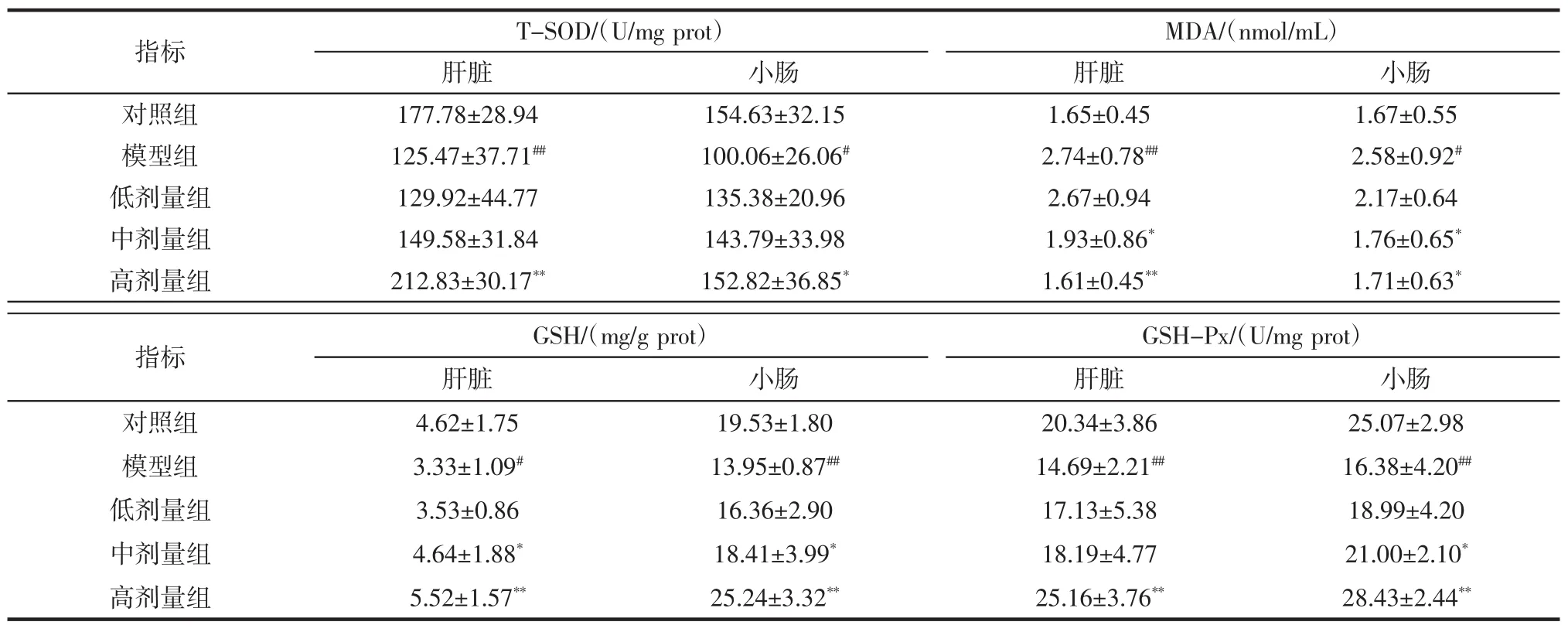
表3 植物乳杆菌P9对小鼠肝脏和小肠抗氧化指标的影响Table 3 Effect of L.plantarum P9 on antioxidant index in mice's liver and intestine
由表3可知,与对照组相比,模型组小鼠肝脏GSH 含量显著降低(P<0.05),而 T-SOD、GSH-Px活性极显著下降(P<0.01),MDA含量极显著上升(P<0.01)。随着L.plantarum P9灌胃剂量的增加,小鼠肝脏中各抗氧化物质水平有所恢复,与模型组相比,高剂量组的GSH含量和T-SOD、GSH-Px活性极极显著上升(P<0.01),MDA含量极显著下降(P<0.01)。模型组肠道GSH含量和GSH-Px活性相对于对照组极显著降低(P<0.01),MDA 含量显著上升(P<0.05),T-SOD 活性显著下降(P<0.05)。与模型组相比,中剂量组和高剂量组小鼠肠道MDA含量显著下降(P<0.05),高剂量组GSH-Px活性极显著升高(P<0.01),T-SOD活性显著升高(P<0.05),GSH 含量极显著升高(P<0.01)。由此可见,灌胃头孢曲松钠后小鼠肝脏和小肠的抗氧化能力呈现不同程度的下降趋势,而L.plantarum P9能使抗氧化指标恢复至对照组水平,说明L.plantarum P9对头孢曲松钠小鼠的肝脏和小肠的氧化应激水平有着调控作用。
2.6 植物乳杆菌P9对小鼠小肠形态的影响
各组小鼠的小肠空肠段病理切片经HE染色后,结果如图3所示。

图3 小鼠小肠切片形态观察(200×)Fig.3 Morphological observation of intestine section of mice(200×)
由图3可知,各组小鼠小肠的绒毛结构完整、边缘整齐、数量丰富,绒毛长度和隐窝厚度都没有明显差异,未见绒毛肿胀或绒毛脱落。黏膜上皮内有排列整齐的单层柱状细胞,固有层肠腺数量丰富,中央乳糜管结构清晰可见,肌纤维形态正常、排列规则,未见明显炎症。说明抗生素和L.plantarum P9均未对小鼠小肠形态造成明显改变。
2.7 植物乳杆菌P9对小鼠典型肠道微生物含量的影响
肠球菌、肠杆菌、双歧杆菌、乳酸杆菌和产气荚膜梭菌都是人类和动物肠道的正常菌群,其数量一般处于相对稳定状态。本实验探究了L.plantarum P9对头孢曲松钠小鼠肠道中这5中常见菌群的具体影响,结果见图4。

图4 植物乳杆菌P9对小鼠肠道菌群计数的影响Fig.4 Effect of L.plantarum P9 on intestinal flora count in mice
如图4所示,在给予抗生素后,小鼠粪便中的肠球菌、肠杆菌、双歧杆菌、乳杆菌数量比对照组极显著减少(P<0.001),产气荚膜菌含量无明显变化。抗生素造损停止后,模型组各类微生物含量有所恢复,其中肠杆菌含量与同期对照组相比极显著升高(P<0.001),乳杆菌含量有所下降,肠球菌和双歧杆菌无明显差异。各剂量组与灌胃L.plantarum P9之前比,肠球菌、肠杆菌、双歧杆菌、乳杆菌含量均有所恢复,与同时期模型组相比,肠球菌、肠杆菌含量有所降低,中高剂量组双歧杆菌、乳杆菌含量明显升高。
在给予L.plantarum P9前,模型组和低、中、高剂量组的上述种类微生物,除产气荚膜菌外,都明显下降,模型成立。产气荚膜菌是一种广泛分布于环境、动物及人体胃肠道的厌氧致病菌,其芽孢具有极强的抗逆性,不易杀死[23],本研究显示,抗生素和益生菌均无法影响产气荚膜菌在肠道的数量。双歧杆菌和乳杆菌都是肠道中的有益细菌,此实验中抗生素能使它们的数量下降,而L.plantarumP9能使它们含量有所上升。模型组与对照组相比肠球菌、肠杆菌含量上升,而在3个剂量组中它们的含量均减少,这2种细菌都具有抗生素耐药性,其中肠球菌对多种抗生素表现为固有耐药机制,而且具有获得新抗菌耐药机制的能力[24];肠杆菌对头孢菌素类、头霉素类、加酶抑制剂类抗生素表现为耐药[25],说明抗生素造模可能提高了耐药细菌的含量,而L.plantarum P9可使耐药菌含量降低。
2.8 干预对小鼠肠道微生物多样性的影响
利用16s rDNA高通量测序可以从整体水平检测出肠道菌群的变化。
2.8.1 基于OTUs聚类的Venn分析
实验采集了5组小鼠共30个样本进行16S rDNA高通量测序。经过对短读序列拼接,平均每个样品测得85 151条标签,质控有效数据量为64 800。以97%的一致性将序列聚类成OTUs,共得到3 394个OTUs。将所有样本均一化处理后绘制Venn图,当样本组数大于5时则展示为花瓣图,见图5。
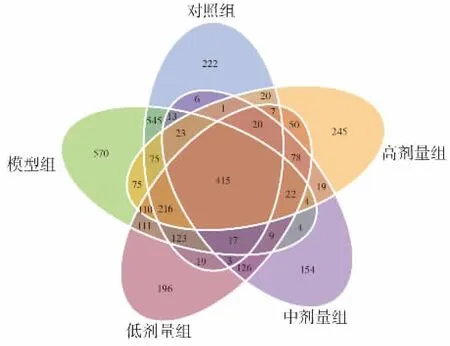
图5 基于OTUs聚类的Venn图Fig.5 The Venn diagram based on OTUs cluster analysis
如图5所示,对照组、模型组、低剂量组、中剂量组、高剂量组OTUs数目分别为1 730、2 332、1 529、858、1 442,模型组与其他各组相比OTUs数量有所增加,但与对照组相比模型组特有的OTUs数目为859,3个剂量组特有的 OTUs数目为 680、373、599。
2.8.2 Alpha物种多样性分析
Alpha物种多样性结果见图6。
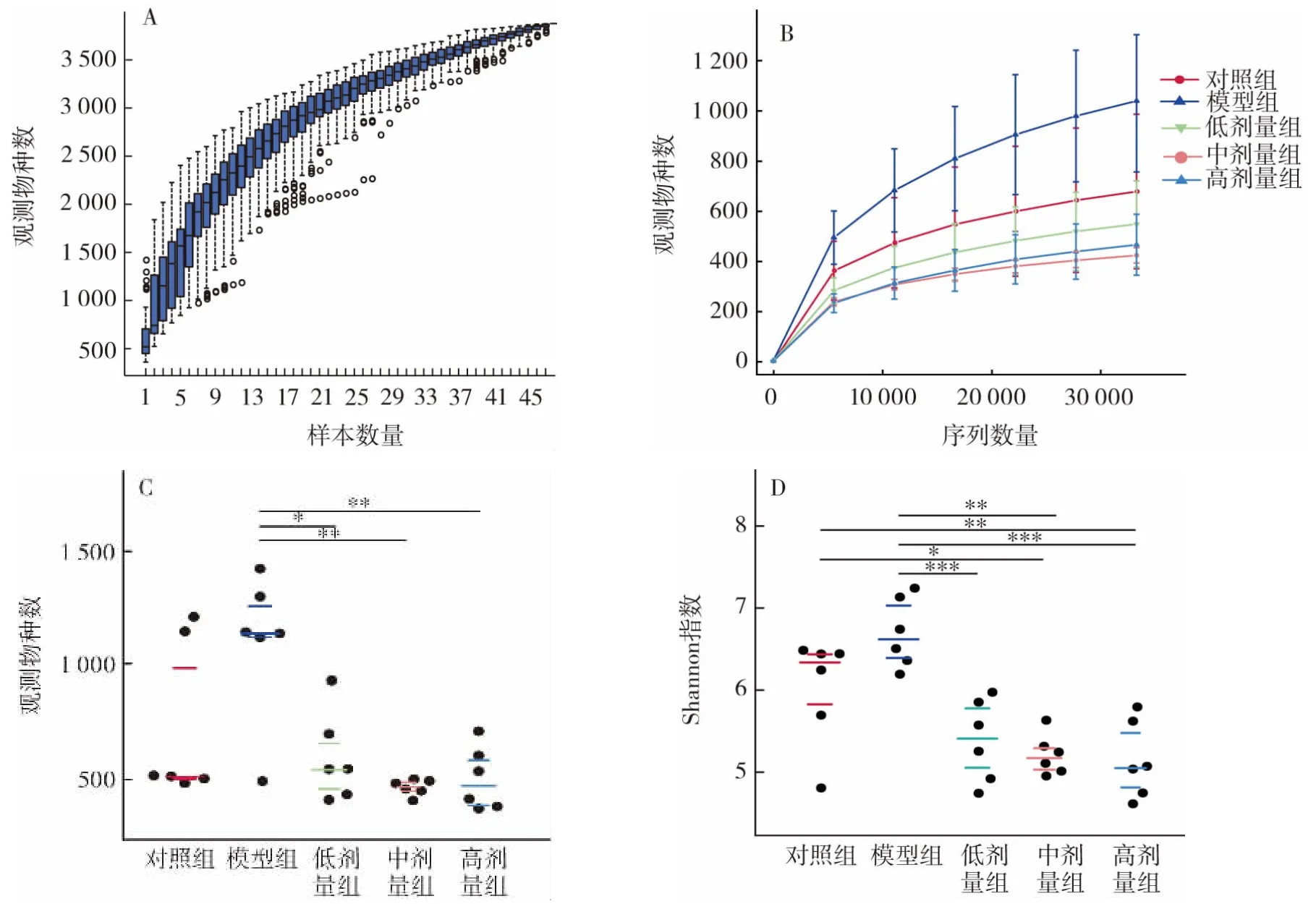
图6 Alpha物种多样性分析Fig.6 Alpha species diversity analysis
由物种累积箱形图可见(图6A)随着样本量的增加,可观察到的物种数目增加,即物种多样性增加,且图形位置趋于平缓,表明环境中的物种不会随样本量增加而急剧增加,样本量充分,可以进行数据分析。物种多样性曲线(图6B)反映了各组样本中的物种数量,可见头孢曲松钠诱导小鼠肠道菌群失调时,物种数目显著增加,而L.plantarum P9灌胃可以降低小鼠肠道物种数量。通过Wilcoxon秩和检验(图6C)可以发现,测得的物种数在模型组与高剂量组、中剂量组、低剂量组间均具有显著性差异(P<0.05),而在对照组与模型组、中剂量组、高剂量组间均无显著性差异(P>0.05)。Shannon指数反映了不同组间样本均一性的差别,当同一组中各样本OTUs序列数均一性越大时,Shannon指数越大,由图6D可见与模型组相比低剂量组、中剂量组、高剂量组的Shannon指数都具有显著性差异(P<0.05),与对照组相比模型组和低剂量组无显著差异(P>0.05),而对照组与中剂量组、对照组与高剂量组组间有显著性差异(P<0.05),低剂量组、中剂量组、高剂量组3组互相无显著差异,说明L.plantarum P9使样本均一性发生了改变。
2.8.3 多样品比较分析
多样品比较分析(beta diversity)是对不同样品中的微生物群落进行比较分析,采用Qiime软件计算unifrac距离,进行降维分析,主坐标分析法(principal co-ordinates analysis,PCoA)提取主要元素和结构,选取贡献率最大的组合作图,结果如图7所示。
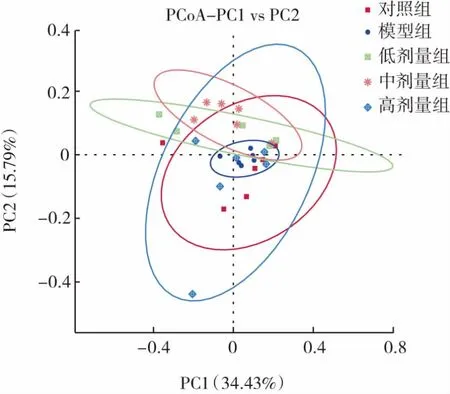
图7 基于weighted unifrac距离的PCoA分析图Fig.7 PCoA analysis chart based on weighted unifrac distance
加权unifrac方法(weighted unifrac)能从样本中的物种有无和物种丰度两方面反映群落结构关系,群落中组成结构相似度高的更倾向于聚集在一起,而组成差异大的样本会分散排列。可见此实验中模型组样本比较集中,相似度较高。而对照组和低、中、高剂量组样本分散度较大,除模型组外的其他4个置信圈重叠部分较多,说明组间差异不显著。此项分析表明灌胃头孢曲松钠后小鼠肠道菌群结构发生了改变,而L.plantarum P9能使小鼠肠道菌群结构有所恢复。
2.8.4 物种相对丰度分析
物种相对丰度分析结果见图8。

图8 门水平物种丰度柱形图和属水平物种丰度柱形图Fig.8 Column diagram of species abundance at phylum level and at genus level
在物种组成方面,在门水平选取丰度排名前10(top 10)的物种绘制柱形图(图8A),对照组的主要菌有拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota),在 top 10中占比91.3%,其中拟杆菌门占49.41%,厚壁菌门占35.3%,疣微菌门占6.59%。在属水平选取丰度排名前10的属绘制柱形图(图8B),各组的优势菌属有阿克曼氏菌属(Akkermansia)、杜氏杆菌属(Dubosiella)、毛螺旋菌属(Lachnospiraceae_NK4A136_group)。Top 10的菌属在模型组的总丰度相对较低,在低、中、高剂量组相对较高。模型组Akkermansia丰度有所降低,拟普雷沃氏菌属(Alloprevotella)丰度有所升高,而在给予L.plantarum P9后,Akkermansia丰度升高,Alloprevotella丰度降低。除此之外,低、中、高剂量组的普雷沃菌属(Prevotellaceae_UCG-001)、别样杆菌属(Alistipes)相对于对照组和模型组明显升高,高剂量组Dubosiella相对于其他组明显升高。此部分结果概括说明了L.plantarum P9能改善小鼠肠道因灌胃头孢曲松钠造成的菌群变化。
2.8.5 物种显著性差异分析
利用T检验对各组间的差异物种进行分析,绘制heatmap图,见图9。
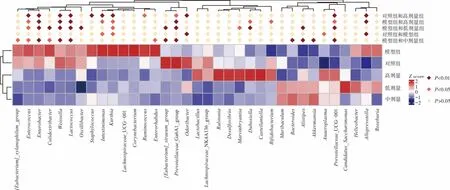
图9 组间差异物种分析heatmap图Fig.9 The heatmap diagram of species differences between groups
从属水平看,与对照组相比,模型组拟普雷沃氏菌属(Alloprevotella)丰度极显著增多(P<0.01),厌氧支原体属(Anaeroplasma)、肠单胞菌属(Intestinimonas)、库特氏菌属(Kurthia)丰度显著增多(P<0.05),气味杆菌属(Odoribacter)丰度极显著减少(P<0.01)。Alloprevotella是从人类口腔分离出来的新型菌,临床研究显示,Alloprevotella感染与下颌骨骨髓炎和口腔鳞状癌有密切联系[26]。Anaeroplasma是柔膜体纲8个属之一,是引起人和动物呼吸系统、泌尿系统、生殖系统炎症的主要致病菌[27]。Intestinimonas是小鼠肠道的一种能产生丁酸盐的细菌,对抗生素有一定耐药性[28]。Kurthia为一种食品致腐阶段性参与菌,具有抗逆性和多重降解功能,研究显示它能够降解农田中残留的抗生素[29]。上述结果表明抗生素造损后上述致病菌及具有抗生素抗性的微生物丰度有所增加。
灌胃L.plantarum P9后,与模型组相比,低、中、高剂量组的肠球菌属(Enterococcus)丰度显著减少(P<0.05),肠杆菌属(Enterobacter)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)丰度极显著减少(P<0.01),而 Prevotellaceae_UCG-001、理研菌属(Alistipes)、拟杆菌属(Bacteroides)丰度有所增加。低剂量组杜氏杆菌(Dubosiella)丰度极显著升高(P<0.01),颤螺旋菌属(Oscillibacter)、Colidextribacter、惰性真杆菌([Eubacterium]_siraeum_group)丰度极显著升高(P<0.01);中剂量组 Colidextribacter丰度显著减少(P<0.05),阿克曼菌(Akkermansia)丰度显著上升(P<0.01);高剂量组卡斯特兰尼氏菌属(Castellaniella)、双歧杆菌(Bifidobacterium)丰度显著升高(P<0.05),Intestinimonas丰度显著降低(P<0.05)。肠球菌、肠杆菌和双歧杆菌的结果与2.7部分相吻合。魏斯氏菌、乳球菌、杜氏杆菌都属于乳酸菌,目前关于魏斯氏菌抗生素耐药性暂无报道,但研究显示乳球菌对大多数常用抗生素具有不同程度耐药性[30],阿克曼菌是一种黏蛋白分解细菌,研究显示其与肥胖、代谢性疾病、炎症呈负相关,不仅可以保护小肠上皮细胞完整性,还可以通过调节T细胞发挥抗炎作用[31]。说明灌胃L.plantarum P9后,与模型组相比具有抗生素抗性的细菌丰度减少,同时肠道内一些有益细菌丰度有所增加。
综上所述,灌胃抗生素使小鼠肠道对抗生素有耐药性和降解功能的细菌增加,使得它们的OTUs数目高于对照组和3个剂量组,而灌胃L.plantarum P9后能够降低这些细菌的数目,使其恢复至对照组水平,其中高剂量组的效果更加明显。
3 结论
本文探究了植物乳杆菌P9对头孢曲松钠诱导的肠道菌群失调小鼠的作用,结果显示植物乳杆菌P9能够降低小鼠因肠道菌群失调导致的全身炎症反应,提高肝脏和小肠的氧化应激水平。灌胃抗生素头孢曲松钠导致小鼠肠道对抗生素耐药的细菌丰度增加,而植物乳杆菌P9可以降低耐药细菌的丰度,植物乳杆菌P9具有调节肠道菌群的作用。
