响应面微波辅助酸法优化提取西兰花茎果胶多糖
2022-05-01冯李院刘经伦杨梅福艾薇汪玉洁
冯李院,刘经伦,杨梅福,艾薇,汪玉洁
(1.保山学院资源环境学院,云南 保山 678000;2.云南省高校怒江河谷生物质资源高值转化与利用重点实验室,云南 保山 678000)
果胶多糖是一种广泛存在于植物初生细胞壁和胞间层中结构复杂的天然高分子化合物,天然果胶类物质主要以原果胶、果胶和果胶酸三种形态存在于植物的果实、根、茎和叶中[1-2]。其中不溶于水的原果胶在酸、碱、酶等的作用下,转变成水溶性果胶并可通过乙醇沉淀析出,故通常以酸、碱和酶等为萃取剂和以乙醇为沉淀剂提取果胶多糖。果胶多糖具有良好的增稠性、稳定性、凝胶性、乳化性和组织成型促进等特性[3-9]以及具有降血糖[10-12]、调节胃肠道菌群[13-15]、抗氧化[16-17]、抗肿瘤[18-19]、免疫调节[20-21]和吸附重金属[22-23]等作用,被广泛应用于食品和医药等行业。目前全球果胶需求量预计以每年大约3%~6%的速度递增,而我国每年的果胶需求量有80%需要进口,当前商业果胶主要为柑橘皮果胶和苹果皮果胶,我国果胶资源物产丰富,但很多原料副产物被直接丢弃或利用率不足致使果胶生产能力和质量较差,若加以充分综合利用,将会产生极大效益[24]。目前,果胶多糖的提取方法主要有酸提法、碱提法、酶提法、超声波辅助法和微波辅助法等[25-26]。其中,微波是一种具有很强热效应和化学效应的高频电磁波,能使介质材料中的分子相互摩擦碰撞,提高物料温度和促进提取液中细胞破裂,使原果胶多糖物质能够更好地渗出于提取液中。微波辅助提取技术与其他传统单一的提取技术相比,具有耗时少、操作简便和得率高等优点,受到越来越多的关注。
西兰花(Brassica oleracea L.var italic Planch)又名青花菜、西蓝花、绿菜花、绿花菜等,富含硫代葡萄糖苷、多糖、维生素、矿物质和酚类等多种营养物质,是一种具有多种生理功效和享有“蔬菜皇冠”美誉的蔬菜[27-28]。西兰花原产于地中海东部地区,全球范围内均有种植,19世纪末从意大利传入我国,根据2021年联合国粮食及农业组织统计数据库显示,从2005年至2019年间世界花椰菜和西兰花的产量吨数增长54%,中国的产量吨数增长45%。西兰花除花球以外的茎叶通常被当作废弃物大量丢弃,造成资源浪费和环境污染,其茎叶约占整棵植株重量的50%~70%,当前西兰花副产物主要用于发酵饲料[29]。
目前有关西兰花茎果胶多糖提取工艺的研究较少,主要有田亚红等[30]采用盐酸醇沉法并通过单因素和正交试验得出最佳西兰花茎叶果胶提取工艺条件,得率为0.68%(称重法);李妍等[31]采用超声波结合三因素三水平响应面得出最佳西兰花茎多糖工艺条件,得率为5.69%(苯酚硫酸法);Petkowicz等[32]先用乙醇预处理原料再经硝酸乙醇沉淀法提取西兰花茎果胶,得率为18%,同时果胶具有较好的理化性质,可考虑作为一种商业果胶来源。
利用微波辅助酸法并结合响应面提取西兰花茎果胶多糖的研究尚未见报道。因此,该研究以保山当地种植的蔓陀绿西兰花茎为主要原料,采用微波辅助酸法提取果胶多糖,并用单因素试验(料液比、提取液pH值、微波功率和微波时间)和响应面分析法来优化提取工艺,不仅提高西兰花副产物的综合利用率,同时也为优质果胶多糖来源的探究提供试验依据。
1 材料与方法
1.1 材料与试剂
蔓陀绿西兰花:市售;食用酒精(经旋转蒸发仪提纯后使用):云南康丰糖业(集团)有限公司勐糯分公司;浓盐酸(分析纯):重庆川东集团有限公司;95%乙醇、无水乙醇(均为分析纯):重庆川东化工有限公司。
1.2 仪器与设备
鼓风干燥箱(DHG 9030A):上海一恒科学仪器有限公司;美的微波炉(QIMO-J1-8D):上海琪摩电子科技有限公司;循环水式多用真空泵[SHZ-D(Ⅲ)]:郑州长城科工贸有限公司;离心机(TDL-5-A):上海安亭科学仪器厂;旋转蒸发仪(N100IDSB210):上海泉杰仪器有限公司;超声清洗机(SK250HP):上海科导有限公司;分析天平(CP214):上海奥豪斯仪器有限公司;高速多功能粉碎机(CS-2000):武义海纳电器有限公司;80目标准检验筛:绍兴市上虞华丰五金仪器有限公司;pH计(PHS-3C):上海仪电科学仪器股份有限公司。
1.3 原料预处理
将新鲜蔓陀绿西兰花除去花球、病虫害和霉变部分,剩下的西兰花茎(含少量叶子)洗净切成大小和厚度大致相同的片状,放入沸水中热烫5 min之后用冷水冲洗(高温灭果胶酶和纤维素酶,防止果胶多糖被降解致使果胶多糖得率降低),挤去多余水分的原料均匀摊放在瓷盘中并置于50℃烘箱烘干,粉碎过80目筛,粉末于自封袋中密封避光保存备用。
1.4 提取工艺流程
称取一定量西兰花茎粉末,按一定料液比加入用盐酸调pH值为设定值的纯水,充分搅拌,测pH值后再次用盐酸调节整个提取液pH值至目标值。将调好pH值的提取液放入微波炉,设置一定微波功率和一段微波时间萃取后,4 500 r/min离心10 min,将上清液过滤,往滤液中加入与滤液等体积的提纯工业酒精,充分搅拌均匀,用保鲜膜盖住烧杯以防乙醇挥发,于25℃室温静置沉淀12 h,4 500 r/min离心20 min,将滤液通过已恒重的滤纸进行抽滤(分别用75%、85%、95%乙醇和无水乙醇依次冲洗),弃其上清液,收集沉积物并置于空气中以挥发掉乙醇,50℃烘箱干燥2.5 h,称量并采用质量法计算西兰花茎的果胶多糖得率。
果胶多糖得率/%=(G1/G2)×100
式中:G1为成品质量,g;G2为原料粉末质量,g。
1.5 单因素试验设计
1.5.1 料液比对果胶多糖得率的影响
固定提取液pH2.0、微波时间5.0 min和微波功率600W 条件下,考察 1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)不同料液比对果胶多糖得率的影响。
1.5.2 提取液pH值对果胶多糖得率的影响
固定微波时间5.0 min、微波功率600 W和料液比1∶20,考察 0.5、1.0、1.5、2.0、2.5、3.0 不同提取液 pH 值对果胶多糖得率的影响。
1.5.3 微波功率对果胶多糖得率的影响
固定微波时间 5.0 min、料液比 1∶20(g/mL)和提取液 pH 值 1.5,考察 600、700、800、900、1 000 W 不同微波功率对果胶多糖得率的影响。
1.5.4 微波时间对果胶多糖得率的影响
分别取料液比1∶20(g/mL)、提取液pH值1.5和微波功率 900 W 条件下,考察 5.0、6.0、7.0、8.0、9.0 min 不同微波时间对果胶多糖得率的影响。
1.6 响应面试验设计
以果胶多糖得率作为评价指标的单因素试验结果为基础,利用Design-Expert V8.0.6的箱线设计(Box-Behnken design,BBD)对西兰花茎果胶多糖提取工艺进行四因素三水平的响应面优化设计,具体见表1。
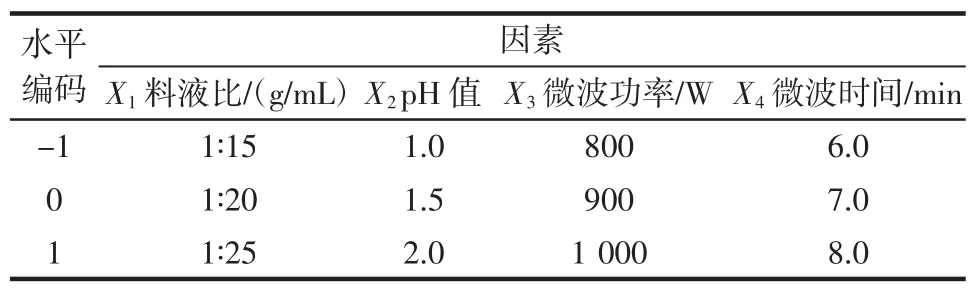
表1 响应面试验设计Table 1 Design of response surface test
1.7 数据处理
结果数值以平均值±标准差表示,标准误差在图中用误差线表示;运用Design-Expert V8.0.6软件进行响应面设计和方差分析,Origin 2018软件和SPSS 23软件分别进行绘图及数据统计分析。
2 结果与讨论
2.1 单因素试验结果分析
2.1.1 料液比对西兰花茎果胶多糖得率的影响
图1为料液比对西兰花茎果胶多糖得率的影响。

图1 料液比对西兰花茎果胶多糖得率的影响Fig.1 Effects of solid-liquid ratio on the yield of pectin polysaccharide from broccoli stalk
由图1可知,果胶多糖得率随着提取液的不断增加呈先上升后下降的变化趋势,且总体上差异显著。其中料液比为1∶20(g/mL)时,果胶多糖得率最高,为(3.83±0.10)%,与其他料液比组相比具有显著性差异。这可能是由于提取液添加量较小时,溶液黏度大,难以保证原料中的果胶多糖完全提取到提取液中,且相对浓度过大致使过滤困难如烧杯等仪器上的果胶多糖残留量较多,造成提取不完全,得率较低;而当提取液添加量超过1∶20(g/mL)时,原料被过度稀释且伴随其他物质的溶出,造成后续的离心、抽滤、沉淀和烘干等工艺提取不完全,致使果胶多糖的溶出率下降,同时果胶多糖在提取液添加量多时更易被水解,造成损失。因此,从得率、成本和操作性等方面考虑,拟定料液比1∶15(g/mL)~1∶25(g/mL)进行下一步试验研究。
2.1.2 提取液pH值对西兰花茎果胶多糖得率的影响图2为提取液pH值对西兰花茎果胶多糖得率的影响。

图2 提取液pH值对西兰花茎果胶多糖得率的影响Fig.2 Effects of pH value of extraction solution on the yield of pectin polysaccharide from broccoli stalk
由图2可知,果胶多糖得率随着提取液pH值不断增高呈先上升后下降的变化趋势,且总体上差异显著。其中提取液pH值为1.5时,果胶多糖得率最高,为(4.11±0.19)%,与pH值为2.0时相比差异不显著,而与其他pH值组相比具有显著性差异。这可能是由于酸性条件会破坏植物细胞结构,使果胶多糖溶出,但在过酸性条件下,部分果胶多糖分子会被降解成小分子量果胶多糖片段[33],而乙醇很难将这部分小分子果胶多糖沉淀,导致果胶多糖得率较低;而当提取液pH值从1.5升至3.0时,由于提取液pH值不断升高,对植物细胞壁的破坏作用减弱,致使果胶多糖溶出量不断减少,得率下降。因此,拟定提取液pH值1.0~2.0进行下一步试验研究。
2.1.3 微波功率对西兰花茎果胶多糖得率的影响
图3为微波功率对西兰花茎果胶多糖得率的影响。
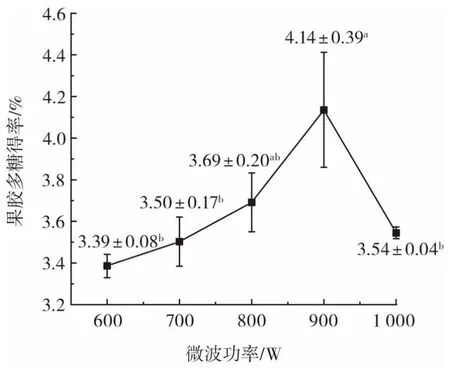
图3 微波功率对西兰花茎果胶多糖得率的影响Fig.3 Effects of microwave power on the yield of pectin polysaccharide from broccoli stalk
由图3可知,果胶多糖得率随着微波功率不断提高呈先上升后下降的变化趋势,且总体上差异显著。其中当微波功率达到900 W时,果胶多糖得率最高,为(4.14±0.39)%,与微波功率800 W时相对差异不显著,而与其他微波功率组具有显著性差异。这可能是由于微波功率越大,对原料的穿透作用越强,温度上升越快,更容易使原料中的不溶性果胶多糖转变为水溶性果胶多糖,从而果胶多糖得率升高[26];但当微波功率过大(超过900 W),果胶多糖水解剧烈,同时温度过高致使果胶多糖降解,从而得率下降[34]。因此,拟定微波功率800 W~1 000 W进行下一步研究。
2.1.4 微波时间对西兰花茎果胶多糖得率的影响
图4为微波时间对西兰花茎果胶多糖得率的影响。

图4 微波时间对西兰花茎果胶多糖得率的影响Fig.4 Effects of microwave time on the yield of pectin polysaccharide from broccoli stalk
果胶多糖得率随着微波时间不断延长呈先上升后下降的变化趋势,且总体上差异显著。其中当微波时间达到7.0 min时,果胶多糖得率最高,为(4.60±0.21)%,与微波时间6.0 min时相比差异不显著,而与其他微波时间组相对具有显著性差异。这可能是由于随着微波时间的延长,原料中的果胶多糖逐渐溶到提取液中,一些不溶性果胶多糖转变为可溶性果胶多糖;但微波时间过长(超过7.0 min),果胶多糖中的半乳糖醛酸分解加剧,从而导致果胶多糖得率下降[35]。因此,拟定微波时间6.0 min~8.0 min进行下一步试验研究。
2.2 响应面试验结果分析
2.2.1 响应面结果
响应面试验设计及结果见表2。

表2 响应面方案及其结果Table 2 Response surface scheme and results

续表2 响应面方案及其结果Continue table 2 Response surface scheme and results
2.2.2 方差分析
利用BBD对表2中的数据进行回归分析和多项式拟合,得到方差分析表3和西兰花茎果胶多糖得率的最终方程(编码因素)。方差分析见表3。
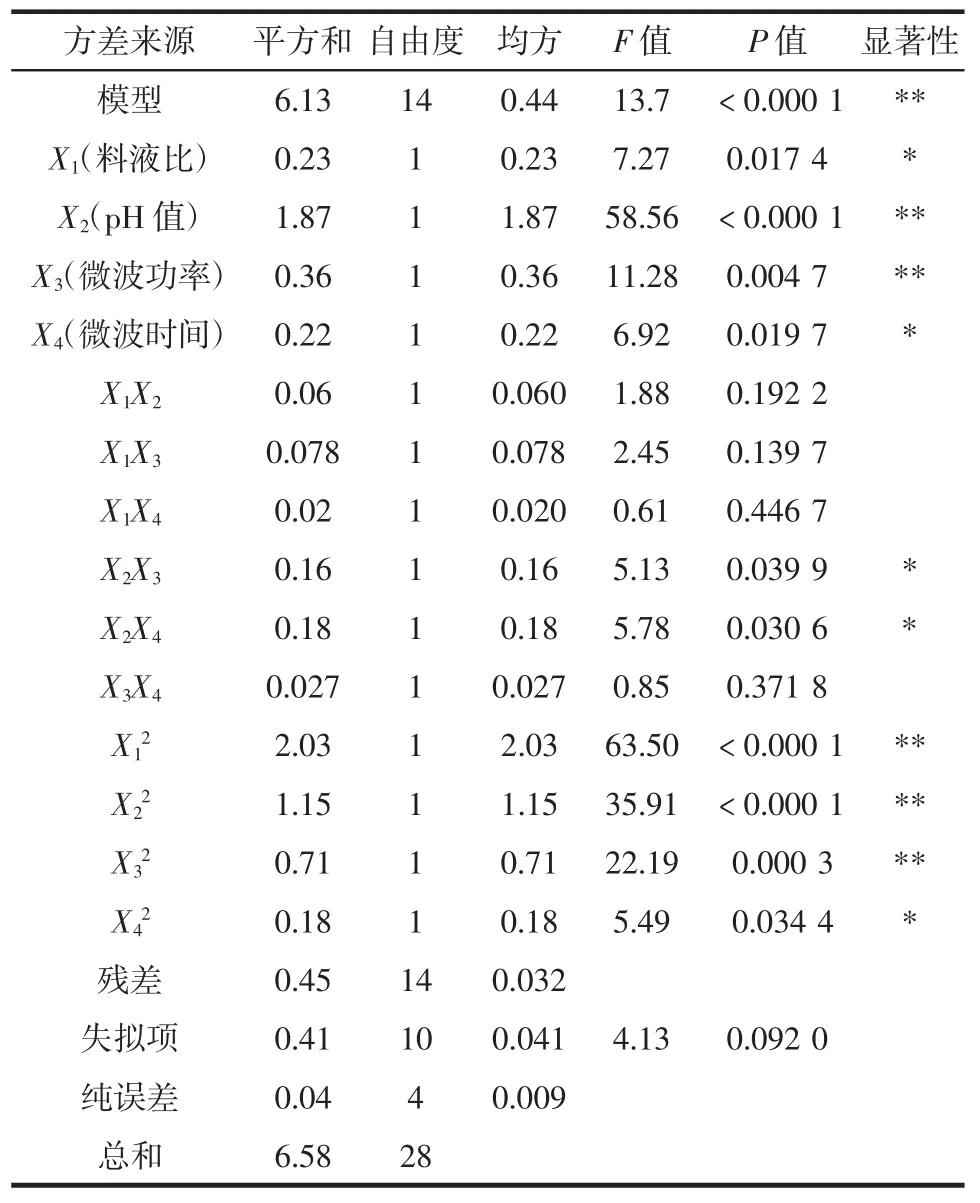
表3 方差分析Table 3 Analysis of variance
西兰花茎果胶多糖得率回归方程:Y%=4.79+0.14X1+0.39X2+0.17X3+0.14X4+0.12X1X2-0.14X1X3+0.07X1X4-0.20X2X3-0.21X2X4-0.082X3X4-0.56X12-0.42X22-0.33X32-0.16X42。
分析表3可知,响应面回归模型的F值为13.7,达到极显著水平(p<0.000 1),表明该模型显著;由F值大小得知,各因素对果胶多糖得率的影响大小顺序为提取液 pH 值(X2)>微波功率(X3)>料液比(X1)>微波时间(X4),且均为显著因素,其中提取液pH值和微波功率为极显著因素;X2X3、X2X4和 X42为显著因素,X12、X22、X32为极显著因素(p<0.000 1),说明以上显著因素和极显著因素与果胶多糖得率之间存在明显的数学关系;失拟项不显著(p=0.092 0>0.05),相关系数R2=0.932 0和校正系数R2adj=0.863 9,表明该模型拟合效果良好,86.39%的果胶多糖得率变化值可通过该模型解释,能较好地反映试验中4个影响因素与响应值的变化情况[36];变异系数为4.27%<15%,信噪比为11.838%>4%,表明该模型试验误差小,可靠性高。
2.2.3 交互作用分析
为探究双因素交互作用对西兰花茎果胶多糖得率的影响,先固定4个因素中的任意两个因素在零水平,再分析另外两个因素的交互作用[37],若响应曲面坡度越陡峭,说明因素影响越大,反之影响越小[38]。
图5为料液比与提取液pH值交互作用对果胶多糖得率的影响。

图5 料液比与提取液pH值交互作用Fig.5 The interaction between solid-liquid ratio and pH of the extraction solution
由图5可知,以微波时间和微波功率为定量,果胶多糖得率随着提取液添加量或提取液pH值的增大呈先增大后减小趋势,且变化幅度相对较小,曲面坡度较平缓,说明料液比与提取液pH值的交互作用对果胶多糖得率的影响不显著,这与方差分析结果一致。
图6为料液比与微波功率交互作用对果胶多糖得率的影响。

图6 料液比与微波功率交互作用Fig.6 The interaction between solid-liquid ratio and microwave power
以微波时间和提取液pH值为定量,果胶多糖得率随着提取液添加量或微波功率的增大呈先增大后缓慢减小趋势,减小幅度小于增大幅度,曲面坡度相对于图5稍较陡,但坡度相对于后面两组仍较小,说明微波时间和提取液pH值的交互作用对果胶多糖得率的影响不显著,这与方差分析结果一致。
图7为料液比与微波时间交互作用对果胶多糖得率的影响。

图7 料液比与微波时间交互作用Fig.7 The interaction between solid-liquid ratio and microwave time
以提取液pH值和微波功率为定量,果胶多糖得率随着提取液添加量或微波时间的增大呈先增大后减小趋势,变化幅度较小,特别是微波时间,曲面坡度较平缓,说明料液比与微波时间的交互作用对果胶多糖得率的影响不显著,这与方差分析结果一致。
图8为提取液pH值与微波功率交互作用对果胶多糖得率的影响。

图8 提取液pH值与微波功率交互作用Fig.8 The interaction between pH of the extraction solution and microwave power
以微波时间和料液比为定量,提取液pH值或微波功率处于低水平时,果胶多糖得率随微波功率或提取液pH值的增大呈先大幅增大后缓慢减小趋势;而当其逐渐处于高水平时,果胶多糖得率随微波功率或提取液pH值的增大呈先缓慢增大后大幅减小趋势。曲面坡度明显陡峭,说明提取液pH值与微波功率的交互作用对果胶多糖得率的影响显著,这与方差分析结果一致。
图9为提取液pH值与微波时间的交互作用对果胶多糖得率的影响。

图9 提取液pH值与微波时间交互作用Fig.9 The interaction between pH of the extraction solution and microwave time
以料液比和微波功率为定量,当提取液pH值或微波时间处于低水平时,果胶多糖得率随微波时间或提取液pH值的增大呈先大幅增大后趋于平缓的趋势;而当其逐渐处于高水平时,果胶多糖得率随微波时间或提取液pH值的增大呈先轻微增大后减小趋势。曲面坡度明显陡峭,说明提取液pH值和微波时间的交互作用对果胶多糖得率的影响显著,这与方差分析结果一致。
图10为微波功率与微波时间交互作用对果胶多糖得率的影响。

图10 微波功率与微波时间交互作用Fig.10 The interaction between microwave power and microwave time
以料液比与提取液pH值为定值,果胶多糖得率随着微波功率或微波时间的增大呈先增大后减小趋势,低水平的变化幅度大于高水平的变化幅度,但总体上变化幅度很小。曲面坡度平缓,说明微波功率与微波时间的交互作用对果胶多糖得率的影响不显著,这与方差分析结果一致。
2.2.4 最优参数及验证
响应面得到最佳西兰花茎果胶多糖提取工艺参数为料液比 1∶20.86(g/mL)、提取液 pH 值 1.72、微波功率907.22 W、微波时间7.14 min。为验证结果的可靠性,结合实际条件将工艺参数修整为料液比1∶21(g/mL)、提取液pH值1.7、微波功率900 W、微波时间7.0 min。在此条件下进行3次平行试验,得到西兰花茎果胶多糖得率为(4.88±0.00)%,与预测值4.91%的相对误差为0.94%,得率显著高于盐酸醇沉法(0.69%)[30],但低于硝酸醇沉法(18%)[32],这可能是由于不同提取方法、不同预处理和原料成分差距等原因造成,但仍可说明采用此响应面优化的西兰花茎果胶多糖提取工艺具有良好的可靠性和发展潜力。
3 结论
本试验采用微波辅助酸法提取西兰花茎果胶多糖,分别研究料液比、提取液pH值、微波功率和微波时间4个因素对西兰花茎果胶多糖得率的影响,以单因素试验结果为基础,通过Design-Expert V8.0.6 BBD进行响应面试验设计,分析出西兰花茎果胶多糖提取的最佳工艺条件为料液比1∶21(g/mL)、提取液pH值1.7、微波功率900 W、微波时间7.0 min,在此条件下西兰花茎果胶多糖得率为(4.88±0.00)%,与预测值仅有0.94%的相对误差。响应面模型显著且拟合度高,四个因素对果胶多糖得率的影响大小顺序:提取液pH值(X2)>微波功率(X3)>料液比(X1)>微波时间(X4),且均为显著因素,其中提取液pH值和微波功率为极显著因素,编码因素方程∶Y%=4.79+0.14X1+0.39X2+0.17X3+0.14X4+0.12X1X2-0.14X1X3+0.07X1X4-0.20X2X3-0.21X2X4-0.082X3X4-0.56X12-0.42X22-0.33X32-0.16X42。该试验不仅对西兰花的副产物进行综合利用,同时为西兰花茎果胶多糖的提取研究提供微波辅助酸法技术支持,以期为探究我国优质果胶来源提供有价值的理论和试验依据。
