基于网络药理学探讨竹节参防治肝癌的作用机制
2022-04-28吴广阳
吴广阳 唐 浪 詹 杰 赵 芬 黄 胜
基于网络药理学探讨竹节参防治肝癌的作用机制
吴广阳唐 浪詹 杰赵 芬黄 胜
(湖北民族大学,湖北 恩施 445000)
基于网络药理学探讨竹节参防治肝癌的作用机制。利用TCMSP、Swiss Target Prediction数据库结合文本挖掘方式,提取竹节参的化合物成分、化合物靶点关系,利用OMIM和Gene Cards网站提取竹节参的疾病靶点,R语言V4.0.3绘制Venny图以获得交集靶点,相关信息导入Cytoscape V3.8.2以获得化合物-靶点-疾病网络;依据交集靶点,在STRING网站获得蛋白互作网络,R语言V4.0.3进行GO、KEGG富集分析。在TCMSP、Swiss Target Prediction库中共获得15种有效化合物,包括皂苷、多糖、黄酮类等,对应靶点数259个,药物与疾病交集靶点57个,导入STRING网站发现连线较多的靶蛋白为AKT1、VEGFA、CASP3等,药物-有效化合物-靶点-疾病网络图表明,度值较高的化合物是竹节参皂苷Ⅳa、竹节参皂苷Ⅳa_qt、人参皂苷 Rg2_qt等;GO生物学过程富集分析发现:竹节参的关键靶蛋白主要通过调控内肽酶、蛋白丝氨酸/苏氨酸激酶、DNA结合转录激活活性RNA聚合酶II特异性等方式起到改善肝癌的作用;KEGG富集通路发现竹节参影响肝癌主要通过PI3K-AKT、卡波西肉瘤相关疱疹病毒感染、脂质和动脉粥样硬化等信号通路。竹节参防治肝癌具有多靶点、多通路的特点,其治疗机制可能是通过调控AKT1、VEGFA、CASP3的活性有关。
竹节参;肝癌;网络药理学;靶点
引言
肝癌的发病率位居全球恶性肿瘤第六位,死亡率位居第四位,其中肝细胞癌(Hepatocellular carcinoma,HCC)占肝癌的75%~85%,每年全球新增肝癌病例约84万,新增死亡病例约78万[1],据其临床表现、体征,可将其归属于中医的“肝积”“癖积”“胁痛”“黄痘”等病症的类别。肝癌常见临床表现为纳呆、消瘦、胁痛、上腹肿块、发热、黄疸和腹水等,中医药治疗在控制患者病情发展、减少复发、改善症状体征、提高生存质量、延长生存等方面有着自己独特的优势[2]。
竹节参,又名白三七、野三七、竹节人参等,是五加科植物竹节参Panax japonicus C.A.Mey.的干燥根茎。其性温,味甘、苦,具有补虚强壮、散瘀止血、止痛的功效。有研究证明,它对肝损伤、肝炎、肝癌等具有较好的预防与治疗作用。然而竹节参影响肝癌确切机制尚不清楚,因此本文通过网络药理学探讨竹节参影响肝癌的机制,以挖掘潜在的治疗靶点,为竹节参改善肝癌提供一定的理论依据。
1 材料与方法
1.1 药物-化合物-靶点-疾病网络图
从TCMSP、Swiss Target Prediction数据库提取竹节参的化合物、化合物靶点关系,OMIM、Gene Cards网站检索疾病“cancer of the liver”的靶点,获得疾病的靶点关系;R语言V4.0.3软件安装“Venn Diagram”包,得到药物-化合物-靶点-疾病信息,然后将相关信息导入cytoscape V3.8.2,以获取药物-化合物-靶点-疾病网络图。
1.2 PPI网络
将交集靶点导入STRING网站,得到PPI网络图,将TSV文件导入R语言V4.0.3软件,得到PPI统计图。
1.3 GO、KEGG富集分析
在R语言V4. 0. 3 软件中安装“RSQLite”“org. Hs. eg. db”程序包,将竹节参的交集靶点名转换为对应的基因ID;安装“colorspace”“stringi”“DOSE”“clusterProfiler”“pathview”程序包,基于基因ID分别进行GO、KEGG富集分析得到图表。
2 结果
2.1 化合物-靶点-疾病网络
利用TCMSP、Swiss Target Prediction数据库提取竹节参的化合物组成、化合物靶点关系(以Swiss Target Prediction生物利用度评分高,胃肠道吸收高为标准),得出竹节参含有15种有效化合物,包括皂苷、多糖、黄酮类等,对应靶点数259个,靶点排名较前的化合物为竹节皂苷Ⅳa、竹节皂苷Ⅳa_qt、人参皂苷Rg2_qt等。与肝癌取交集后,交集靶点57个(见图1),然后交集靶点导入cytoscape V3.8.2以获取药物-化合物-靶点-疾病网络图,排名较前的蛋白为AKT1、VEGFA、CASP3等(见图2)。
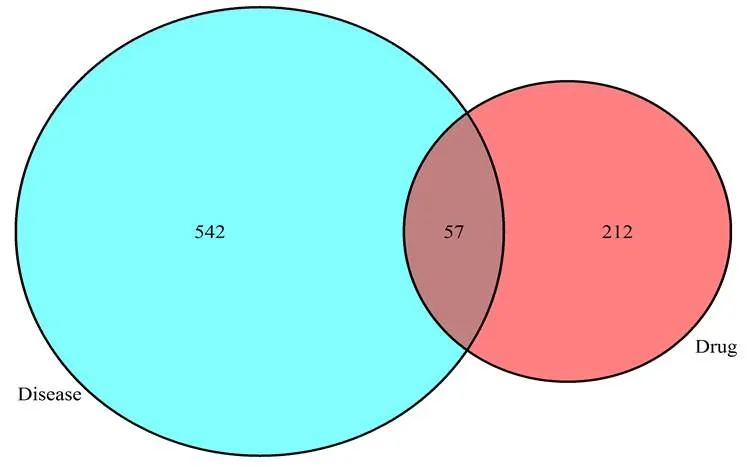
图1 竹节参有效成分与肝癌的交集靶点

图2 “药物-活性成分-关键靶点-疾病”可视化网络图
2.2 PPI网络
将交集靶点导入STRING网站,得到竹节参治疗肝癌的靶蛋白相互作用网络图(见图3),将TSV文件导入R语言V4.0.3软件,得到PPI统计图(见图4)。PPI统计图显示,AKT丝氨酸/苏氨酸激酶1(AKT serine/threonine kinase 1,AKT1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、胱天蛋白酶3(caspase 3,CASP3)、JUN原癌基因(Jun proto-oncogene,AP-1 transcription factor subunit,JUN)、基质金属肽酶 9(matrix metallopeptidase 9,MMP9)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、雷帕霉素激酶机械靶(mechanistic target of rapamycin kinase,MTOR)、前列腺素-内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、细胞周期蛋白D1(cyclin D1,CCND1)、雌激素受体1(estrogen receptor 1,ESR1)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma,PPARG)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、去乙酰化酶1( sirtuin 1,SIRT1)、B细胞淋巴瘤2(BCL2 like 1,BCL2L1)、基质金属肽酶2(matrix metallopeptidase 2,MMP2)、白细胞介素 2(interleukin 2,IL2)、丝裂原活化蛋白激酶 1(mitogen-activated protein kinase 1,MAPK1)、胱天蛋白酶8(caspase 8,CASP8)、磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha,PIK3CA)可与多种蛋白发挥作用。

图3 竹节参治疗肝癌的靶蛋白相互作用网络图
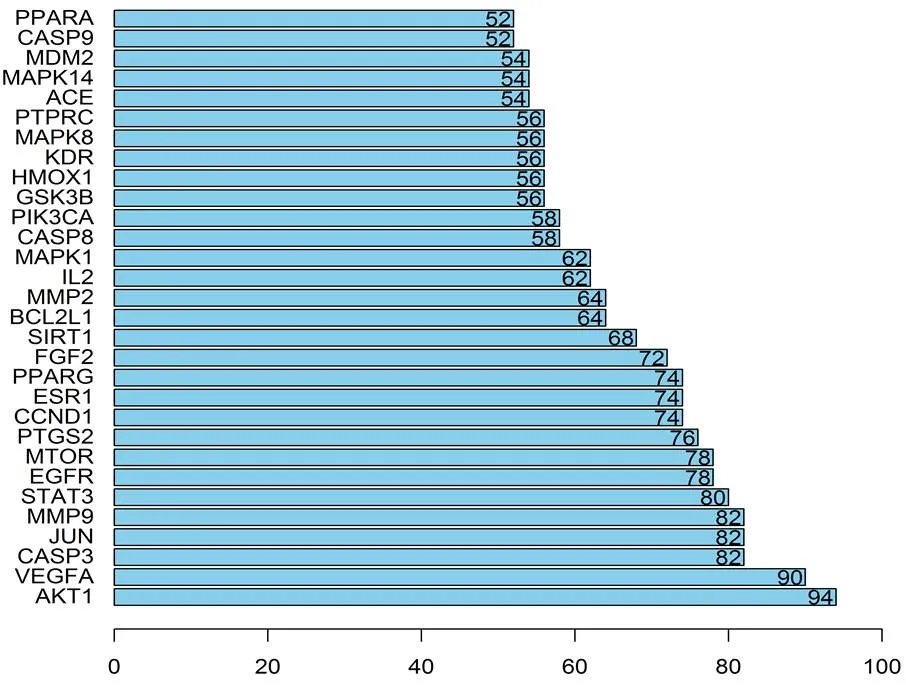
图4 竹节参治疗肝癌的靶蛋白相互作用统计图
2.3 GO、KEGG富集分析
通过GO富集分析交集靶点可观察到,内肽酶活性(endopeptidase activity)、核受体活性(nuclear receptor activity)、配体激活的转录因子活性(ligand-activated transcription factor activity)、丝氨酸型肽酶活性(serine-type peptidase activity)、丝氨酸水解酶活性(serine hydrolase activity)、RNA聚合酶II特异性 DNA 结合转录因子的结合、蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)、丝氨酸型内肽酶活性(serine-type endopeptidase activity)、细胞表面受体蛋白酪氨酸激酶活性(transmembrane receptor protein tyrosine kinase activity)、磷酸酶结合(phosphatase binding)、DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白酶结合(protease binding)、胰岛素受体基底结合(insulin receptor substrate binding)、半胱氨酸型内肽酶活性参与凋亡信号通路(cysteine-type endopeptidase activity involved in apoptotic signaling pathway)、蛋白酪氨酸激酶活性(protein tyrosine kinase activity)、细胞表面受体蛋白激酶活性(transmembrane receptor protein kinase activity)、肝素结合(heparin binding)、半胱氨酸型内肽酶与细胞凋亡的关系(cysteine-type endopeptidase activity involved in apoptotic process)等生物进程可能为竹节参治疗肝癌的机制(见图5、表1)。

图5 竹节参治疗肝癌的GO富集分析柱状图

表1 竹节参治疗肝癌的GO富集分析表
KEGG富集分析可观察到糖尿病并发症中的衰老信号通路(AGE-RAGE signaling pathway in diabetic complications)、卡波西肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、脂质和动脉粥样硬化(Lipid and atherosclerosis)、内分泌抵抗(Endocrine resistance)、癌症中的蛋白多糖(Proteoglycans in cancer)、胰腺癌(Pancreatic cancer)、EGFR酪氨酸激酶抑制剂抗性(EGFR tyrosine kinase inhibitor resistance)、化学致癌-受体激活(Chemical carcinogenesis-receptor activation)、PI3K-AKT信号通路(PI3K-Akt signaling pathway)、人巨细胞病毒感染(Human cytomegalovirus infection)、前列腺癌(Prostate cancer)、膀胱癌(Bladder cancer)、麻疹(Measles)、大肠癌(Colorectal cancer)、丙型肝炎(Hepatitis C)、人类乳突病毒感染(Human papillomavirus infection)、Foxo 信号通路(FoxO signaling pathway)、C 型凝集素受体信号通路(C-type lectin receptor signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)等信号通路可能为竹节参治疗肝癌的机制(见图6、表2)。
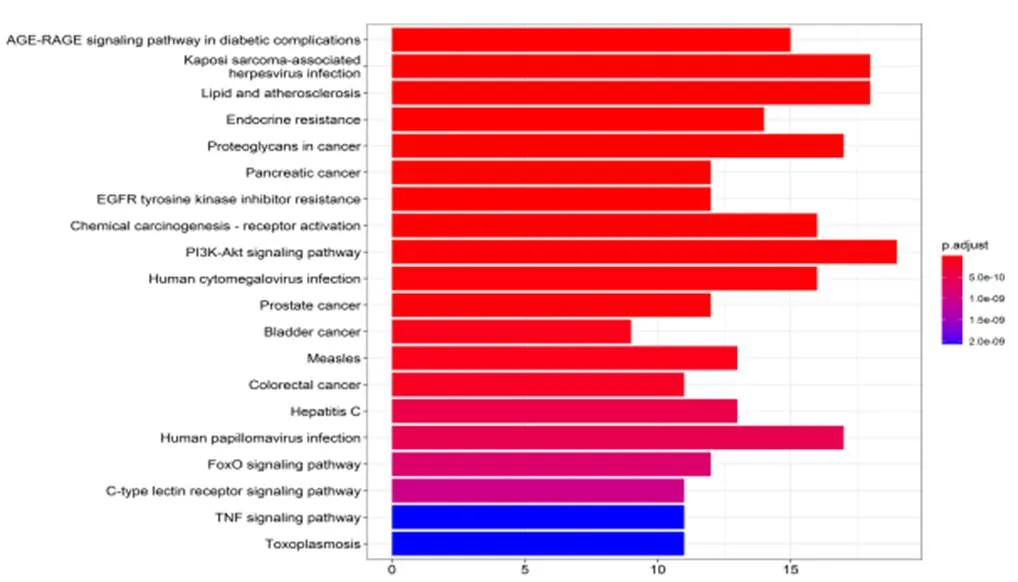
图6 竹节参治疗肝癌的KEGG富集分析柱状图

表2 竹节参治疗肝癌的KEGG富集分析表
3 讨论
肝癌是全球常见和致命的恶性肿瘤之一,目前,治疗肝癌最有效的方法是手术切除,这种方法会导致许多手术并发症和副作用,如肝缺血、肠道出血[3]。中医认为,肝癌的发生、发展是内外因共同导致的结果,其中正虚为本、邪实为标、气滞血瘀为其主要病机,竹节参具有补虚强壮、散瘀止血、止痛的功效,可以较好地改善病症。
有研究可知竹节参中活性成分主要是竹节皂苷Ⅳa、竹节皂苷Ⅳa_qt、竹节皂苷Ia、竹节皂苷Ib、竹节皂苷III、人参皂苷Rg2、人参皂苷Rg2_qt等,有研究证明,竹节参皂苷与多糖都都较好的抗肿瘤作用,竹节参皂苷还能抑制抑制耐药相关蛋白,多药耐药基因从而增强抗癌药物与癌症细胞的结合,增强靶向治疗的作用[4]。竹节皂苷Ⅳa、人参皂苷通过抑制肿瘤细胞增殖、凋亡、信号转导、抑制肿瘤血管生成的方式来防治肝癌[5]。
通过构建竹节参与肝癌交集靶基因PPI网络,获得PPI网络核心靶基因AKT1、VEGFA、CASP3等。PI3K/AKT通路被激活可能是多种癌症发生的机制,其中通过药物抑制PI3K/AKT通路上相关蛋白PI3K、AKT、AFP、PTEN等蛋白的表达,可以达到改善早期肝癌病变的作用[6]。血管生成被认为是恶性肿瘤发展的一个重要过程,并且与癌症的进展和转移有关。HCC是肝脏最常见的原发肿瘤,被认为是典型的血管生成肿瘤[7]。lncRNA-PDPK 2P与PDK 1相互作用并通过PDK 1/AKT/CASP3信号通路促进HCC进展。lncRNA-PDPK 2P可以促进肝癌进展,这表明它可能是临床上有价值的生物标志物和作为用于诊断、预后,以及治疗肝细胞癌的分子靶标[8]。
GO生物学过程富集分析主要集中在内肽酶活性、核受体活性、配体激活的转录因子活性、丝氨酸型肽酶活性、丝氨酸水解酶活性、RNA聚合酶II特异性DNA结合转录因子的结合、蛋白丝氨酸/苏氨酸激酶活性、丝氨酸型内肽酶活性、细胞表面受体蛋白酪氨酸激酶活性、磷酸酶结合、DNA结合转录因子结合、蛋白酶结合、胰岛素受体基底结合、半胱氨酸型内肽酶活性参与凋亡信号通路、蛋白酪氨酸激酶活性、细胞表面受体蛋白激酶活性、肝素结合、半胱氨酸型内肽酶与细胞凋亡的关系等生物过程。其中中性内肽酶CD10可能是B系急性淋巴细胞白血病和多种癌症的诊断和预后的非常有用的工具。已经检测到中性内肽酶的表达在肿瘤细胞中可以上调或下调,中性内肽酶间接和直接参与调节介导细胞迁移、增殖和存活的信号通路[9]。
KEGG富集分析可观察到糖尿病并发症中的衰老信号通路、卡波西肉瘤相关疱疹病毒感染、脂质和动脉粥样硬化、内分泌抵抗、癌症中的蛋白多糖、胰腺癌、EGFR酪氨酸激酶抑制剂抗性、化学致癌-受体激活、PI3K-AKT信号通路、人巨细胞病毒感染、前列腺癌、前列腺癌、膀胱癌、麻疹、大肠癌、丙型肝炎人类乳突病毒感染、Foxo 信号通路、C 型凝集素受体信号通路、肿瘤坏死因子信号通路可能为竹节参治疗肝癌的机制。其中PI3K/AKT通路是几种人类癌症中最常见的过度激活的细胞内通路之一,该通路作用于不同的下游靶蛋白,促进肿瘤细胞的癌变、增殖、侵袭和转移,在多种癌症类型中发现了多层次的损伤,包括突变和遗传改变、miRNA序列的异常调节和级联因子的异常磷酸化[10]。有研究表明马尼布通过PI3K/AKT信号、趋化因子信号、TGF-β等通路引发癌症[11]。细胞死亡途径、DNA 损伤和突变以及炎症是肝癌发生的驱动因素,抑制这些途径可以防止早期肝癌的发展,但这种治疗策略可能对晚期肝癌无效,炎症和肿瘤反应性基质在许多癌症中发挥重要作用,因此,通过免疫检查点抑制剂阻断促肿瘤的炎症信号和增强肿瘤免疫力可能是治疗肝癌的有效策略[12]。NF-κB和STAT3可能在肝脏炎症反应和体内平衡维持中发挥重要作用,并对肝癌的发展和进展做出关键贡献,尽管在人类肝癌中负责NF-κB和STAT3激活的机制尚不完全清楚,但在病毒性肝炎和肝脂肪变性中都出现了NF-κB调节的STAT3激活细胞因子IL-6表达的作用[13]。这些研究说明预测的通路是改善肝癌的关键通路。
4 结束语
基于网络药理学分析得到的活性成分与靶基因存在相关性,两者之间有许多代谢通路,有一个关键分子调控多个通路,也有多个分子同时调控一个通路,反映了中药可以通过多成分、多通路、多靶点干预疾病的发生发展。通过上述研究,研究人员可以从不同层面去了解竹节参改善肝癌的机制,以新的眼光去发掘民族药的价值。竹节参为特色的土家药,土家医多用它补虚、抗炎、抗肿瘤。有许多研究证明,竹节参有改善肝癌的作用,但是对于其抗肝癌的具体活性成分、作用的相关靶蛋白、通过的具体通路仍然缺乏认识,通过此研究预测出竹节参相关的活性成分、关键靶点、信号通路,希望为竹节参的理论与临床研究提供一定的理论支持,为后来研究者提供一点思路。但是竹节参的活性成分、靶基因的相互作用、关键通路的获得是通过网络数据库模拟获得,仍需要后期进一步的动物实验或细胞实验验证。
[1]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[2]张宇,陈华国,赵超,等. 中药有效成分抗肝癌作用机制研究进展[J]. 中国中药杂志,2020,45(14): 3395-3406.
[3]Liao X., Bu Y, Jia Q. Traditional Chinese medicine as supportive care for the management of liver cancer: past, present, and future[J]. Genes and Diseases, 2020,7(3): 370-379.
[4]周静,付先芸,蔡三金,等. 竹节参的化学成分、药理作用及质量标志物(Q-Marker)预测分析[J]. 中草药, 2021,52(9): 2819-2830.
[5]陈颖,周岩,曹银萍. 中药皂苷类化合物体外抗肿瘤研究进展[J]. 中国医院药学杂志,2011,31(7): 591-593.
[6]Jiang N, Dai Q, Su X, et al. Role of PI3K/AKT pathway in cancer: the framework of malignant behavior[J]. Molecular Biology Reports, 2020, 47(6): 4587-4629.
[7]Lin J, Cao S, Wang Y, et al. Long non-coding RNA UBE2CP3 enhances HCC cell secretion of VEGFA and promotes angiogenesis by activating ERK1/2/HIF-1alpha/ VEGFA signalling in hepatocellular carcinoma[J]. Journal of Experimental and Clinical Cancer Research, 2018, 37(1): 113.
[8]Pan W, Li W, Zhao J, et al. lncRNA-PDPK2P promotes hepatocellular carcinoma progression through the PDK1/ AKT/Caspase 3 pathway[J]. Molecular Oncology, 2019, 13(10): 2246-2258.
[9]Mizerska-Dudka M, Kandefer-Szerszen M. Opioids, neutral endopeptidase, its inhibitors and cancer: is there a relationship among them?[J]. Archivum Immunologiae et Therapiae Experimentalis, 2015, 63(3):197-205.
[10] Rascio F, Spadaccino F, Rocchetti, M T, et al. The pathogenic role of PI3K/AKT pathway in cancer onset and Drug resistance: an updated review[J]. Cancers, 2021, 13(16): 3949.
[11] Goodson W H, Lowe L, Carpenter D O, et al. Assessing the carcinogenic potential of low-doseexposures to chemical mixtures in the environment: the challenge ahead[J]. Carcinogenesis, 2015, 36(Suppl 1): S254-S296.
[12] Yang Y M, Kim S Y, Seki E. Inflammation and liver cancer: molecular mechanisms and therapeutic targets[J]. Seminars in Liver Disease, 2019, 39(1): 26-42.
[13] He G, Karin M. NF-κB and STAT3-key players in liver inflammation and cancer[J]. Cell Research, 2011, 21(1): 159-168.
Study on the Mechanism of Prevention and Treatment of Liver Cancer by Panax Japonicus Based on Network Pharmacology
To explore the mechanism of prevention and treatment of liver cancer of Panax japonicus based on network pharmacology.TCMSP, Swiss target prediction database combined with text mining were used to extract the compound components and compound target relationship of Panax japonicus, and OMIM and Gene Cards websites were used to extract the disease targets of Panax japonicus, R language V4.0.3 draw Venny diagram to obtain intersection targets, and import relevant information into Cytoscape V3.8.2 to obtain a compound target disease network, according to the intersection target, the protein interaction network was obtained at the string website, GO and KEGG enrichment analysis was performed in R language V4.0.3.A total of 15 effective compounds, including saponins, polysaccharides and flavonoids, were obtained in tcmsp and Swiss target prediction libraries, with 259 corresponding target points and 57 drug disease intersection targets. It was found that the target proteins with more connections were AKT1, VEGFA and CASP3. The drug-effective compound-target-disease network diagram showed that the compounds with high degree value are Panax japonicus saponin Ⅳa and Panax japonicus saponin Ⅳa_qt, ginsenoside Rg2_qt, etc; GO biological process enrichment analysis found that the key target proteins of Panax japonicus can improve liver cancer mainly by regulating endopeptidase, protein serine/threonine kinase, DNA binding transcriptional activation activity and RNA polymerase II specificity; KEGG enrichment pathway found that bamboo ginseng affected liver cancer mainly through PI3K-AKT, Kaposi sarcoma associated herpesvirus infection, lipid and atherosclerosis.The prevention and treatment of liver cancer by Panax japonicus has the characteristics of multi-target and multi-channel. Its therapeutic mechanism may be related to regulating the activities of AKT1, VEGFA and CASP3.
Panax japonicus; liver cancer; network pharmacology; target
R285
A
1008-1151(2022)02-0114-05
2021-11-04
吴广阳(1994-),男,湖北民族大学医学部在读硕士研究生,研究方向为民族医学。
黄胜(1987-),男,湖北民族大学研究生导师,研究方向为微生物来源天然产物的合成。
