六堡茶中具有胆汁酸结合能力的化学成分研究
2022-04-28滕建文韦保耀尹世磊
陈 欢 滕建文 韦保耀 夏 宁 黄 丽 尹世磊
六堡茶中具有胆汁酸结合能力的化学成分研究
陈 欢滕建文韦保耀夏 宁黄 丽尹世磊
(广西大学轻工与食品工程学院,广西 南宁 530001)
以六堡成品茶为原料,采用溶剂提取法提取不同极性部分进行胆汁酸结合能力测试,并利用高效液相色谱法进行主要化学成分测定。最后用相关性分析找出具有胆汁酸结合能力的主要化学成分。通过对胆汁酸结合能力与特征物质、多酚与多糖含量的相关性分析发现六堡茶中具有结合胆汁酸能力的主要为酚类成分,除酯型儿茶素外,没食子酸(GA)与总酚含量也与胆汁酸结合能力有较强相关关系,多糖也有一定的结合胆汁酸能力。
六堡茶;胆汁酸结合能力;降脂;酚类化合物
引言
茶叶中的化合物如茶多酚,能够通过自身抗氧化能力或者改善机体内部的抗氧化系统来抵御脂质过氧化,从而预防心血管疾病。胆汁酸的生物合成为胆固醇的分解提供了一条重要的代谢途径[1]。胆汁酸的肝肠循环中,在肝脏中由胆固醇合成的胆汁酸流入胆管进入肠道,95%的胆汁酸在回肠末端被重吸收经过门静脉回流到肝脏,大部分胆汁酸可被肝脏一次性吸收,这些在肝脏中被重新吸收的胆汁酸对胆汁酸自身的合成起负反馈调节作用,同样也对胆固醇的分解代谢起负反馈调节作用[2,3]。因此,茶叶中相关物质与胆汁酸结合,从而阻碍胆汁酸的重吸收,有利于降低机体胆固醇水平。
六堡茶是广西梧州特有名茶。六堡茶是典型的黑茶之一,为国家地理标志保护产品,六堡茶因其独特的风味和良好的保健功能受到消费者的喜爱。有研究报道,黑茶中的功能性成分在肠道内影响脂类的消化和吸收,有效地降低大鼠总胆固醇(TC)、甘油三酯(TG)以及低密度脂蛋白胆固醇含量(LDL-C),同时能显著提高高密度脂蛋白胆固醇含量,达到降血脂的目的,其中六堡茶的效果特别明显[4,5]。然而现在关于六堡茶降脂作用的成分并不明确,因此,研究根据六堡茶的胆汁酸结合能力来讨论其降脂的功能成分值得探究,这对于六堡茶保健功能方面的发展与理论支撑具有重要意义。
绿茶属于无发酵茶,而黑茶属于后发酵茶。绿茶是现在被广泛证明具有较强胆汁酸结合能力的物质[6]。与绿茶相比,黑茶茶多酚总量下降,但在体内仍表现出较高的胆汁酸结合能力[7]。发酵过程使黑茶各指标均产生了变化,黑茶中的茶多酚、儿茶素、茶黄素、茶红素、氨基酸和可溶性糖的含量较发酵前的毛茶水平均大大降低;相反,茶褐素、多糖、不溶性多酚等含量明显增加[8,9]。后发酵过程还增加了黑茶中的咖啡因含量[10]。这些物质的含量的变化也导致了其胆汁酸结合能力的变化。
黄丽[11]通过小鼠体内模型证明了六堡茶提取物能显著降低血脂三项,其乙酸乙酯相和水萃余相活性进一步增强,都具有降低TC和TG,增加高密度脂蛋白胆固醇(HDL-C)的作用。吴正梅[12]通过模拟肠部消化,发现了在茶提取物中,绿茶、红茶、六堡毛茶和六堡成品茶的胆汁酸结合量为17.92%~43.55%,六堡成品茶在结合胆汁酸能力、抗氧化能力及酶活性上强于毛茶。由于六堡茶是典型的黑茶之一,经过发酵后其成分发生了显著的化学变化,六堡茶主要具有降低脂活性作用的物质是哪些值得进一步研究。但目前的研究没有从六堡茶整体上,获得不同极性部分,研究其胆汁酸结合能力大小,这对于六堡茶具有降脂产品的进一步提纯与开发是不利的。
本研究以六堡成品茶为研究对象,采用溶剂提取法获得有效活性部分,根据课题组前期对六堡茶中茶叶水提物的指纹图研究中确定的没食子酸(Gallic acid,GA)、没食子儿茶素(Gallocatechin,GC)、原儿茶素、原花青素、咖啡碱、EGCG、没食子基儿茶素没食子酸酯(Gallocatechin gallate,GCG)和ECG 8个共有峰的基础上[13],确定六堡茶具有胆汁酸结合能力的主要物质基础。以期为六堡茶后期活性物质的提取与功能性食品的开发提供进一步参考。
1 材料与方法
1.1 主要材料与试剂
六堡成品茶:由梧州中茶茶业有限公司提供。
标准品:GA,Gallic acid:没食子酸;GC,(-)-gallocatechin:没食子儿茶素; EGCG,(-)-epigallocatechin gallate:表没食子儿茶素没食子酸酯; GCG,(-)-Gallocatechin gallate:没食子儿茶素没食子酸酯;ECG,(-)-Epicatechin gallate:表儿茶素没食子酸酯;Caffeine:咖啡碱;Protocatechuic acid:原儿茶素;Procyanidin:原花青素;葡萄糖。以上标准品均购于北京北京盈泽纳新化工技术研究院。
其他试剂:乙二胺四乙酸(EDTA);乙酸乙酯;氯仿;无水乙醇;福林酚;碳酸钠;浓硫酸;苯酚;甘氨鹅胆酸;甘氨胆酸;甘氨脱氧胆酸;牛磺脱氧胆酸;牛磺鹅胆酸;磷酸缓冲液;考来烯胺;盐酸;氢氧化钠;胰酶,以上试剂均为分析纯,购于中国国药公司。超纯水(美国Millipore 超纯水机制备)。甲醇;乙腈;乙酸,以上试剂均为色谱纯级别,采购自美国Thremo fisher公司。
主要仪器与设备:5694高效液相色谱仪-2998二极管阵列检测器:配有Empower Pro数据处理系统,美国Waters公司。电热恒温水浴锅 HHS:上海博讯实业有限公司。分析天平AL204:梅特勒托利多仪器(上海)有限公司。
1.2 高效液相色谱检测条件
高效液相色谱条件:液相柱为安捷伦 ZORBAX Eclipse Plus C18柱(250 mm×4.6 mm,5 µm),柱温设定为35℃。流动相A:分别将90 mL乙腈,20 mL乙酸,2 mL EDTA-2Na溶液(20 mg/mL)加入1000 mL容量瓶中,用水定容至刻度,摇匀,过0.45 µm膜。流动相B:分别将800 mL乙腈,20 mL乙酸,2 mL EDTA-2Na溶液(20 mg/mL)加入1000 mL容量瓶中,用水定容至刻度,摇匀,过0.45 µm膜。流动相的流动速率为1 mL/min。流动相的梯度为:0 min~10 min,A:100%;10 min~20 min,A:100%~68%,B:0%~32%,保持10 min。30 min~50 min,A:100%,用于冲洗。二极管阵列检测器检测条件:检测波长设定为278 nm。
1.3 样品的制备
参考张名娥等[14]的方法进行制备。茶叶水提液:茶叶样品粉碎至40目颗粒大小。用天平称量20.00 g样品,加入200 mL蒸馏水,于沸水水浴浸提20 min,过滤,收集滤液。重复3次,合并滤液得到茶叶水提液。氯仿相:将茶叶水提液浓缩至200 mL左右并加入等体积氯仿进行萃取,重复操作至氯仿萃取相无色,收集合并氯仿萃取相并减压浓缩干燥得到氯仿相样品。乙酸乙酯相:将氯仿萃余相加入等体积的乙酸乙酯萃取,重复操作至乙酸乙酯萃取相恢复原来的色泽,收集合并乙酸乙酯萃取相并减压浓缩得到乙酸乙酯相样品。醇沉相:将乙酸乙酯萃余相继续加入三倍体积的无水乙醇醇沉,过滤,收集沉淀物,真空冷冻干燥得到醇沉相样品。水余相:将剩余醇沉相上清液浓缩冷冻干燥得水余相样品。各相回收率与提取率计算方式为:回收率=溶剂提取干物质重量/茶叶水提液干物质总量×100%;提取率=溶剂提取干物质重量/提取茶样质量×100%。
1.4 多酚含量测定
用不同浓度的没食子酸(10 µg/mL、20 µg/mL、30 µg/mL、40 µg/mL、50 µg/mL)所对应的吸光度构建标准曲线(y= 0.0092x+0.0216,R2= 0.9983)。准确称取0.10 g茶多酚样品于烧杯中,加入不超过60℃的蒸馏水25 mL左右,充分溶解后冷却定容至100 mL容量瓶中,即为1 mg/mL的母液,后续使用时稀释成不同浓度(10 µg/mL、20 µg/mL、30 µg/mL、40 µg/mL、50 µg/mL、60 µg/mL)。1 mL样品或标准品加入5 mL的10%福林酚试剂后,于3 min~8 min内加入4 mL 7.5%的碳酸钠溶液混匀,反应60 min后,于765 nm处测定吸光值。所有样品重复做三次平行试验。
并按下式求出茶多酚含量:
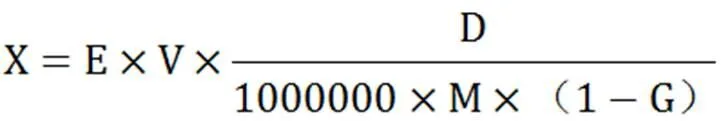
式中,X:多酚含量(%);E:根据试样测得的吸光度,从标准曲线上查得的没食子酸相应含量(µg/mL);V:样品溶液的体积(mL,本实验中为100 mL);D:测得吸光度前的稀释因子(本实验中稀释因子为20);M:样品质量(g);G:试样水分(%)。
1.5 多糖含量测定
参考王黎明等[15]的方法。称取20 mg、经105℃干燥至恒重的葡萄糖标准品, 定容至500 mL。配制成0.040 mg/mL 标准葡萄糖溶液。称取6 g苯酚溶于100 mL容量瓶中配成0.06 g/mL的苯酚溶液。准备24只20 mL试管分成3组,分别加入蒸馏水和葡萄糖溶液配置成为不同浓度的葡萄糖溶液(10 µg/mL、20 µg/mL、30 µg/mL、40 µg/mL、50 µg/mL、60 µg/mL),然后在每只试管中加入0.06 g/mL的苯酚溶液1 mL,将各试管摇匀后, 每试管中加入5 mL 98%浓硫酸,静置20 min后摇匀,40℃恒温水浴15 min。490 nm处测定OD值,制作标准曲线(如表3所示)。所有样品重复做三次平行试验。
1.6 结合胆汁酸能力实验
参考Kahlon等[16]的方法。胆汁酸混合液(36 mmol/L)由甘氨鹅胆酸(9 mmol/L)、甘氨胆酸(9 mmol/L)、甘氨脱氧胆酸(9 mmol/L)、牛磺脱氧胆酸(4.5 mmol/L)和牛磺鹅胆酸(4.5 mmol/L)组成,均用pH 6.8 的磷酸盐缓冲溶液进行配制,并于-20℃下储备,使用时稀释到0.72 mmol/L。
取5 mg样品或5 mg考来烯胺,加入1 mL 0.01 mol/L的盐酸溶液,在37℃下恒温振荡消化2 h。然后用0.02 mol/L的氢氧化钠溶液调节pH值到7~7.5,随后加入4 mL稀释过的胆汁酸混合工作液和5 mL 10 mg/mL胰酶(用pH6.8的磷酸缓冲液进行配制),继续在37℃下恒温振荡消化2小时后,在6000 r/min 转速下离心20 min。最后测定上清液中的胆酸盐的含量,即为未结合的胆汁酸含量。所有样品重复做三次平行试验。
1.7 数据分析
采用EXCEL2010、SPSS17.0、ORIGIN8.5软件对数据进行处理和绘制;采用Empower pro软件进行高效液相检测结果的分析和标曲的构建。
2 结果与分析
2.1 六堡成品茶各组分的提取与组成分析
表1可知,乙酸乙酯相以多酚为主、醇沉相以多糖为主。乙酸乙酯相中的酚类含量高达55.69%,醇沉相的多糖类含量高达47.07%,远远高于其六堡成品茶本身(六堡成品茶水提液的多酚多糖含量分别为17.87%和3.32%),本次溶剂萃取法相对于原提取液的总回收率约为85%,说明本研究采用的提取方法有较好的提取效果,可以用于后续分析与进一步实验。
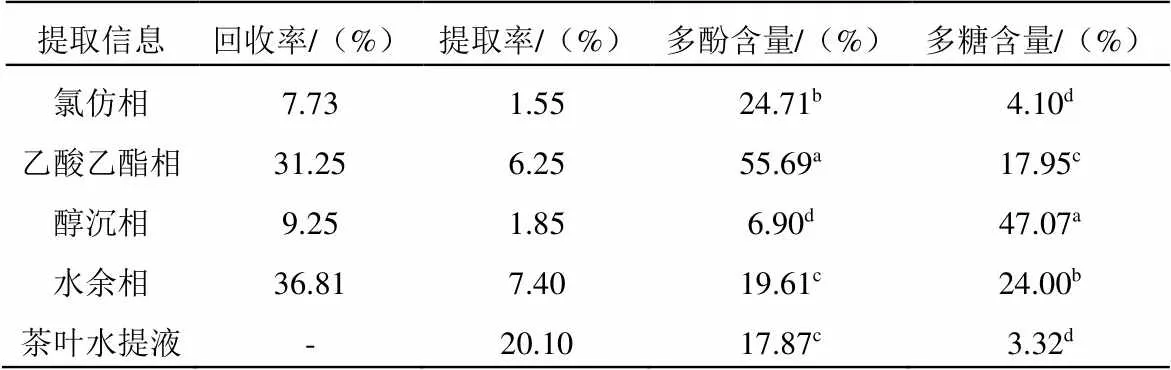
表1 六堡成品茶各组分提取与含量情况
注:a~d:表示同一列数据中的显著性差异(<0.05)
2.2 六堡成品茶各提取物的体外胆汁酸结合能力
表2中可以看出茶叶水提液的胆汁酸结合能力为27.15%,而表中除了作为标准对照的考来烯胺外,具有最高胆汁酸结合能力是六堡茶乙酸乙酯相,它的胆汁酸结合能力为68.77%,说明所采用的溶剂提取法能够将有效部分较好的提取出来。就胆汁酸结合能力的强弱比较:乙酸乙酯相>茶叶水提液>水余相>醇沉相>氯仿相。
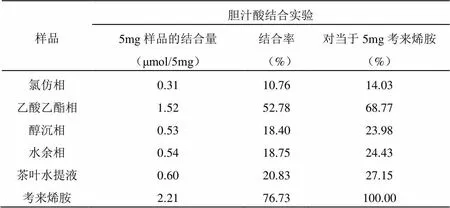
表2 六堡成品茶各提取物的体外的胆汁酸结合能力
注:胆汁酸结合率(%)=5 mg样品的结合量/空白对照中胆汁酸含量
2.3 标准曲线的构建与不同样品中特征物质含量的分析
利用高效液相法对不同浓度的GA、GC、原儿茶素、原花青素、咖啡碱、EGCG、GCG与ECG的单标进行测定,构建了峰面积与含量的标准曲线。利用吸光光度法对不同浓度的多酚与多糖进行测定,构建了吸光度值与含量的标准曲线。其标准曲线与R2值如表3所示。可以看出这10种成分的标准曲线R2值均大于0.99,说明具有良好的线性关系,可以用于后续实验的含量分析。
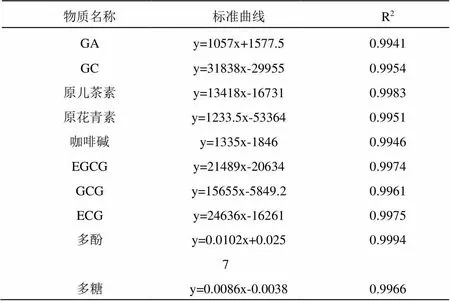
表3 特征物质、多酚与多糖的标准曲线的构建
为了进一步了解各相中的特征物质含量,分别取六堡茶氯仿相、乙酸乙酯相、醇沉相和水余相样品进行高效液相色谱检测。得到的结果如图1与表4所示,图1中可以看出各峰的分离度良好,基线较平稳,符合分析要求。从表4中可以发现,各相化学物质的组成与含量差别均较大。乙酸乙酯相与水余相的化学物质比其余相更加丰富,且乙酸乙酯相的总体含量水平明显高于水余相;六堡茶氯仿相中以咖啡碱和GA为主;醇沉相中几乎没有六堡茶特征化学物质的存在。
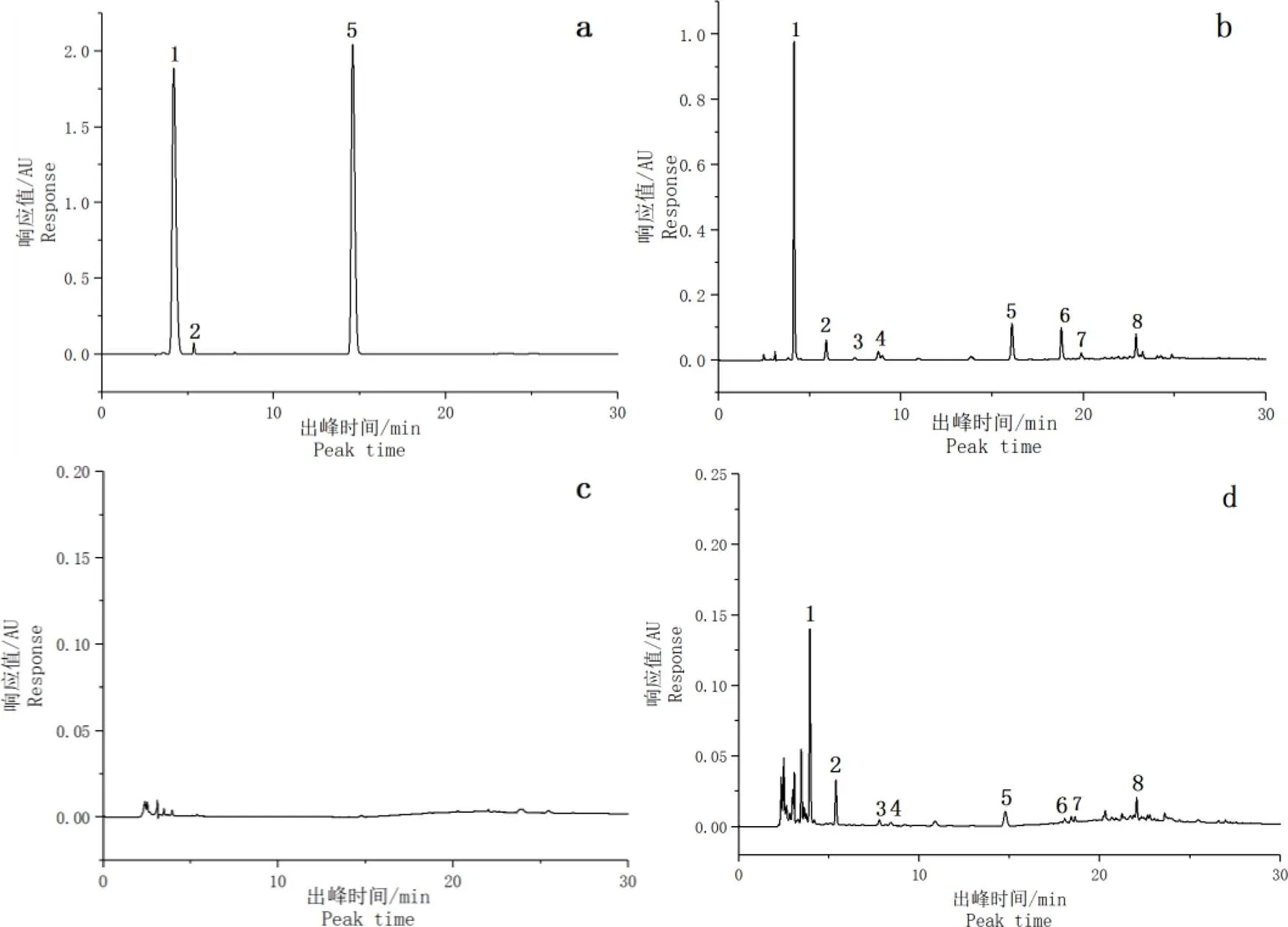
图注:a:氯仿相,b:乙酸乙酯相,c:醇沉相,d:水余相;1:GA,2:GC,3:原儿茶素,4:原花青素,5:咖啡碱,6:EGCG,7:GCG,8:ECG
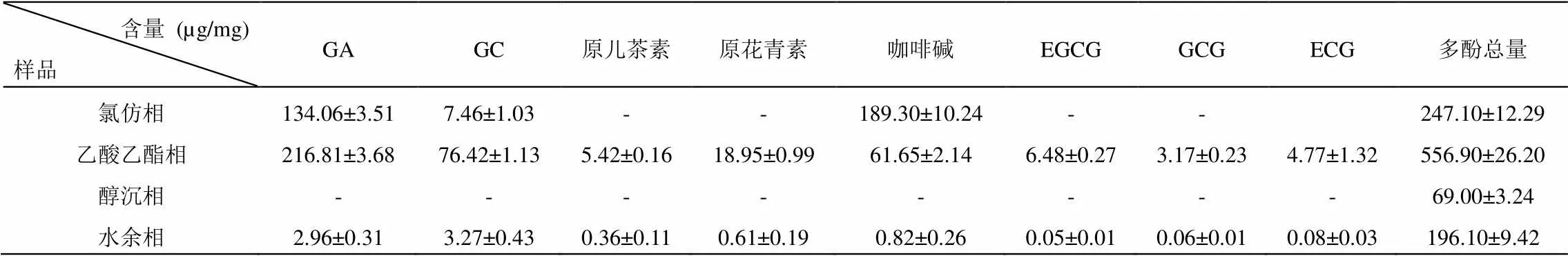
表4 六堡成品茶氯仿相、乙酸乙酯相、醇沉相和水余相的特征物质含量
注:-,表示在高效液相色谱检测条件下没有检出或低于检出限。
2.4 特征物质含量与胆汁酸结合能力之间的相关关系
由表5可知,GA、EGCG、GCG、ECG为胆汁酸结合能力较强的共同物质,相关系数均在0.90以上,特别是GCG(相关系数0.945)与EGCG(相关系数0.936)具有显著相关性。在这当中,仅有GA为非酯型儿茶素。总多酚与胆汁酸结合能力的相关性为0.917,证明总多酚含量与胆汁酸结合具有显著相关性。此外,结合表2中的结果可以看出氯仿相、醇沉相和水余相也具有一定的胆汁酸结合能力。且乙醇相与水余相的胆汁酸结合能力比氯仿相更强,可能是因为乙醇相和水余相中含有较强胆汁酸结合能力的EGCG、GCG与ECG。而氯仿相的胆汁酸结合能力可能主要依赖于GA的存在。

表5 六堡成品茶中特征物质含量与胆汁酸结合能力之间的相关关系
注:*,在0.05 水平(双侧)上显著相关。
3 讨论
六堡茶具有独特的渥堆发酵工艺,因其优良的风味和功效受到消费者喜爱,降脂作用是六堡茶具有的重要功能之一。已有的报道中,kahlon[16]采用类似的方法,研究了多种水果的胆汁酸结合能力,结果发现包括苹果、菠萝等多种水果在内的胆汁酸结合率在1%~7%之间,而茶叶的胆汁酸结合率可达到20.55%~36.5%。说明茶叶具有较高的降血脂开发价值,是潜在的保健食品。为了研究茶叶具有结合胆汁酸能力的主要成分物质,首先,采用溶剂提取法尽可能多的获得有效活性成分。一般在茶叶提取物中,氯仿相主要含有咖啡碱等,乙酸乙酯相主要为多酚类等物质,醇沉相主要是多糖类等物质,水余相为极性类酚类等。通过各相提取的酚类和多糖的数据,也可以看出六堡茶各个部分提取的效果良好,满足后续实验的需要。
绿茶是具有较强的胆汁酸结合能力并且现在被广泛研究的茶叶种类,六堡毛茶是未经过渥堆发酵的茶叶,它们常与六堡成品茶一起进行比较。在胆汁酸结合能力方面,Wu[7]的研究发现水提物的胆汁酸结合能力为绿茶(45.83%)>六堡成品茶(26.03%)>六堡毛茶(18.86%);Qin[9]研究了六堡成品茶水提物体外结合胆汁酸的能力为26.05%,与本研究对成品茶水提液的胆汁酸结合的数据结果(27.15%)相近。在多酚与多糖的含量方面,六堡毛茶的多酚含量为28.41%[17],多糖含量为0.88%[18];绿茶的多酚含量为27.52%~29.62%[19],多糖含量1.62%~4.34%[20],且绝大多数被测样品的多糖含量在3%以下。本研究所测得的六堡成品茶中多酚含量为17.87%,多糖含量为3.32%。综上,多酚含量:绿茶≈六堡毛茶>六堡成品茶;多糖含量:六堡成品茶≥绿茶>六堡毛茶。相似的,分析本研究中不同提取相的胆汁酸结合能力与多酚多糖的含量可以发现:胆汁酸结合能力:乙酸乙酯相>茶叶水提液>水余相>醇沉相>氯仿相;多酚含量:乙酸乙酯相>氯仿相>水余相>茶叶水提液>醇沉相;多糖含量:醇沉相>水余相>乙酸乙酯相>氯仿相>茶叶水提液。结合绿茶、六堡毛茶、六堡成品茶与六堡成品茶各相的胆汁酸结合能力与多酚多糖的含量不同,可以推测,多糖含量与胆汁酸结合能力的相关性不高;多酚含量与胆汁酸结合能力更相关,多酚含量越高往往也有更高的胆汁酸结合能力,但这不是绝对的,还与多酚的具体组成有关。因此,本研究将六堡茶中的特征物质作为活性成分研究的主要对象,并参考林小珊[13]针对六堡茶中的特征等物质的研究确定了具体物质。
通过对各相的主要特征物质的含量检测结果可以发现,六堡茶乙酸乙酯相与水余相的多酚含量、种类丰富程度和胆汁酸结合率明显高于其他相。可以说明丰富的多酚的确具有较强的胆汁酸结合能力,多名学者的研究也证明了这一点[21,22]。但是本次研究也发现,多酚含量较高的氯仿相胆汁酸结合能力却最低,这与其含有的主要成分有关。氯仿相中含有的多酚类物质只有GA与GC,它们都属于非酯型儿茶素类物质。而已有的研究表明,酯型儿茶素(EGCG、GCG、ECG)具有更强的胆汁酸结合能力[23,24],本研究的最终相关性分析的结果也证明了酯型儿茶素(EGCG、GCG、ECG)具有较强的胆汁酸结合能力。此外,本次研究发现GA虽然属于非酯型儿茶素类物质,但相关性分析表明与胆汁酸结合能力中具有显著正相关性。Craig[25]认为绿茶中的GA可能通过减少胆固醇吸收而起到降血脂的作用。Kirana[26]研究中发现,GA也能有效降低胆固醇的胶束溶解度,表明GA部分也是决定胆固醇吸收活性的关键。因此,在胆汁酸结合能力的大小还应对非酯型儿茶素进行进一步研究。
Mao[27]采用高脂血症大鼠的动物模型发现六堡茶多糖具有明显的辅助降血脂作用,发现六堡茶多糖可以明显降低高脂饮食大鼠的TC、TG和LDL-C,但对高密度脂蛋白胆固醇(HDL-C)无显著影响;而且可以不通过改变动物的摄食量、粪便排泄量来影响大鼠体重水平。Qin[9]比较了发酵前后六堡毛茶和成品茶多糖与它们精制后的多糖组分的组成、结构、功能的差异性,结果发现经过发酵后,六堡毛茶多糖的抗凝血能力活性显著优于成品茶多糖,但胆汁酸结合能力二者相当。本实验也发现醇沉相多糖含量最高(47.07%),多酚含量最低(6.90%)且不含有测定的特征物质,但仍旧具有与水提液体相当的胆汁酸结合能力,说明多糖的确具有一定的辅助降血脂作用。
在本研究中,初步找出了在六堡茶中具有胆汁酸结合能力的主要物质,但是研究仅对六堡茶中的特征化学成分进行了测定;六堡茶中还有大量其他的特征成分,还需要进一步的探究。本研究得出的结论对于六堡茶产品保健功能的证明与六堡茶产业的健康积极发展具有一定的促进意义。
4 结论
以课题组利用指纹图谱技术确定的六堡茶中的特征物质作为基础,研究了不同溶剂部分胆汁酸结合能力。证明所采用的溶剂提取法能够富集活性成分,并通过分析胆汁酸结合能力与特征物质及多糖、多酚的相关性关系,发现除酯型儿茶素外,GA、总酚含量也具有较好的胆汁酸结合能力,多糖也有一定的结合胆汁酸能力。可以推断,六堡茶中具有结合胆汁酸能力的主要为酚类成分,多糖等其它物质具有一定协同作用。
[1]刘笑,王琰. 胆汁酸的合成调控及其在生理与病理中的功能机制[J]. 遗传,2019,41(5): 365-374.
[2]温芳,姚映芷,张晓东. 从胆汁酸肝肠循环角度探讨中药降血脂的机理[J]. 时珍国医国药,2018,29(11): 2718-2720.
[3]贾昊宇,杨长青. 胆汁酸的肝肠循环及肠道微生态在胆汁淤积性肝病发病和治疗中的作用[J]. 临床肝胆病杂志,2009,35(2): 270-274.
[4]张名位. 黑米抗氧化与降血脂的活性成分及其作用机理[D]. 广州: 华南师范大学,2003.
[5]He Z P, Wu Z M. Extraction and separation of tea effective ingredients[J]. Soft Computing in Information Communication Technology, 2012, 158: 373-379.
[6]王玉洁,葛建,杨斌英,等. 儿茶素EGCG对胆汁酸的结合及调控脂质代谢研究[J]. 食品科技,2016,41(2): 227-232.
[7]Wu Z, Teng J, Li H, et al. Stability, antioxidant activity and in vitro bile acid-binding of green, black and dark tea polyphenols during simulated in vitro gastrointestinal digestion[J]. RSC Advances, 2015, 5: 92089-92095.
[8]Luo L, Wu X, Deng Y, et al. Variations of main biochemical components and their relations to quality formation during pile-fermentation process of Yunnan puer tea[J]. Journal of Tea Science, 1998, 18(1): 53-60.
[9]Qin H A,Huang L, Teng J W, et al. Purification, characterization, and bioactivity of Liupao tea polysaccharides before and after fermentation[J]. Food Chemistry, 2021, 353: 129419.
[10] 田洋,肖蓉,徐昆龙,等. 普洱茶加工过程中主要成分变化及相关性研究[J]. 食品科学,2010,31(11): 20-24.
[11] 黄丽,彭静静,夏宁,等. 六堡茶调节高血脂症与抗凝血的功能特性研究[J]. 食品科技,2013,38(8): 123-128.
[12] 吴正梅. 六堡茶调节脂类代谢及抗氧化活性研究[D]. 南宁: 广西大学,2016.
[13] 林小珊,黄丽,夏宁,等. 六堡茶酚类物质的分析鉴定及指纹图谱研究[J]. 轻工科技,2019,35(6): 8-11,18.
[14] 张名娥,杨乔中,陈兴荣. 茶叶有效成分的综合提取分离实验研究[J]. 大理学院学报,2009,8(2): 19-20.
[15] 王黎明,夏文水. 水法提取茶多糖工艺条件优化[J]. 食品科学,2005,26(5): 171-174.
[16] Kahlon T S, Smith G E. In vitro binding of bile acids by blueberries (Vaccinium spp.), plums (Prunus spp.), prunes (Prunus spp.), strawberries (Fragaria X ananassa), cherries (Malpighia punicifolia), cranberries (Vaccinium macrocarpon) and apples (Malus sylvestris)[J]. Food Chemistry, 2007, 100(3): 1182-1187.
[17] 尹世磊,赵谋明,滕建文,等. 六堡茶在体外模拟胃肠道消化过程中的成分变化与抗氧化活性变化[J]. 现代食品科技,2017,33(8): 88-94.
[18] Chen X Q, Zhang Z F, Gao Z M, et al. Physicochemical properties and cell-based bioactivity of Pu’erh tea polysaccharide conjugates[J]. International Journal of Biological Macromolecules, 2017, 104(A): 1294-1301.
[19] 陈磊. 不同种类茶叶中茶多酚含量的测定和分析[J]. 食品安全导刊,2021(25): 71,73.
[20] 刘晶晶,江丹,陈搏,等. 不同产地绿茶主要成分含量及质量指标的差异分析[J]. 农产品加工,2021(4): 50-53.
[21] 姜红波,赵卫星,温普红. 天然抗氧化剂———茶多酚的应用[J]. 应用化工,2010,39(10): 1578-1580.
[22] 张均伟,侯粲,杜昱光,等. 基于高分辨质谱结合主成分分析技术评价发酵过程对六堡茶关键品质成分的影响[J]. 食品科技,2019(12): 7.
[23] Am L D L, Giménez B, Pérezsantín E, et al. Bioaccessibility of green tea polyphenols incorporated into an edible agar film during simulated human digestion[J]. Food Research International, 2012, 48(2): 462-469.
[24] 邓志汇. 液氮提取茶鲜叶的茶多酚及其降血脂研究[D]. 广州: 华南理工大学,2012.
[25] Craig W J. Health-promoting properties of common herbs[J]. The American Journal of Clinical Nutrition, 1999, 70(3): 491-499.
[26] Kirana C, Rogers P F, Bennett L E, et al. Naturally derived micelles for rapid in vitro screening of potential cholesterol lowering bioactives[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 4623-4627.
[27] Mao Y, We B Y, Teng J W, et al. Polysaccharides from Chinese Liupao dark tea and their protective effect against hyperlipidemia[J]. International Journal of Food Science and Technology, 2017, 53(3): 599-607.
Study on Chemical Constituents with Bile Acid Binding Ability in Liupao Tea
Liupao finished tea was used as raw material, the different polar parts were extracted by solvent extraction, the bile acid binding ability was tested, and the main chemical components were determined by high performance liquid chromatography. Finally, the main chemical components with bile acid binding ability were found by correlation analysis. Through the correlation analysis between bile acid binding ability and characteristic substances, polyphenols and polysaccharide content, it was found that phenols had the ability to bind bile acids in Liupao tea. In addition to ester catechins, the content of gallic acid(GA) and total phenols also has a strong correlation relationship with the binding ability of bile acids, and polysaccharides also had a certain ability to bind bile acids.
Liupao tea; bile acid binding capacity; lipid-lowering; phenolic compounds
TS27; TS201
A
1008-1151(2022)02-0040-05
2021-12-19
国家自然基金项目(32160571)。
陈欢(1997-),女,广西大学在读硕士研究生,从事六堡茶微生物安全与功能成分的研究。
