LiCl-KCl-LaCl3熔盐体系中La3+的反应动力学机理
2022-04-28刘雅兰杨大伟姜仕林赵修良
罗 万,刘雅兰,杨大伟,姜仕林,赵修良,*
1.南华大学 核科学技术学院,湖南 衡阳 421000;2.中国科学院 高能物理研究所 核能与放射化学实验室,北京 100049
核能是一种高效清洁的能源形式,随着核能的广泛应用,将会产生更多的乏燃料,而乏燃料后处理则是实现核燃料闭式循环中重中之重的关键环节。高温冶金干法后处理技术(pyroprocessing technology)是处理乏燃料的一种有前途的技术,它能实现核燃料闭式循环,满足核能可持续发展的基本要求,因此,得到了世界上核能强国的大力发展[1]。
熔盐电解精炼是高温冶金干法后处理技术的关键步骤。这个过程采用LiCl-KCl熔盐/液态金属为媒介,首先将切碎的金属乏燃料段置于多孔钢阳极篮中,然后施加一定的电流将乏燃料中的锕系元素及其它裂变产物从阳极篮中溶解。接下来,大多数的铀(U)在固态电极上回收,而剩余的U、超铀元素(TRU)及稀土元素(RE)则沉积在液态Cd阴极中,其他的裂变产物则依据其氯化物的稳定性分布在盐相和Cd相之间[2]。乏燃料中含有多种裂变产物,当它们溶解在熔盐中时会使系统更加复杂且难于分离。稀土元素是重要的裂变产物,约占裂变产物的 1/4,并且与锕系元素的电化学性质相似[3]。因此,了解这些裂变产物在熔盐中的电化学、热力学和动力学性质对于熔盐电解精炼流程中实际电解分离镧系/锕系元素具有重要意义。
镧是一种裂变轻稀土元素,其化学性质与其他镧系元素相似。已有相关工作研究了LiCl-KCl熔盐中La3+在W电极上的电化学性质,结果表明La3+在W电极上的还原过程为一步转移3个电子的准可逆过程[4-6]。而本课题组还研究了La3+在活性Al、液态Ga和Bi电极上的热力学性质 (活度、扩散系数、表观标准电位等)[7-8]。另外,Tang等[9]采用计时电流法判断了La3+在W电极上的成核机制为瞬时成核,并通过扫描电子显微镜(SEM)观察了La的沉积形貌。这些重要的热力学性质为进一步研究锕系元素提供了一定参考,同时也为研究其他镧系和锕系元素在固态电极上的沉积机制奠定了基础。关于La3+的基本电化学性质及热力学性质研究得较多,而动力学性质却研究得较少。
动力学描述的是粒子在电极/溶液界面的交换速率,而交换电流密度和反应速率常数是基本的动力学参数,对于实际电解分离镧系/锕系元素及动力学模型的建立具有重要意义。电化学阻抗谱(EIS)是一种研究反应动力学的有效方法,被广泛应用于电池、电沉积、材料腐蚀与防护等方面[10-13],而将其用于熔盐电解精炼中研究裂变产物的动力学性质在国内还鲜有报道。因此,本工作拟选取La3+为研究对象,通过循环伏安法研究La3+在W电极上的电化学性质,并计算扩散系数及扩散活化能。另外,拟通过电化学阻抗谱模拟等效电路来研究La3+在W电极上的动力学机理,并计算La3+在W电极上的交换电流密度及反应速率常数等动力学参数。
1 实验部分
1.1 试剂与仪器
LiCl(纯度为97.0%)、KCl(纯度为99.5%)和无水氯化镧(纯度为99.5%),北京伊诺凯科技有限公司;高纯Ar(纯度为99.999%),北京北氧联合气体有限公司;钨丝(φ1 mm,纯度为99.9%)、石墨棒(φ6 mm,光谱纯)、钼丝(纯度为99.9%),北京恒远卓立科技发展有限公司;铋(纯度为99.99%),国药集团化学试剂有限公司;锂(纯度为99.9%),Sigma-Aldrich 西格玛奥德里奇(上海)贸易有限公司;刚玉坩埚、刚玉管,唐山市宝田工业瓷厂;氮化硼,福州赛瑞特新材料技术开发有限公司。
HG1500/750TS手套箱,Vigor公司;Autolab PGSTAT 302 N电化学工作站,Metrohm公司;电感耦合等离子体发射光谱仪(ICP-OES),HORIBA公司。
在纯氩气环境的手套箱中完成LiCl-KCl-LaCl3熔体的制备和所有的电化学实验。手套箱内配备一个由可编程温度控制器控制的高温电阻炉(GR2-270)以满足实验的高温要求,实验温差控制在±5 K。在Autolab PGSTAT 302 N电化学工作站内进行电化学测试,如图1所示,实验选用三电极体系,其中钨丝为工作电极(WE),石墨棒为对电极(CE),Li/Li3Bi合金为参比电极(RE)[14]。
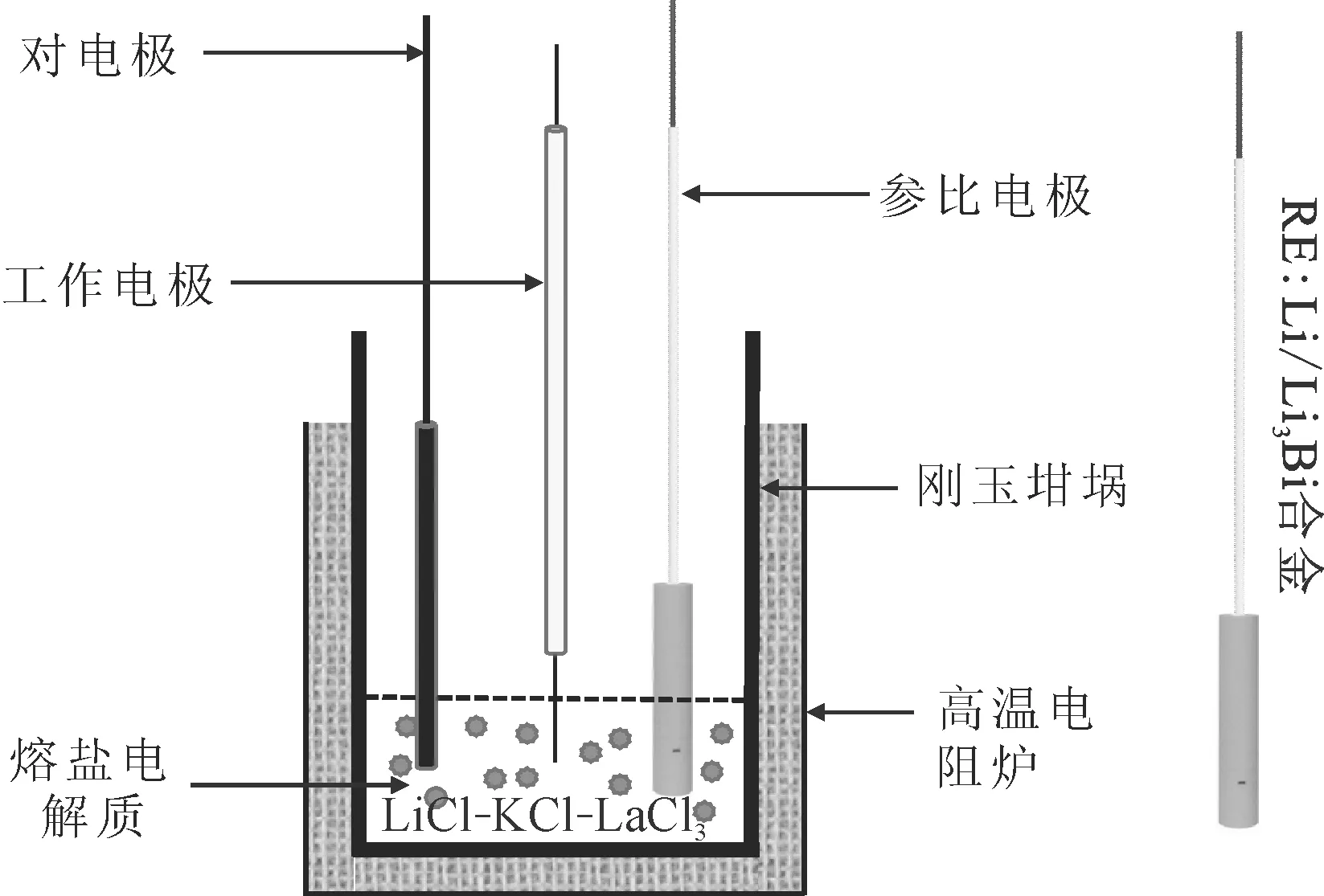
图1 电解池的实验装置Fig.1 Apparatus of electrochemical cell
1.2 实验方法
称取LiCl-KCl(44.2%(质量分数,下同)LiCl-55.8%KCl)混合盐(60 g)放入热解石墨坩埚中,然后移入真空干燥箱中去除水分。在423 K下干燥24 h后将混合盐倒入刚玉坩埚中于773 K下熔化,恒温72 h进一步除去残留的水氧。称取0.6 g LaCl3加入LiCl-KCl共晶盐,充分搅拌熔化至底部无沉淀后插入电极并设置电位-0.4 V(vs. Li/Li3Bi) 恒电位电解6 h以除去杂质金属离子。利用ICP-OES确定共晶盐中La3+的真实浓度。选取循环伏安法(CV)、开路计时电位法(OCP)研究La3+在熔盐中的电化学行为及扩散性质;采用电化学阻抗谱法(EIS)研究La3+在W电极上的反应动力学机理。
2 结果与讨论
2.1 W电极上La3+的还原过程及可逆性
图2为773 K时两个熔盐体系在W电极上的CV曲线。虚线为纯LiCl-KCl熔盐在W电极上的CV曲线,其中峰A、A′出现在-0.7 V附近,分别对应Li金属的析出和溶解[14]。实线为LaCl3(质量分数1%)加入LiCl-KCl熔盐后的CV曲线,其中峰B、B′分别是La3+在W电极上的析出与溶解[7]。
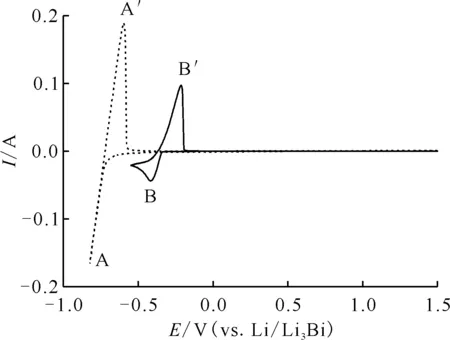
T=773 K,扫描速率v=100 mV/s,电极面积S=0.47 cm2… ——LiCl-KCl,— ——LiCl-KCl-1%LaCl3图2 纯LiCl-KCl与LiCl-KCl-1%LaCl3在W电极上的CV曲线Fig.2 Comparison of cyclic voltammograms for pure LiCl-KCl melt and LiCl-KCl-1%LaCl3melt on W electrode

T=773 K,S=0.47 cm2(a)——峰电位随扫描速率变化,(b)——峰B的峰值电流密度(ip)与扫描速率平方根(v1/2)的关系图3 LiCl-KCl-1%LaCl3在W电极上不同扫描速率下的CV曲线Fig.3 CV curves on W electrode of LiCl-KCl-1%LaCl3 with different scan rates
图3为773 K时不同扫描速率下的CV曲线。从图3可以看到,随着扫描速率(v)的增加,峰B、B′的峰电位向负轻微移动且峰值电流变大,这表明La3+在W电极上的还原过程除了受扩散控制外还可能受电荷转移控制。图3中插图(a)为峰值电位(Ep)随扫描速率(v)的变化。根据文献报道,在准可逆反应中阴极峰值电流密度(ip)与扫描速率的平方根(v1/2)为非线性关系[9];而可逆反应或不可逆反应中ip与v1/2呈线性关系[15]。从图3中插图(b)可知,v=50~300 mV/s时ip与v1/2为非线性关系,因此在此扫描速率范围内La3+在W电极上的还原过程是准可逆过程,此结果与Tang等[9]的报道吻合。
2.2 氯盐中La3+的动力学过程
La3+在LiCl-KCl中的动力学过程主要受扩散控制和电化学反应控制,其反应动力学过程示意图示于图4。如图4所示,扩散控制是La3+在电解质中受到电场力及浓度差异的影响迁移至阴极附近;电化学反应控制是La3+在电极表面得到电子还原为La金属并沉积在电极上。
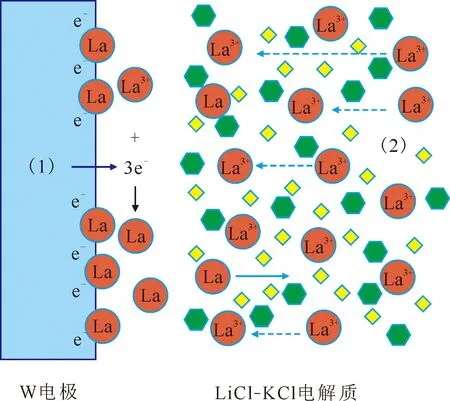
图4 La3+的反应动力学过程示意图Fig.4 Schematic diagram of reaction kinetics process of La3+
图5为723~873 K范围内La3+在W电极上的CV曲线。从图5可以看到,随着温度升高La3+的沉积电位正移,峰值电流的绝对值增大。温度对La3+电化学性质的影响在前期工作中已有报道[16]。
对于一个可溶-不可溶的反应,扩散系数D可由Berzis-Delahay方程[17]计算:
ip=0.611nFSc0(nFvD/RT)1/2
(1)
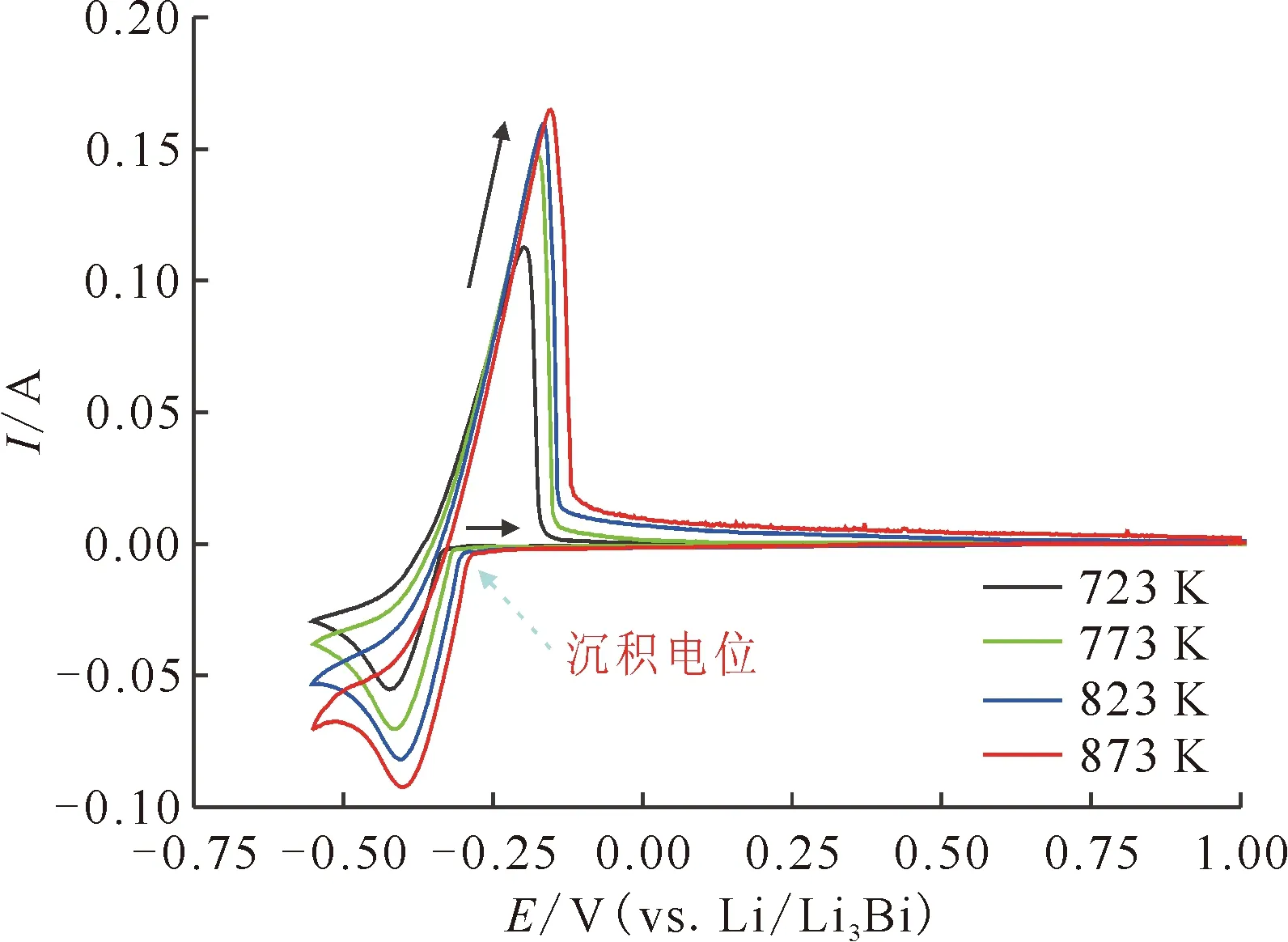
v=100 mV/s,S=0.47 cm2图5 不同温度时LiCl-KCl-1%LaCl3熔盐体系在W电极上的循环伏安曲线Fig.5 Cyclic curves on W electrode of LiCl-KCl-1%LaCl3 system at different temperatures
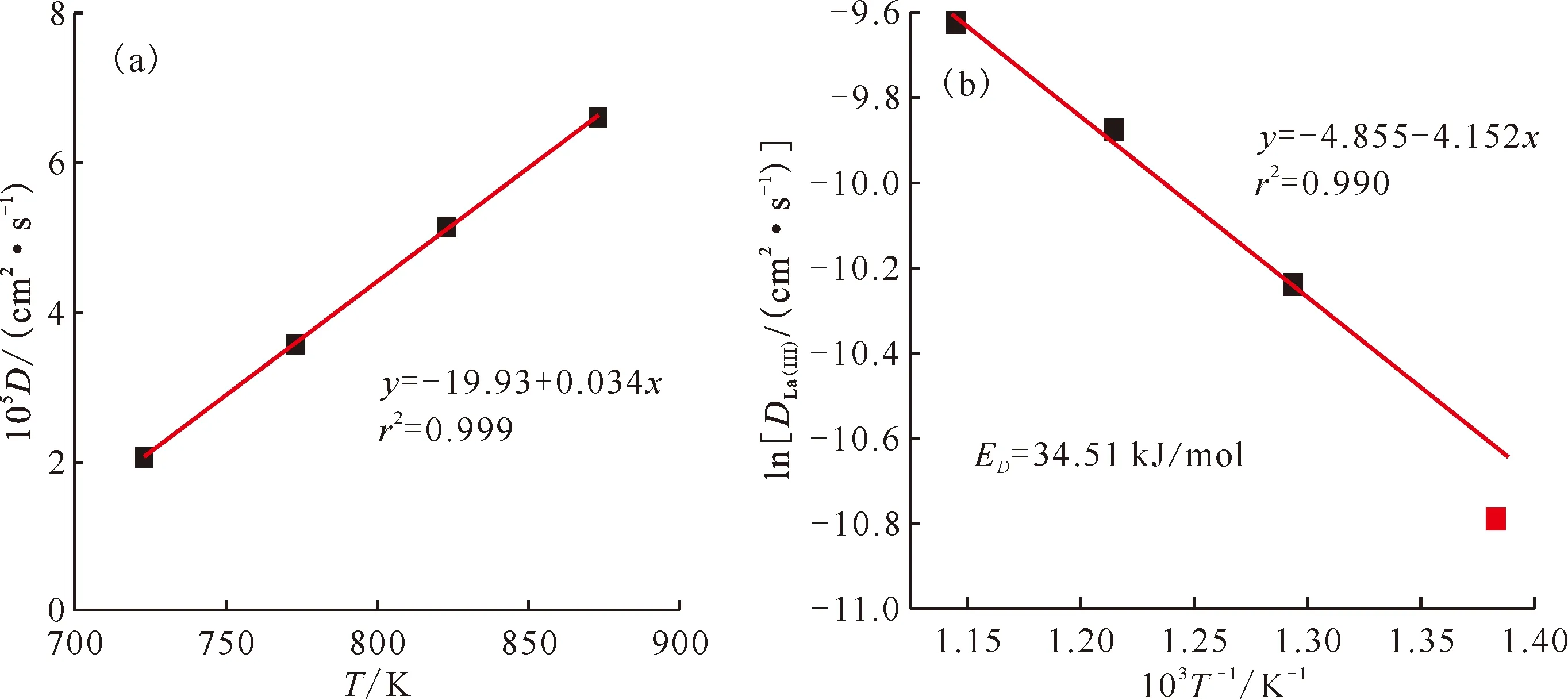
图6 扩散系数随温度的变化(a)及阿伦尼乌斯图(b)Fig.6 Variation of diffusion coefficient with temperature(a), and Arrhenius plots(b)
3 电极表面La3+的反应动力学
3.1 交换电流密度及反应速率常数
利用电化学阻抗谱(EIS)研究LiCl-KCl中La3+在W电极上的反应动力学机理并计算交换电流密度i0和反应速率常数k0。在EIS测试之前需要利用开路计时电位法确定La3+/La电对在W电极上的平衡电位。通过在W电极上施加一个-0.6 V的电位,恒电位沉积30 s将La3+沉积到电极上后断开电位并记录此时电位随时间的变化(图7(a)),当电位平台趋于稳定时的电位即为La3+/La电对在W电极上的平衡电位。图7(b)显示了平衡电位(Ee)与温度的关系。根据能斯特方程,平衡电位受温度的影响,温度越大平衡电位越正。
EIS测试只会在电极表面引起极其微小的扰动,可以避免在电极附近产生严重的浓差极化并减小电极表面状态变化的不确定性[20],这一特性使得 EIS技术较其他方法在测量动力学参数上更具优势。EIS测试的振幅设置为10 mV、频率为0.01~10 000 Hz,并在平衡电位1~5 mV范围内设置电位进行多次测试。记录重现性良好的EIS数据并根据Nyquist图拟合得到电化学电池的等效电路图。
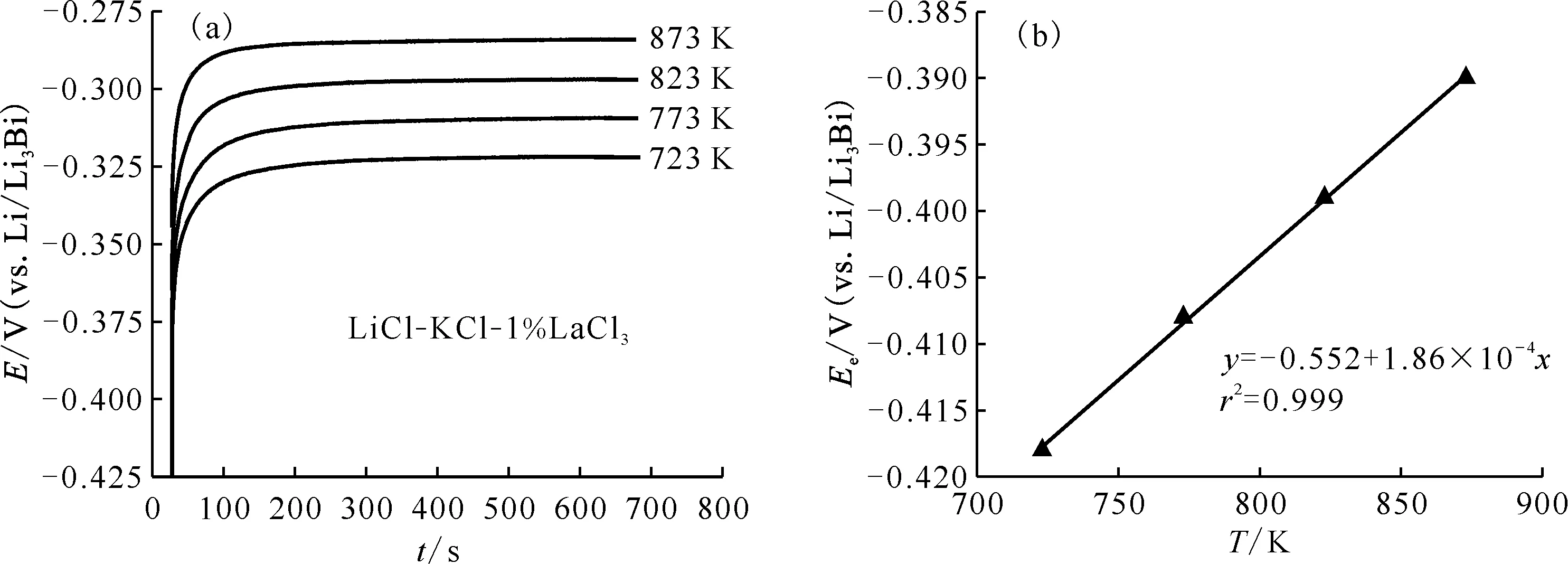
T=723~873 K图7 不同温度下La3+/La电对在W电极上的电位(a)及平衡电位随温度的变化(b)Fig.7 Potential of La3+/La couple on W electrode at various temperatures(a), and variation of equilibrium potential with temperature(b)
Nyquist图记录了在不同频率时的实部阻抗Z′和虚部阻抗Z″数据,结果示于图8。如图8所示,Nyquist图是由高频区的一个半圆和低频区的一条45度直线构成,表明La3+/La电对的电极过程是由电荷传递和扩散共同控制[21]。从图8可以看到,Nyquist图在高频区的半圆弧偏离了标准半圆轨迹,表现为一个压扁的半圆弧,这种现象称为“弥散效应”[21]。这种“弥散效应”可能是由电极表面粗糙、各点电化学活性不同及电场不均匀等因素引起的。因此,在拟合等效电路时需引入一个常相角元件(CPE)来描述产生的“弥散效应”,并通过CPE中常数n的取值来反映双电层偏离理想电容的情况。
根据重现性良好的Nyquist图拟合并得到不同温度时的等效电路图,结果示于图9。
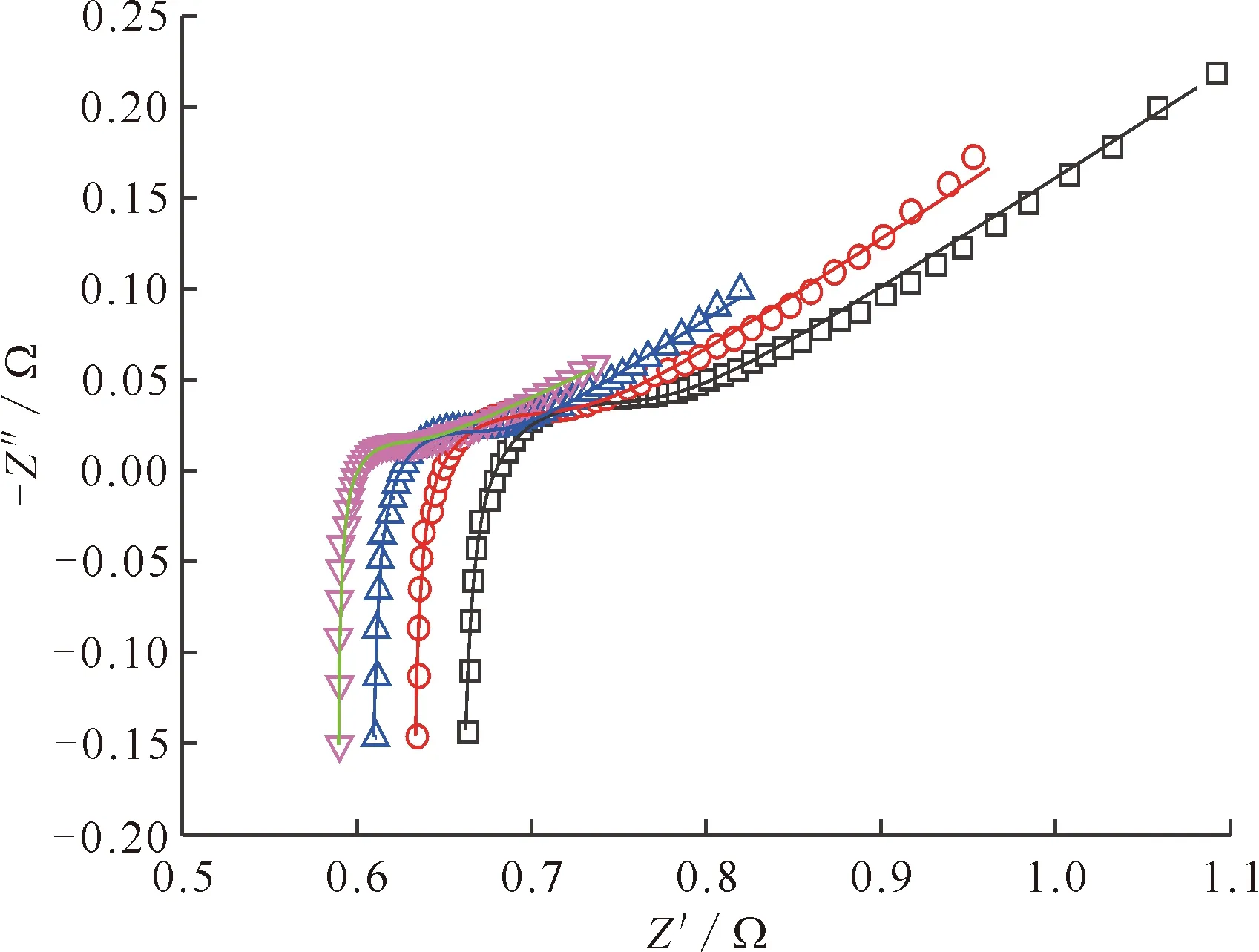
实线为拟合曲线□——723 K,○——773 K,△——823 K,▽——873 K图8 W电极上测量并拟合的LiCl-KCl-1%LaCl3熔盐体系的阻抗谱Fig.8 Measured and fitted impedance spectra in LiCl-KCl-1%LaCl3 melt on W electrode

图9 W电极上LiCl-KCl-1%LaCl3熔盐体系电化学电池的等效电路图Fig.9 Equivalent circuit diagram of electrochemical cell with LiCl-KCl-1%LaCl3 melt on W electrode
在等效电路中Y0表示常相角元件(CPE)的导纳,定义如下:
(2)
式中:YQ是一个包含扩散系数的常数;ω=2πf,f是频率;n为取值在-1到1之间的常数;j为虚部。当n=0时,此CPE代表一个电阻R=1/YQ的电阻;当n=1时,此CPE代表一个电容C=YQ的电容;当n=-1时,此CPE代表一个电感L=1/YQ的电感器;当n=0.5时,CPE可解释为与扩散相关的Warburg阻抗[21]。等效电路中的Rp代表电荷转移电阻,Rs代表电解质的溶液电阻。在与Rp串联的CPE中,n(等效电路中的N)的测量值在0.3~0.5之间,考虑到“弥散效应”的存在,这里n值取为0.5,所以此CPE代表Warburg阻抗;在与Rp并联的CPE中,n的测量值在0.6~1之间,这里取n值为1,所以此CPE表示双电层电容[22]。对比四个温度时的Rs,发现随温度的增大溶液电阻Rs变小,这是由于温度增大使熔盐的密度有所减小所致。等效电路图中L是电感元件,表示因测量系统接触不良、RE反应缓慢及恒电位仪工作不理想等引起的电感。
利用电荷转移电阻Rp值计算La3+/La电对的交换电流密度i0(A/cm2)和反应速率常数k0(cm/s)[23]:
(3)
式中:α是传递系数;S是电极面积,0.47 cm2;c0为La3+浓度,6.67×10-5mol/cm3。通过上文的CV数据发现La3+在电极上的还原反应是一个具有微弱扩散效应的可逆过程(低扫描速率时),所以α可取值为0.5[20]。由式(3)计算得到的反应速率常数k0和交换电流密度i0列于表1。
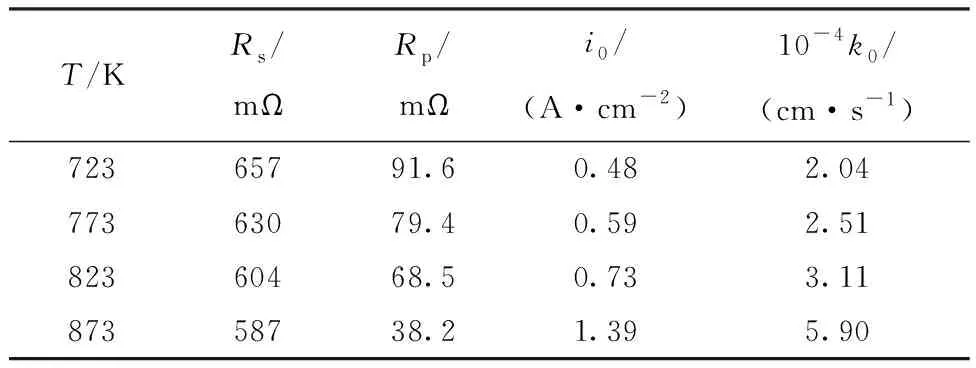
表1 不同温度下的Nyquist数据和动力学参数Table 1 Nyquist data and kinetic parameters at different temperatures
表1中La3+/La电对的i0和k0值略大于Guo等[24]的计算结果,这可能是因为Guo等[24]采用Tafel法和线性极化法(LP)来测试动力学参数。这两种方法受传质的影响较大从而造成动力学参数计算值略小,虽然应用非简化动力学方程计算动力学参数可以减小传质效应带来的误差,但是电化学测量技术的劣势并不能消除。
3.2 温度对动力学参数的影响
表1数据显示了La3+/La电对在W电极上的i0和k0受温度的影响并随着温度的升高而增大。根据文献报道,k0遵循Arrhenius定律[25]:
k0=Aexp[-Eα/(RT)]
(4)
lnk0=-Ea/(RT)+lnA
(5)
式中:A为指前因子;Ea为反应活化能,kJ/mol。由式(5)作lnk0与1/T关系图,示于图10。通过图10拟合Arrhenius斜率求得反应活化能Ea=35.04 kJ/mol。

图10 反应速率常数对温度的依赖性Fig.10 Temperature dependence of reaction rate constant
La3+在熔盐中的电极反应受扩散效应的限制而温度升高使得离子在电解质中迁移至电极附近的速率更快,因此在电极表面的还原反应更易进行,体现为i0和k0随着温度的升高而增大。
由以上可知,温度对电极反应的影响是正相关的,所以在构建动力学模型时需要将动力学参数和温度进行建模。然而在努力提高电解精炼的回收效率时也要兼顾能源消耗,所以选择适当的温度非常重要。在乏燃料的电解精炼中积极寻求低能耗与高效率也是响应“碳中和与碳达峰”的一种方式。
4 结 论
(1) 本工作在LiCl-KCl-1%LaCl3体系中研究了La3+在W电极上的电化学性质,结果表明La3+在W电极上的还原过程除受到扩散控制外还可能受电荷转移控制,当扫描速率v在50~300 mV/s时氧化还原反应为一个准可逆过程。
(2) 在723~873 K研究了La3+在熔盐中的扩散系数对温度的依赖性。发现熔盐中La3+的扩散系数与温度成正相关,并根据Arrhenius方程计算得到LiCl-KCl-1%LaCl3中La3+的扩散活化能ED=34.51 kJ/mol。
(3) 将电化学阻抗谱技术(EIS)应用于高温熔盐电解精炼中研究镧系裂变元素的动力学机理,并计算得到723~873 K下La3+在W电极上的交换电流密度i0=0.48~1.39 A/cm2,反应速率常数k0=2.04×10-4~5.90×10-4cm/s,反应活化能Ea=35.04 kJ/mol。
