基于COX信号通路探讨栀黄止痛散对急性痛风性关节炎大鼠的影响*
2022-04-28王洋洋齐秀春韩崇涛
王洋洋,齐秀春,韩崇涛
1.河南省省立医院,河南 郑州 450000; 2.河南省中医院,河南 郑州 450000
急性痛风性关节炎(acute gouty arthritis,AGA)是因尿酸盐沉积在关节囊、滑囊、软骨及其他组织中引起的关节病变及炎性反应,患者常表现为关节疼痛、肿胀、活动受限,严重者可出现关节畸形、肌萎缩,甚至由于长期活动受限导致关节功能永久丧失,严重影响患者的生活质量[1]。治疗主要以消炎止痛为主,但可使用的药物较少,同时有不良反应[2]。近年来,中医药对关节炎疾病的治疗有明显优势,单独或联合常规西药治疗能够有效改善患者的症状[3-5]。栀黄止痛散为治疗关节炎、关节损伤的外用中药方剂,具有活血化瘀止痛、除湿消肿的功效。研究表明,栀黄止痛散外敷能够治疗痛风性关节炎,减轻患者关节疼痛,改善睡眠质量,联合体外冲击波可显著缓解滑膜炎患者关节肿胀和疼痛,但其作用机制尚不明确[6-7]。本研究通过向大鼠踝关节腔注射尿酸钠建立AGA模型,观察栀黄止痛散对AGA模型大鼠的保护作用。
1 材料
1.1 动物75只6周龄SD大鼠,SPF级,体质量180~220 g,雌雄各半,购自北京维通利华实验动物技术有限公司。动物许可证号为:SCXK(京)2017-0011。饲养条件如下:室温(22±2) ℃,湿度(50±10)%,动物房保持12 h12 h光暗循环照明,食水不限。研究方案获河南省省立医院伦理委员会批准,伦理批号:HNSLYY2019C010。
1.2 药物和试剂栀黄止痛散(主要成分为栀子、大黄、乳香、没药、木香、姜黄、赤芍、白芷、天花粉、白蔹、赤小豆、黄柏、冰片、麝香,由河南省省立医院药学部制剂室提供)。秋水仙碱片(云南西双版纳药业有限公司,批号:H53021369);尿酸钠(美国Sigma-Aldrich公司,货号:U2875);白细胞介素-6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(武汉伊莱瑞特生物科技有限公司,货号:E-EL-R0015c、E-EL-R0012c、E-EL-R2856c、E-EL-0060c、E-BC-K020-M);环氧化酶-1(cyclooxygenase,COX-1)、COX-2兔源单克隆抗体(美国CST公司,货号:9896、12282);前列腺素E2(prostaglandin E2,PGE2)兔源单克隆抗体[艾博抗(上海)贸易有限公司,货号:ab45295];RevertAidTMfirst Strand cDNA Synthesis Kit(美国Thermo Scientific,货号:K1622);蛋白定量试剂盒(武汉博士德生物工程有限公司,货号:AR0146)。
1.3 仪器37140型爪肿测量仪(意大利Ugo Basile);1703935型转印电泳仪、1645050型电泳仪电源、1658001型垂直电泳仪、ChemiDoc MP型凝胶成像仪(美国Bio-Rad公司);7500型PCR仪(美国ABI公司);IX53型显微镜(日本Olympus公司);FlexA-200型全波长酶标分析仪(杭州奥盛仪器有限公司)。
2 方法
2.1 动物分组、造模与给药将75只大鼠随机选取15只为正常组,其余大鼠均通过踝关节腔注射尿酸钠建立AGA模型,具体为:大鼠用体积分数10%水合氯醛麻醉后,在右后踝关节处注射50 μL尿酸钠混悬液(20 g·L-1),正常组大鼠在相同部位注射50 μL生理盐水[8],若大鼠受试关节在1 h内肿胀度≥0.3 mL即认为造模成功,然后将造模成功的大鼠随机分为模型组、秋水仙碱组、栀黄止痛散组和联合组。造模后1 h开始给药,栀黄止痛散组大鼠使用栀黄止痛散(根据关节大小,取适量栀黄止痛散加蜂蜜调匀)摊涂在棉纱上外敷于受试踝关节处并用医用胶带固定,每12 h更换一次药物;秋水仙碱组大鼠灌胃秋水仙碱0.15 mg·kg-1,每天3次;联合组大鼠在灌胃秋水仙碱的基础上外敷栀黄止痛散;正常组和模型组大鼠使用淀粉外敷于受试关节,每12 h更换一次。所有大鼠均连续给药3 d。
2.2 大鼠步态评分造模后1 h、6 h、12 h、24 h、48 h、72 h观察大鼠步态变化,并进行分级评分为0级:行走正常,计0分;1级:受试肢体稍微弯曲,轻度跛行,计2分;2级:受试肢体刚触及地面,中度跛行,计4分;3级:受试肢体离开地面,呈三足态行走,重度跛行,计6分[9]。
2.3 大鼠关节肿胀程度测定在大鼠受试踝关节处做标记,造模后1 h、6 h、12 h、24 h、48 h、72 h采用爪肿测量仪测量各组大鼠右后踝关节标记以下的容积。
关节肿胀度(mL)=(造模后踝关节容积-造模前踝关节容积)
2.4 大鼠机械缩足反射阈(paw mechanical withdrawal threshold,PWT)测定采用von Frey测试针分别于造模后1 h、6 h、12 h、24 h、48 h、72 h测定大鼠PWT值,以此评价大鼠机械性痛觉过敏变化。每次测试前,大鼠先放置于容器中适应15 min,然后使用不同刺激强度的von Frey测试针刺激大鼠受试右后肢足底中部,使针弯曲并持续6~8 s,观察大鼠后肢缩足反应。若大鼠在刺激时间内出现缩足反应则记为阳性反应,每次刺激间隔时间应大于10 s,找到能引起大鼠50%缩足反应的测试探针,记录相应的压力值(g)。
2.5 大鼠血清炎症和氧化应激因子测定造模 72 h 后,各组大鼠腹主动脉取血并分离血清,按照试剂盒说明书检测IL-6、IL-1β、TNF-α、MDA含量和SOD活力。
2.6 HE染色观察大鼠关节组织病理损伤变化处死大鼠,每组随机取5只大鼠分离其右后肢踝关节,置于体积分数10%福尔马林中固定,随后进行脱钙、组织脱水、制作组织蜡块、切片,切片厚度为 4 μm。将组织切片置于防脱载玻片上,65 ℃烤片 2 h 后使用二甲苯脱蜡30 min,行HE染色,脱水后用中性树胶封片,置于显微镜下观察各组大鼠关节组织的病理改变。
2.7 Western Blot法检测大鼠关节组织COX-1、COX-2、PGE2蛋白表达水平每组随机选取5只大鼠的右后肢踝关节囊,收集关节液、滑膜等周围的软组织,冰上研磨,离心取沉淀,沉淀中加入RIPA裂解液提取组织蛋白,BCA法蛋白定量,确定蛋白浓度,将蛋白作变性处理后进行SDS-PAGE电泳,湿转至PVDF膜,封闭2 h,4 ℃孵育COX-1、COX-2、PGE2一抗(抗体稀释比例均为11 000),过夜后洗膜,37 ℃孵育二抗(抗体稀释比例为11 000),再次清洗后滴加发光试剂,放入凝胶成像仪中成像,Image J软件对目的蛋白灰度值进行量化,计算蛋白相对表达量。
蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值
2.8 RT-PCR法检测大鼠关节组织COX-1mRNA、COX-2mRNA、PGE2mRNA表达水平取剩余大鼠的右后肢踝关节囊,收集关节液、滑膜等周围的软组织,冰上研磨,加1 mL Trizol裂解液提总RNA,根据试剂盒说明书进行逆转录合成cDNA并进行后续反应。采用2-△△CT的方法计算目的基因mRNA相对表达水平。引物序列见表1。

表1 基因引物序列
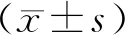
3 结果
3.1 各组大鼠步态变化比较造模后1 h,模型大鼠的步态均不正常,步态评分均为所有时间点最高值。正常组大鼠有轻微跛行现象,模型组、秋水仙碱组、栀黄止痛散组和联合组大鼠右后足弯曲,跛行现象明显,个别大鼠呈现三足步态;造模后6 h,正常组大鼠步态恢复正常,但其余四组大鼠仍存在明显跛行现象,随着时间推移,各组大鼠步态逐渐趋于正常。与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠步态评分显著降低,其中联合组恢复最快,差异具有统计学意义(P<0.05)。见表2。

表2 各组大鼠步态评分比较
3.2 各组大鼠踝关节肿胀程度比较造模后1 h,各组大鼠踝关节均出现肿胀现象,其中正常组大鼠踝关节有轻微红肿,模型组、秋水仙碱组、栀黄止痛散组和联合组大鼠踝关节处红肿明显。造模后6 h,与正常组比较,其余四组大鼠踝关节仍存在明显肿胀(P<0.05);与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠踝关节肿胀度减轻(P<0.05)。随着时间推移,各组大鼠踝关节肿胀均逐渐恢复正常,其中联合组大鼠踝关节肿胀度减少最显著,差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠踝关节肿胀度比较
3.3 各组大鼠PWT值比较造模后1 h,与正常组比较,其余各组大鼠PWT值均降低(P<0.05)。造模后6~72 h,模型组、秋水仙碱组和栀黄止痛散组大鼠PWT值均有所回升,与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠PWT值显著升高,其中,联合组PWT值高于秋水仙碱组和栀黄止痛散组,差异有统计学意义(P<0.05)。见表4。

表4 各组大鼠PWT值比较
3.4 各组大鼠血清炎症和氧化应激因子水平比较与正常组比较,模型组大鼠血清IL-6、IL-1β、TNF-α、MDA含量显著升高,SOD活力显著降低(P<0.05);与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠血清IL-6、IL-1β、TNF-α、MDA含量均显著降低,SOD活力显著升高(P<0.05);与秋水仙碱组比较,联合组IL-6、IL-1β、TNF-α、MDA含量降低,SOD活力显著升高(P<0.05)。见表5。

表5 各组大鼠血清细胞因子水平比较
3.5 各组大鼠关节组织病理变化比较正常组大鼠关节组织正常,偶见炎症细胞;模型组大鼠关节组织滑膜增生,滑膜细胞数量增加,同时有大量炎症细胞向滑膜组织浸润;与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠关节组织虽有纤维增生,但炎症细胞向滑膜组织的浸润明显减轻。见图1。

图1 各组大鼠关节组织病理变化比较(HE染色,×400)
3.6 各组大鼠关节组织COX信号通路蛋白表达水平比较与正常组比较,模型组大鼠关节组织COX-2、PGE2蛋白表达均升高(P<0.05),COX-1表达无显著差异(P>0.05);与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠关节组织COX-2、PGE2蛋白表达均降低,COX-1表达无显著差异(P>0.05);与秋水仙碱组比较,栀黄止痛散组大鼠关节组织COX-1、COX-2、PGE2蛋白表达无显著差异(P>0.05),联合组大鼠关节组织 COX-2、PGE2蛋白表达降低(P<0.05),COX-1表达无显著差异(P>0.05)。见图2,表6。

表6 各组大鼠关节组织COX信号通路蛋白表达水平比较

注:A.正常组;B.模型组;C.秋水仙碱组;D.栀黄止痛散组;E.联合组
3.7 各组大鼠关节组织COX-1mRNA、COX-2mRNA、PGE2mRNA水平比较与正常组比较,模型组大鼠关节组织COX-2mRNA、PGE2mRNA表达均显著升高(P<0.05),COX-1mRNA表达无显著差异(P>0.05);与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠关节组织COX-2mRNA、PGE2mRNA表达均显著降低(P<0.05),COX-1mRNA表达无显著差异(P>0.05);与秋水仙碱组比较,栀黄止痛散组大鼠关节组织COX-1mRNA、COX-2mRNA、PGE2mRNA表达无显著差异(P>0.05),联合组大鼠关节组织COX-2mRNA、PGE2mRNA表达均降低,COX-1mRNA表达无显著差异(P>0.05)。见表7。

表7 各组大鼠关节组织COX信号通路mRNA表达水平比较
4 讨论
AGA是由于嘌呤代谢紊乱导致血尿酸水平升高,尿酸盐结晶沉积于关节腔引起的关节红肿热痛的急性炎症反应[10-11]。中药在治疗AGA具有多成分、多靶点和多通路的治疗优势[12-13]。栀黄止痛散由栀子、大黄、乳香、没药、木香、姜黄、赤芍、白芷、天花粉、白蔹、赤小豆、黄柏、冰片、麝香等中药组成。栀子和大黄可消肿散结、破瘀通脉;乳香、没药、木香、姜黄、赤芍可活血化瘀、消肿止痛;白芷、天花粉、白蔹、赤小豆、黄柏除湿利水消肿;冰片、麝香芳香走窜,引药入病所,用蜂蜜调和药粉,外敷患处,全方共奏行气活血、化湿利水、清热消肿之功效。临床研究证明,栀黄止痛散对关节炎症性疾病具有较好的疗效,并可协同其他疗法改善患者症状,但其作用机制尚不清晰[14-15]。本研究通过建立大鼠AGA模型观察栀黄止痛散对AGA大鼠关节肿胀与疼痛的改善作用,并初步探究其作用机制。
研究结果显示,秋水仙碱和栀黄止痛散均能降低AGA模型大鼠步态评分,减轻踝关节肿胀,提高PWT值,而秋水仙碱和栀黄止痛散联合的效果优于单药,初步表明栀黄止痛散对大鼠急性关节炎关节肿胀和疼痛具有一定的改善作用,并可协同提高西药疗效。氧化应激和炎症反应是AGA的重要病理变化过程,两种反应相辅相成,互相诱导,是加快疾病发展的重要因素[16-18]。IL-1β是IL-1的主要存在形式,可与滑膜细胞及内皮细胞上的受体结合,介导细胞因子转录,刺激单核-巨噬细胞等大量分泌IL-1、IL-6及TNF-α等因子并沉积于关节,诱发炎症反应[19-20]。研究表明,风湿性关节炎患者外周血与关节液中IL-1、IL-6、TNF-α等炎症因子异常升高,可能参与了风湿性关节炎的发生发展[21]。研究认为,血清IL-6、IL-1β、TNF-α等细胞因子的表达水平对药物治疗类风湿性关节炎的疗效具有一定程度的预测作用,IL-6、IL-1β、TNF-α 的表达下调代表着药物治疗的有效性[22]。另一方面,在正常情况下,活性氧(reactive oxygen species,ROS)的产生受到体内SOD等抗氧化剂的控制,但在关节炎中这种氧化剂和抗氧化剂的平衡失调,ROS可破坏关节组织中的脂质、蛋白质和DNA,MDA的含量增加[23-25]。本研究发现,秋水仙碱和栀黄止痛散可降低AGA模型大鼠血清IL-6、IL-1β、TNF-α、MDA含量,提高SOD活力,二者联合的抗炎和抗氧化应激作用更显著,提示栀黄止痛散可显著抑制AGA大鼠的炎症反应和氧化应激损伤,与西药联合应用有增效作用。病理结果显示,与正常组比较,模型组大鼠关节组织有明显滑膜增生和炎症浸润;与模型组比较,秋水仙碱组、栀黄止痛散组和联合组大鼠关节组织虽有纤维增生,但炎症细胞向滑膜组织的浸润明显减轻,表明栀黄止痛散可显著改善急性关节炎大鼠关节组织病变。
环氧合酶(COX)由两种同工酶组成,即COX-1和COX-2。COX-1主要存在于胃、肾、血管等组织,有保护胃肠道黏膜、调节肾血流量的作用,与COX-1不同,COX-2的表达主要由机体炎症反应如TNF、IL-1β等细胞因子的刺激引起,PGE2是其主要代谢产物,可进一步加速炎症反应的发展[26-27]。研究表明,IL-6/COX-2轴的激活加重了急性类风湿性关节炎的发展[28]。研究发现,下调COX-2可拮抗胶原诱导型大鼠关节炎的关节肿胀和疼痛反应[29]。本研究发现,AGA模型大鼠关节组织COX-2、PGE2 蛋白和mRNA表达水平均升高,而秋水仙碱和栀黄止痛散可降低COX-2、PGE2 蛋白和mRNA表达,其中栀黄止痛散联合秋水仙碱的作用优于单药治疗,表明栀黄止痛散单独或联合西药治疗可抑制AGA大鼠COX信号通路的活化。
综上所述,栀黄止痛散单独和联合西药治疗均可改善AGA模型大鼠步态、踝关节肿胀和疼痛,减少炎症和氧化应激反应,减轻受试关节组织病理损伤变化,其作用可能与抑制COX信号通路的活化有关。
