α-倒捻子素对阿尔茨海默病大鼠认知记忆功能的影响
2022-04-27罗佳佳胡英豪钟长军左坚王秀皖南医学院中西医结合研究中心安徽芜湖241000
★ 罗佳佳 胡英豪 钟长军 左坚 王秀(皖南医学院中西医结合研究中心 安徽 芜湖 241000)
阿尔茨海默病(alzheimer's disease, AD)是一种病因未明的慢性神经退行性疾病,目前尚无治愈或阻止AD 病程进展的特效药物。研究表明,AD的发生和发展可能涉及胆碱能损伤,β-淀粉样蛋白异常沉积,Tau 蛋白过度磷酸化,自由基损伤,氧化应激反应,神经血管功能退化等多种机制[1]。其中,β-淀粉样蛋白毒性假说占主导地位,Aβ的异常沉积可导致神经炎症,加重AD 患者的认知障碍[2]。研究表明,激活小胶质细胞表面α7-烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)能减少β-淀粉样蛋白对神经细胞的损伤,对神经元产生保护作用[3]。α-倒捻子素(α-mangostin,MAN)分来自山竹的果壳,其具有增加乙酰胆碱,上调α7nAChR 表达,抑制炎症的作用[4],表明MAN 抑制炎症的作用可能与胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)激动有关。通过建立AD 模型,观察MAN 对实验大鼠认知记忆功能的作用,并根据其对CAP 的干预作用,初步探讨上述治疗过程中涉及的分子机制。
1 材料与方法
1.1 材料
SPF 级雄性SD 大鼠36 只,体质量(160±20)g,由郑州市惠济区华兴实验动物养殖场提供,许可证号SCXK(豫)2019-0002,饲养于皖南医学院SPF 级动物中心。Aβ1-42(美国Sigma 公司,货号SCP0038);D-半乳糖(上海MACKLIN 公司,批号C10888470);大鼠 TNF-α ELISA Kit(批号:A38200623)、大鼠IL-1β ELISA Kit(批号:A301B00631)为杭州联科生物技术股份有限公司产品;CHRNA7 兔抗大鼠单克隆抗体(货号:A1588)、β-actin 兔抗大鼠多克隆抗体(货号:AC026)为武汉爱博泰克生物科技有限公司(ABclonal)产品;二抗兔抗(美国CST 公司,货号:7074P2);苏木素伊红(hematoxylin eosin,H&E)染色试剂盒(上海碧云天生物技术有限公司,编号:C0105M)。
1.2 方法
1.2.1 实验分组与模型制备大鼠适应性喂养1 周后,随机分为正常组、模型组、MAN 组,每组12 只。模型组和MAN组以每天100 mg/kg剂量腹腔注射5% D-半乳糖,连续注射42 d,期间在第21 天于大鼠大脑右的侧海马区注射Aβ1-425 μL,Aβ1-42的浓度为2 μg/μL。正常组不做任何处理。大鼠海马区注射Aβ1-42具体操作如下:大鼠麻醉后,剪去头部两耳间毛发,固定于大鼠脑立体定位仪上,消毒皮肤,然后剪开头部皮肤,暴露颅骨,找到前囟,在前囟点向后4.4 mm,向右2.2 mm 的位置作一标记,作为Aβ注射点,用10 mL注射器针头缓缓钻通该点颅骨,用微量注射器吸取5 μL Aβ1-42溶液,从注射点向下进针2.8 mm 到达海马区,缓慢推注,药物推完后留针5 min,再缓慢退针。然后缝合伤口,皮下注射4万IU 青霉素钠预防感染。
从第22 天开始,MAN 组以40 mg/kg 剂量灌胃给药,连续灌胃21 d,模型组和正常组以等体积生理盐水代替药物。
1.2.2 Morris 水迷宫实验 Morris水迷宫分为6 d定位航行试验和1 d 空间探索试验,用于检测大鼠的学习记忆能力和空间探索能力。定位航行试验:水迷宫水池分为4 个象限,将平台放置在第2 象限中间,往水池中放水直至高出平台3 cm 左右,向水中加入墨汁混匀,使水变黑,看不见水里的平台。实验开始前,先撤去水中平台,将大鼠放入水池里适应性游泳90 s,以熟悉水池环境。实验正式开始,将大鼠面向池壁从任一象限的同一位置放入水中(4 个象限轮流进行),并点击电脑Morris 水迷宫开始程序,记录大鼠在90 s内找到平台所需要的时间,即为大鼠上平台潜伏期,以及大鼠上台前的游泳路程。大鼠找到平台后,让其在平台上休息10 s,然后取出擦干,放回笼内休息1 min,再进行下一象限的测试。若大鼠在90 s 内不能找到平台,则上平台潜伏期记为90 s,由实验人员将其引导至平台上,同样休息10 s。实验连续做6 d。第7 天时撤去水中平台,将第4 象限的中点作为入水点,将大鼠面向池壁放入水中,记录大鼠90 s 内穿越原平台位置的次数以及大鼠在该象限内停留的时间。
1.2.3 ELISA 法检测大鼠血清中TNF-α、IL-1β的浓度大鼠麻醉后,剪开腹腔,从腹主动脉采集血液,将血液贮存在促凝管中,静置2 h,然后以3 000 r/min 转速离心10 min,收集上清,按试剂盒说明书要求测定TNF-α、IL-1β 浓度。
1.2.4 组织切片及病理学观察行为学实验结束后第2 天,用10%水合氯醛麻醉大鼠。大鼠深度麻醉后,用生理盐水和4%多聚甲醛对大鼠进行心脏灌注,灌注完成后快速断头取脑,并将取出的脑组织进一步固定于4%多聚甲醛。 待24 h 后完成组织固定,取视交叉至大脑横裂部份的脑组织,进行石蜡包埋,以5 μm 左右厚度,进行冠状切片。经HE 染色后,光学显微镜下观察细胞形态学变化。
1.2.5 Western Blot 法检测大鼠海马α7 受体表达取0.05 g 大鼠海马组织,用生理盐水洗2 次,吸水纸吸干水分,置于2 mL 无菌离心管中,加入500 μL现配的含蛋白酶抑制剂、磷酸酶抑制剂的RIPA 裂解液,在冰冷条件下以匀浆器匀浆处理,继续置于冰上裂解30 min,之后在4℃下以12 000 rpm 速度离心10 min,取上清。所得样本经BCA 蛋白定量试剂盒测定蛋白浓度后加入蛋白上样缓冲液,沸水浴5 min 变性处理。所得样本上样于10%的SDSPAGE 胶,进行蛋白电泳,随后将分离后蛋白电转至聚偏二氟乙烯膜(PVDF 膜)上,用5%脱脂牛奶封闭2 h,TBST 洗膜3 次,每次10 min,一抗α7 抗体4 ℃孵育过夜,TBST 洗膜3 次,室温孵兔抗二抗1 h,再用TBST 洗膜3 次。在全自动化学发光凝胶成像分析系统设备上以ECL 化学发光液曝光,显影。使用image J 记录条带灰度值,进行归一化处理。
1.3 统计学方法
采用SPSS 21.0 统计学软件,实验结果以均值±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 Morris 水迷宫实验
2.1.1 MAN 对AD 大鼠定位航行功能的影响定位航行试验中,随着训练次数的增加,各组大鼠上平台潜伏期呈现缩短趋势。与正常组比较,模型组大鼠在第3 天以后上平台潜伏期明显延长,上平台前的路程也明显增多,差异具有统计学意义(P<0.05,P<0.01);与模型组比较,MAN 组大鼠上平台潜伏期时间在第4 天以后明显缩短,上台前路程也明显缩短,差异具有统计学意义(P<0.05)。见表1-2。
表1 MAN对AD大鼠上平台潜伏期的影响(±s,n=12) s
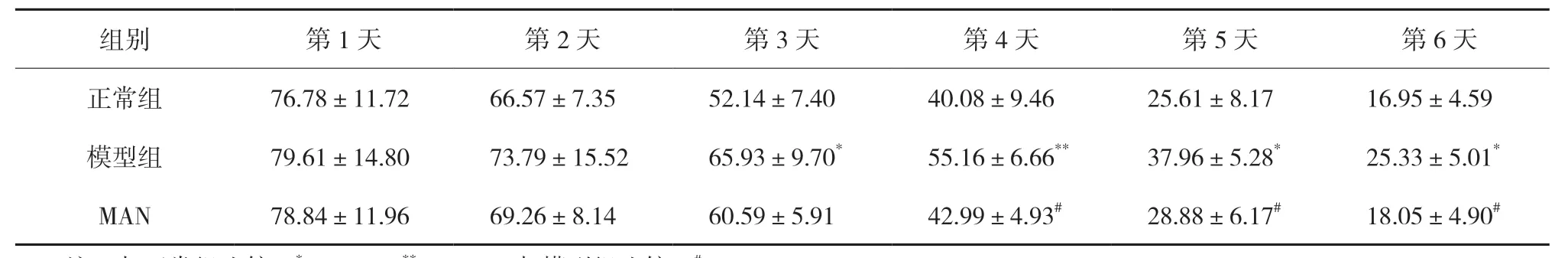
表1 MAN对AD大鼠上平台潜伏期的影响(±s,n=12) s
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。
组别 第1 天 第2 天 第3 天 第4 天 第5 天 第6 天正常组 76.78±11.72 66.57±7.35 52.14±7.40 40.08±9.46 25.61±8.17 16.95±4.59模型组 79.61±14.80 73.79±15.52 65.93±9.70* 55.16±6.66** 37.96±5.28* 25.33±5.01*MAN 78.84±11.96 69.26±8.14 60.59±5.91 42.99±4.93# 28.88±6.17# 18.05±4.90#
表2 MAN对AD大鼠上台前路程的影响(±s,n=12) mm
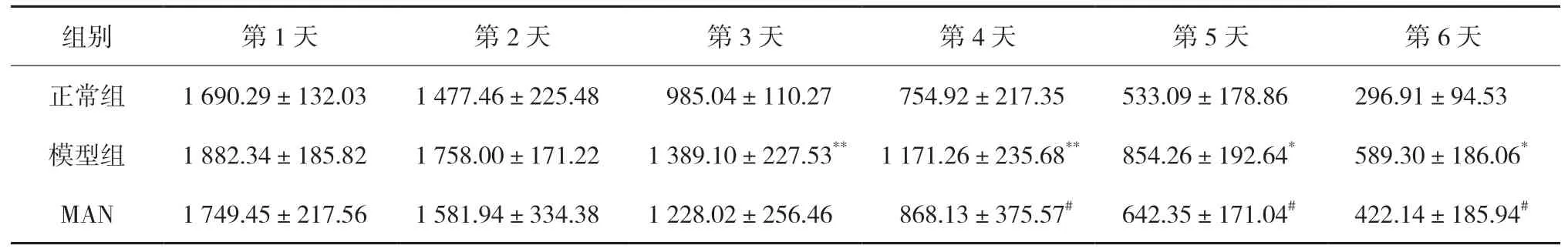
表2 MAN对AD大鼠上台前路程的影响(±s,n=12) mm
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。
组别 第1 天 第2 天 第3 天 第4 天 第5 天 第6 天正常组 1 690.29±132.03 1 477.46±225.48 985.04±110.27 754.92±217.35 533.09±178.86 296.91±94.53模型组 1 882.34±185.82 1 758.00±171.22 1 389.10±227.53** 1 171.26±235.68** 854.26±192.64* 589.30±186.06*MAN 1 749.45±217.56 1 581.94±334.38 1 228.02±256.46 868.13±375.57# 642.35±171.04# 422.14±185.94#
2.1.2 MAN 对AD 大鼠空间探索功能的影响在空间探索试验中,与正常组比较,模型组大鼠穿越平台的次数和目标象限逗留时间均明显减少(P<0.01);而MAN 组的大鼠穿越平台的次数和目标象限的逗留时间均明显增加(P<0.05)。见表3。
表3 MAN对AD大鼠平台穿越次数和目标象限停留时间的影响(±s,n=12)

表3 MAN对AD大鼠平台穿越次数和目标象限停留时间的影响(±s,n=12)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05。
组别 平台穿越次数/次 目标象限逗留时间/s正常组 8.0±1.91 46.94±7.79模型组 4.29±1.98** 29.29±6.17**MAN 组 6.86±1.35# 42.06±9.04#
2.2 MAN 对AD 大鼠血清中TNF-α、IL-1β 浓度的影响
模型组大鼠血清中TNF-α 和IL-1β 水平较正常组显著升高,差异具有统计学意义(P<0.01);与模型组比较,MAN 组TNF-α、IL-1β 水平明显降低(P<0.01,P<0.05)。见表4。
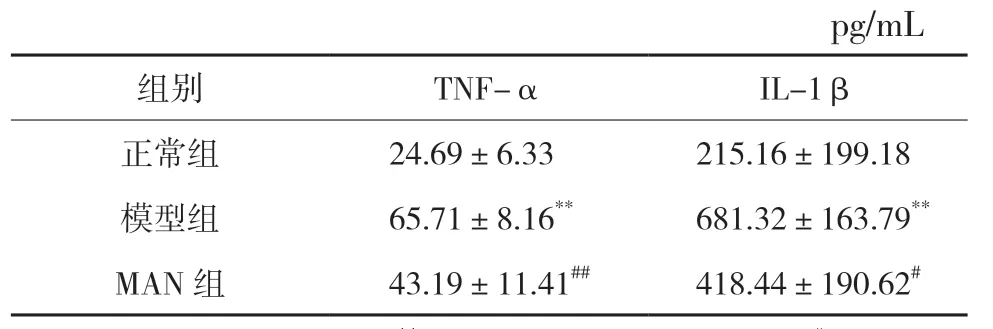
表4 MAN对AD大鼠血清中TNF-α、IL-1β浓度的影响
2.3 MAN 对AD 大鼠海马中α7nAChR 表达的影响
模型组大鼠海马α7nAChR 表达跟正常组比较,明显下调,差异具有统计学意义(P<0.01);MAN 组的AD 大鼠海马α7nAChR 表达明显增高,差异具有统计学意义(P<0.01)。见图1。

图1 MAN对AD大鼠海马中α7nAChR表达的影响
2.4 MAN 对AD 大鼠海马CA1 区的形态学的影响
正常组大鼠海马CA1 区神经细胞排列整齐,细胞核圆大,细胞结构完整、清晰;模型组大鼠海马CA1 区大部分细胞正常结构消失,细胞变形,胞核区域深染,胞核肿胀、碎裂,形态不规则,大量神经元变性;MAN 组相较模型组,细胞排列较为整齐,细胞结构比较清晰,排列规则。见图2。

图2 MAN对AD大鼠海马CA1区组织形态的影响(×400)
3 讨论
随着社会人口进入深度老龄化阶段, AD 患者群体总量不断增加。预计到2050 年,仅我国AD患者人数就将超过3 000 万[5]。AD 起病隐匿,逐渐发展导致认知记忆功能、语言功能和生活独立性的丧失,严重影响患者的身心健康,加重家庭和社会的负担。MAN 是一种天然多酚,主要分布在山竹果皮中,其具有抗炎、抗菌、抗氧化、抗肿瘤、神经保护等作用[6~8]。研究发现MAN 可同时抑制乙酰胆碱酯酶(AChE)活性,促进α7nAChR 表达,从而有效激活CAP,改善外周免疫环境[9],从而表现出良好的抗炎作用[10]。与上述活性一致,MAN 可以改善抑郁症模型大鼠的认知缺陷和抑郁表现[11]。本研究发现,行为学方面,MAN 缩短了AD 大鼠的上平台潜伏期和上台前路程,增加了平台穿越次数、目标象限停留时间。同时,MAN 降低AD 大鼠血清中TNF-α、IL-1β 水平,上调海马中α7nAChR 蛋白表达,复性调控作用同步伴随着AD 大鼠海马CA1 区神经细胞的病理变化的显著改善。提示MAN 具有一定改善AD 大鼠认知记忆功能的作用。
近年来,炎症与AD 的关系受到越来越多人的关注。小胶质细胞是中枢神经系统内固有的免疫效应细胞,在AD 中小胶质细胞过表达的炎症反应,释放炎症介质,如炎性细胞因子、补体成分、趋化因子等,促进β 淀粉样蛋白沉积、tau 蛋白过度磷酸化,加剧神经退行性变[12-13]。文献报道,MAN能够抑制癫痫小鼠海马神经元凋亡,降低其炎症水平,改善空间记忆能力[14]。α-倒捻子素衍生物能减轻再灌注引起的炎症损伤,并改善血管性痴呆大鼠的认知功能[15]。在本研究中,MAN 能够降低AD 大鼠血清中TNF-α、IL-1β 水平,减轻体内炎症反应。
CAP 是一种神经免疫调节通路。迷走神经刺激下释放的乙酰胆碱与α7nAChR 结合,神经系统能快速显著的抑制巨噬细胞释放炎症因子,如TNF-α,减轻全身性炎症反应[16]。α7nAChR 是CAP 的核心组成,激活α7nAChR 可以抑制IL-1、IL-6、IL-8 等炎症细胞因子的释放[17]。α7nAChR属于烟碱型乙酰胆碱受体,由5 个α7 单体组成的配体门控离子通道,是研究阿尔茨海默病和精神分裂症治疗的一个重要靶点[18]。α7nAChR 在中枢和外周均有分布,神经元型α7nAChR 广泛分布于海马、大脑皮质、下丘脑,具有抗炎及神经保护作用[19]。研究发现,激活α7nAChR 能促进脑胆碱能信号的调节,增强认知功能,改善AD 的病理表现[20]。同时,α7nAChR 激动剂可以增加脓毒症脑病小鼠的M2 型小胶质细胞数量,减轻脑内炎症反应,改善小鼠的认知记忆能力[21]。本研究结果表明MAN 能够上调AD 大鼠海马中α7nAChR 的表达,改善AD大鼠在水迷宫定位航行和空间探索试验中的表现,与上述报道结果一致。组织病理结果显示,经MAN治疗后的AD 模型大鼠海马CA1 区神经细胞结构比较完整,无明显细胞破裂,进一步验证了上调的α7nAChR 表达对神经细胞具有保护作用。提示MAN 改善AD 大鼠认知记忆能力可能与其缓解了脑内炎症反应有关。
综上,MAN 具有上调AD 大鼠海马α7nAChR表达,改善AD 大鼠认知记忆功能的作用。这一作用可能与α7nAChR 表达增加激活CAP,抑制IL-1β、TNF-α 炎症因子的释放,减轻脑内炎症对神经细胞的损害有关。
