象皮生肌膏对慢性创面大鼠肉芽组织TGF-β1、EGFR、FN 蛋白表达的影响
2022-04-27程学荣李木清张月娟李成丽姜雄杜攀攀毛滔杨振武湖南中医药大学第二附属医院长沙0005湖南中医药大学第一附属医院长沙0007长沙市中医院长沙000湖南中医药大学长沙08
★ 程学荣 李木清 张月娟 李成丽 姜雄 杜攀攀 毛滔 杨振武(.湖南中医药大学第二附属医院 长沙 0005;.湖南中医药大学第一附属医院 长沙 0007;.长沙市中医院 长沙 000;.湖南中医药大学 长沙 08)
骨科创伤患者往往会有大面积的皮肤软组织缺损,伤口在短时期内难以愈合,已发展为慢性创面,传统的骨科创伤治疗方法有一定的弊端,如处理不当,迁延不愈,容易引发感染,最终导致解剖和功能上的缺陷[1]。象皮生肌膏在临床皮肤损伤修复、促进创面愈合的治疗中有着显著的效果[2],本实验采用象皮生肌膏对慢性创面大鼠进行治疗,观察创面新生组织中TGF-β1、EGFR 及FN 蛋白的表达及创面愈合率的变化,从微观角度阐述其促愈合的作用机制,丰富其“祛腐生肌”的科学内涵[3]。
1 材料与方法
1.1 材料
1.1.1 实验动物Sprague-Dawley(SD)大鼠72 只,SPF 级,雄性,12 周龄,220~250 g,由湖南中医药大学动物实验中心(动物使用许可证号:SYXK<湘>2019-0009)代购于湖南长沙斯莱克景达(动物生产许可证号:SCXK<湘>2019-0004),动物分笼饲养,自由摄食、饮水,室温(20±2)℃,适应性喂养1 周后进行实验。实验中对动物处置符合科技部《关于善待实验动物的指导性意见》的规定。
1.1.2 材料10%水合氯醛(北京雷根生物技术有限公司,批号:0528A20);象皮生肌膏(湖南中医药大学第一附属医院制剂室制备,湘药制字Z20070276,生产批号20200121);重组牛碱性成纤维细胞生长因子凝胶(珠海亿盛生物制药有限公司,产品批号:04481212);醋酸氢化可的松(上海源叶生物科技有限公司,产品编号S47632)。
1.1.3 主要仪器台式冷冻离心机(中国湖南湘仪);电子天平(美国双杰);精密pH 计(中国雷磁);转膜仪(中国北京六一)。
1.2 方法
1.2.1 造模方法参考付小兵等的创面造模方法[4]:造模前24 h,72 只大鼠均禁食禁水,用棉签刺激其肛门部排空大便,用10%水合氯醛腹腔注射(按每只大鼠0.3 mL/100g 的剂量注射,注意勿注射入大鼠肠腔以及膀胱)进行麻醉。麻醉成功后,将大鼠俯卧位固定,腰椎正中偏上约4 cm×4 cm 大小皮肤处予脱毛膏脱毛。脱毛干净后置于净化台上,手术区常规消毒,铺无菌单,选择背中部脊柱右侧旁开0.5 cm 距肩胛骨以下2 cm 处制备直径20 mm深至皮下深筋膜层的圆形创面,注意用眼科刀切除表皮和真皮,深至皮下深筋膜层,按照80 mg/kg标准注射醋酸氢化可的松将实验组、对照组、模型组3 组大鼠建成慢性创面模型。空白组仅背部备皮处理。
1.2.2 动物分组从72 只SD 大鼠中随机挑选18只为空白组,其余64 只制备慢性创面模型后,随机分为实验组、对照组和模型组,每组18 只。
1.2.3 处理方法实验组:创面用5%碘伏消毒再用生理盐水棉球擦净后在创面涂抹约1 mm 厚的象皮生肌膏,再用无菌敷贴覆盖创面,用胶布加以固定,早晚各予以一次换药。对照组:创面用5%碘伏消毒再用生理盐水棉球擦净后在创面涂抹约1 mm 厚的重组牛碱性成纤维细胞生长因子凝胶,再用无菌敷贴覆盖创面,用胶布加以固定,早晚各予以一次换药。模型组:创面用5%碘伏消毒再用生理盐水棉球擦净后,再用无菌敷贴覆盖创面,用胶布加以固定,早晚各予以一次换药。空白组:备皮处局部用5%碘伏消毒后以生理盐水外涂,再用无菌敷贴覆盖创面,用胶布加以固定,早晚各予以一次换药。
1.2.4 疗效评价方法于肉眼及显微镜下观察创面愈合情况。于治疗后第3、7、14 天随机挑选6 只处死并取同一部位的创面组织为标本,采用westernblot 检测EGFR、TGF-β1、FN 蛋白在创面中的表达。
1.2.5 创面愈合率的计算分别在治疗后的第3、7、14 天用透明膜描记法绘得创面的图形,再将图形描至小方格纸,以小方格的格数表示创面面积,与治疗前比较,计算每只动物不同时间的创面愈合百分率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
1.2.6 统计学方法采用SPSS 25.0 统计软件分析,计量资料用“均数± 标准差”(±s)表示,若满足方差齐性检验则采用单因素方差分析,然后采用LSD 检测两两比较,若不满足方差齐性检验则采用非参数秩和检验,然后采用Mann-WhitneyU 两两比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组创面溃疡组织形态学观察
空白组皮肤结构完整,表皮无坏死脱落,无出血、无炎细胞浸润。造模后第3 天,模型组、实验组、对照组均可见坏死表皮组织,大量炎性细胞浸润,实验组、对照组可见大量新生毛细血管,两组较模型组丰富;造模后第7 天,模型组仍有大量炎性细胞,实验组及对照组有大量成纤维细胞分布,毛细血管丰富。造模后第14 天,实验组及对照组大量成纤维细胞分布,毛细血管丰富,模型组炎性细胞较前减少,纤维细胞散在分布。见图1。
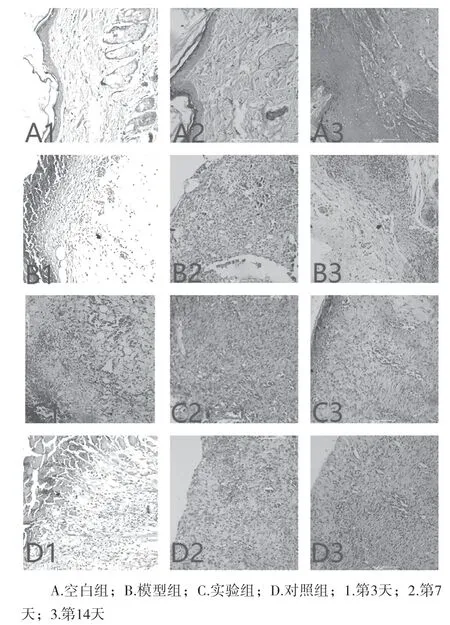
图1 HE染色结果(×200)
2.2 各组创面愈合率比较
模型组的愈合率第3、7、14 天均低于实验组、对照组(P<0.05);实验组和对照组第3 天无明显差异,第7 天实验组愈合率高于对照组(P<0.05),第14 天实验组与对照组差异无统计学意义(P>0.05)。见表1。
表1 各组创面愈合率比较(±s,n=6) %

表1 各组创面愈合率比较(±s,n=6) %
注:与实验组比较,*P<0.05;与对照组比较,#P<0.05;与模型组比较,▲P<0.05。
组别 3 d 7 d 14 d模型组 1.28±0.01*# 14.92±0.03*# 59.03±0.02*#实验组 6.15±0.01▲ 35.40±0.02▲# 82.23±0.01▲对照组 6.83±0.01▲ 29.10±0.04*▲ 81.48±0.03▲
2.3 各组TGF-β1 表达水平比较
在局部处理后的第3、7、14 天,空白组中TGF-β1 表达水平无明显变化,差异无统计学意义(P>0.05);模型组与实验组及对照组相比第3、7、14 天创面组织中TGF-β1 均处于低表达,差异具有统计学意义(P<0.05);对照组第3、7、14 天均高于模型组(P<0.05),处理第7 天达到最高峰,第14 天时呈现下降趋势;实验组前后表达较稳定,与模型组相比第3、7、14 天均显著高表达,差异具有统计学意义(P<0.05)。见表2 和图2。
表2 各组TGF-β1表达水平比较(±s,n=6)

表2 各组TGF-β1表达水平比较(±s,n=6)
注:与空白组比较,*P<0.05;与对照组比较,#P<0.05;与模型组比较,▲P<0.05。
组别 3 d 7 d 14 d空白组 41.34±5.79▲# 51.27±6.00▲# 46.64±8.26▲#模型组 20.85±3.57*# 32.95±7.92*# 25.03±10.37*#对照组 55.75±3.50*▲ 62.77±6.62*▲ 58.88±5.34*▲▲实验组 64.53±6.74*▲# 71.13±10.59*▲ 73.74±9.81*▲#
2.4 各组EGFR 表达水平比较
在局部处理后的第3、7、14 天,空白组中EGFR 表达水平差异无统计学意义。处理第3 天与模型组比较,对照组及实验组显著高于模型组,差异具有统计学意义(P<0.05)。处理第7 天,实验组及对照组均显著高于模型组,差异具有统计学意义(P<0.05);处理第14 天,实验组及对照组创面接近痊愈,EGFR 表达增长趋势总体趋缓,模型组增长趋势加快,在跟其它组比较中其表达更高,差异具有统计学意义(P<0.05)。见表3 和图2。
表3 各组EGFR表达水平比较(±s,n=6)

表3 各组EGFR表达水平比较(±s,n=6)
注:与第3天比较,▲P<0.05;与第7天比较,△P<0.05;与对照组比较,*P<0.05;与空白组比较,#P<0.05;与模型组比较,◆P<0.05。
组别 3 d 7 d 14 d空白组 19.67±3.54◆* 19.49±2.99◆* 29.82±12.29◆*模型组 44.04±3.03#* 38.85±2.80#* 81.15±4.78#*对照组 59.59±1.93#◆ 58.12±5.16#◆ 65.50±6.06#◆△实验组 58.32±1.96#◆ 65.37±3.69#◆* 71.29±7.66#▲△
2.5 各组FN 表达水平比较
在局部处理后的第3、7、14 天,空白组组织中FN 表达水平前后差异无统计学意义(P>0.05);模型组处理第3、7、14 天FN 表达均低于实验组及对照组,差异具有统计学意义(P<0.05),总体呈逐渐缓慢递增趋势。实验组表达显著高于模型组,差异具有统计学意义(P<0.05),处理第3、7、14 天逐渐递增。对照组处理第3、7、14 天均高于空白组及模型组(P<0.05),差异具有统计学意义,但与实验组相比相对偏低,总体呈递增趋势。见表4 和图2。
表4 各组FN表达水平比较(±s,n=6)

表4 各组FN表达水平比较(±s,n=6)
注:与第3天比较,▲P<0.05;与第7天比较,△P<0.05;与对照组比较,*P<0.05;与空白组比较,#P<0.05;与模型组比较,◆P<0.05。
组别 3 d 7 d 14 d空白组 39.05±4.19◆* 48.98±14.88◆ 40.53±16.30◆*模型组 19.96±2.43#* 26.86±10.95#* 59.19±14.11#▲△对照组 55.60±7.12#◆ 62.41±7.80◆ 73.67±9.60#▲实验组 61.27±5.36#◆ 70.17±12.75#◆ 78.62±4.22#◆▲

图2 各组不同时间蛋白表达情况
3 讨论
慢性创面是骨伤科常见症状,若处理不当,会使创面迟迟不能愈合,最终给患者带来解剖和功能上的缺陷,运用中医药防治本病的发生发展是保障人类健康的重大需求。古人在治疗慢性创面上累积了一定经验,认为应当遵守“祛腐生肌”的理念,祛腐可以生肌,早在《刘涓子鬼遗方·痈疽证治方》就有相关论述,指出“治死肉臭秽与高肉相缀,须用猪蹄汤熨拭,令死肉相离,别生好肉,猪蹄汤方”[5]。清代吴谦著《医宗金鉴》更确切的指出“腐者,坏肉也……腐不去则新肉不生”[6]。大量临床实践证实[7],慢性创面中称之为“腐”的坏死组织不仅难以愈合,而且还能阻碍正常组织尤其新生肉芽的生长,因此通过对创面合理清创,清除坏死组织,使原来的慢性创面成为新鲜的急性创面,新的创面才会有新生肉芽组织生长出来,即“腐去肌方生”;同样,生肌亦可祛腐。象皮生肌膏出自《疡科纲要》,药物组成主要包括:象皮、当归、地黄、血余炭、炉甘石、石膏等。其中象皮止血、敛疮;当归补血活血、排脓生肌、消肿止痛;地黄清热生津、滋阴凉血;血余炭消瘀止血;炉甘石解毒收湿、止痒敛疮;石膏清热泻火解毒;诸药合用能调和阴阳气血,使而祛腐生肌[8]。
创面愈合是一个多种因素参与的复杂生物过程,大致分为3 个相互重叠的阶段,即炎症期、增殖期和重塑期,此过程受到神经、内分泌以及激素变化等诸多方面的影响[9]。研究表明,慢性创面的机制主要在于局部创面生长因子浓度的变化、修复细胞的过度凋亡以及创面细胞外基质成分的基因表达下调等,因此创面愈合分子即细胞因子、受体、神经递质等化学信号分子[10]。这些微观分子具有多效性、重叠性、拮抗性和协同性等特点,它们构成一张复杂的神经-内分泌-免疫网络,调控着机体的功能活动。因此,可以通过调节这些微观分子的平衡从而达到对整体功能的调控作用,从而促进创面的愈合。EGFR 作为配体表皮生长因子触发细胞增殖、修复、分化、存活的重要受体[11],在创伤修复过程中表达增加、活性增强,并呈现一定的时相性[12]。FN 是一类分子量为440~550 kD 的糖蛋白, 广泛存在于机体许多组织中,具有促进伤口愈合作用, 并参与创伤修复的全过程[13]。FN 作为一种黏合剂, 在正常皮肤下组织含量极微,当皮肤发生溃烂时,可与纤维原、纤维蛋白原、肝素及硫酸肝素和胶原相结合, 共同形成基质, 促进肉芽组织的生长以及表皮移行,在创面修复中起着重要作用[14]。临床及基础研究均证实TGF-β1 作为转化生长因子中的一员,是成纤维细胞最强的趋化因子,在促进成纤维细胞增殖、迁徙、分化中起重要作用[15-16],TGF-β1 与溃疡愈合面积呈高度正相关。新生血管的形成、肉芽组织的再生和结缔组织的形成均与 MMP-2 和TIMP-2 密切相关[17],而TGF-β1 可通过增强TIMP-2,抑制MMP-2 的基因表达,促进新生血管生成,参与创面修复。
本次研究显示,在局部处理后的第3、7、14 天,TGF-β1、EGFR、FN 在空白组大鼠局部皮肤组织中表达水平差异无统计学意义(P>0.05),组织形态学无明显差异。与空白组比较,实验组、对照组、模型组大鼠创面组织中TGF-β1、EGFR、FN 表达水平变化均较明显,差异具有统计学意义(P<0.05)。实验处理第3 天,与模型组比较,实验组及对照组TGF-β1、EGFR、FN 均显著升高,差异具有统计学意义(P<0.05)。实验第7 天,与模型组比较,实验组及对照组TGF-β1、FN、EGFR 均显著升高,差异具有统计学意义(P<0.05)。实验第14 天,实验组及对照组TGF-β1、FN 显著高于模型组,差异具有统计学意义(P<0.05),实验组及对照组EGFR蛋白第14 天增长减缓,模型组增长明显。空白组皮肤结构完整,表皮无坏死脱落,无出血、无炎细胞浸润,前后无明显差异。研究证明实验组、对照组组织形态学观察与同期较模型组相对恢复更好。说明象皮生肌膏可促使大鼠创面TGF-β1、EGFR、FN增多, 进而促进创面细胞增殖、生长。
综上所述,象皮生肌膏能够提高大鼠创面组织中TGF-β1、EGFR、FN 蛋白的表达水平,促进慢性创面的愈合,丰富了其“祛腐生肌”的科学内涵,为临床应用象皮生肌膏治疗慢性难愈合创面提供可靠的实验依据。然而,象皮生肌膏的作用机制复杂,且本次研究只进行了蛋白层面的研究,不能完全阐述象皮生肌膏促进慢性创面愈合的作用机制,下一步将深入基因层面进行探讨研究。
