多发性骨髓瘤患者骨髓活检组织中IL-8、CD56的表达及临床意义
2022-04-26黄裕林
黄裕林
重庆市开州区人民医院检验科,重庆 405400
多发性骨髓瘤(MM)为恶性血液系统疾病,其临床发病机制主要与骨髓微环境、DNA甲基化、基因突变等有关[1]。近年来,随着MM新兴疗法的临床运用,该类患者的生存率得到显著提高,但该病仍难以治愈[2]。因此,寻找其早期诊断标志物意义重大。目前,临床对于MM的诊断主要依据骨髓细胞检验、血清指标检验联合影像学检查[3]。有研究显示,CD56可介导骨髓瘤细胞的黏附,其在浆细胞上呈高表达[4]。另有研究报道,白细胞介素-8(IL-8)能够促进肿瘤进展,其可诱导血管生成[5]。为进一步探讨IL-8、CD56与MM的关系,本文对67例MM患者进行了研究,现报道如下。
1 资料与方法
1.1一般资料 选取2019年1月至2021年5月本院收治的67例MM患者作为MM组。纳入标准:均为初发病例,经骨髓形态学、X线、免疫球蛋白(Ig)检查,符合《中国多发性骨髓瘤诊治指南(2015年修订)》[6]中的诊断标准。排除标准:合并自身免疫性疾病、严重感染性疾病、其他恶性肿瘤及近期接受放化疗治疗等患者。MM组中男41例,女26例;年龄46~73岁,平均(55.26±3.54)岁;Durie-Salmon(D-S)分期[7]:Ⅰ期17例,Ⅱ期38例,Ⅲ期12例。另选取同期于本院就诊的35例骨髓象检查正常的患者作为对照组,其中男18例,女17例;年龄43~75岁,平均(56.15±2.89)岁。2组性别构成、年龄差异无统计学意义(P>0.05),具有可比性。
1.2方法 收集2组骨髓组织,经石蜡包埋备用,应用免疫组织化学法检测标本中IL-8、CD56的表达。具体操作步骤:(1)将骨髓切片脱蜡后水化,经温室孵育15 min后,采用磷酸盐缓冲液(PBS)冲洗骨髓切片3次,每次2 min,滴加一抗(兔抗人IL-8单抗、鼠抗人CD56单抗),于37 ℃孵育2 h;(2)用吸水纸擦干切片后滴加聚合物辅助剂,于室温下孵育20 min;(3)滴加辣根酶标记的二抗(羊抗兔IgG),于室温下孵育20 min,采用PBS冲洗骨髓切片3次,每次2 min,经二氨基联苯胺染色后清洗切片;(4)经苏木精复染、脱水、封固后,于显微镜下进行观察。
1.3评价标准[8]随机选取10个高倍视野(×400)进行观察,每个视野计数100个细胞。细胞阳性表达评分:阳性细胞占比<10%计0分,阳性细胞占比10%~25%计1分,阳性细胞占比>25%~50%计2分,阳性细胞占比>50%计3分。细胞染色强度评分:无染色计0分,呈淡黄色计1分,呈黄色或棕黄色计2分,呈棕褐色计3分。以细胞阳性表达评分与细胞染色强度评分之和为总分,总分≤1分为阴性(-),总分2~3分为弱阳性(+),总分4~5分为中强阳性(++),总分≥6分为强阳性(+++)。

2 结 果
2.12组骨髓组织中IL-8、CD56表达情况比较 与对照组比较,MM组骨髓组织中IL-8和CD56的阳性表达率明显更高(P<0.05),见表1。

表1 2组骨髓组织中IL-8、CD56表达情况[n(%)]


表2 IL-8、CD56与MM患者临床特征的关系
2.3IL-8和CD56对MM的诊断效能 根据浆细胞表面免疫表型表达情况对MM进行诊断,以1-特异度为横坐标,以灵敏度为纵坐标,绘制IL-8及CD56诊断MM的ROC曲线,结果显示,IL-8单独检测诊断MM的AUC为0.788(95%CI:0.621~0.907,P=0.027),灵敏度为87.43%,特异度为80.15%;CD56单独检测诊断MM的AUC为0.754(95%CI:0.596~0.879,P=0.041),灵敏度为85.03%,特异度为77.93%;IL-8和CD56联合检测诊断MM的AUC为0.836(95%CI:0.711~0.953,P=0.008),灵敏度为91.14%,特异度为83.29%,见图1。
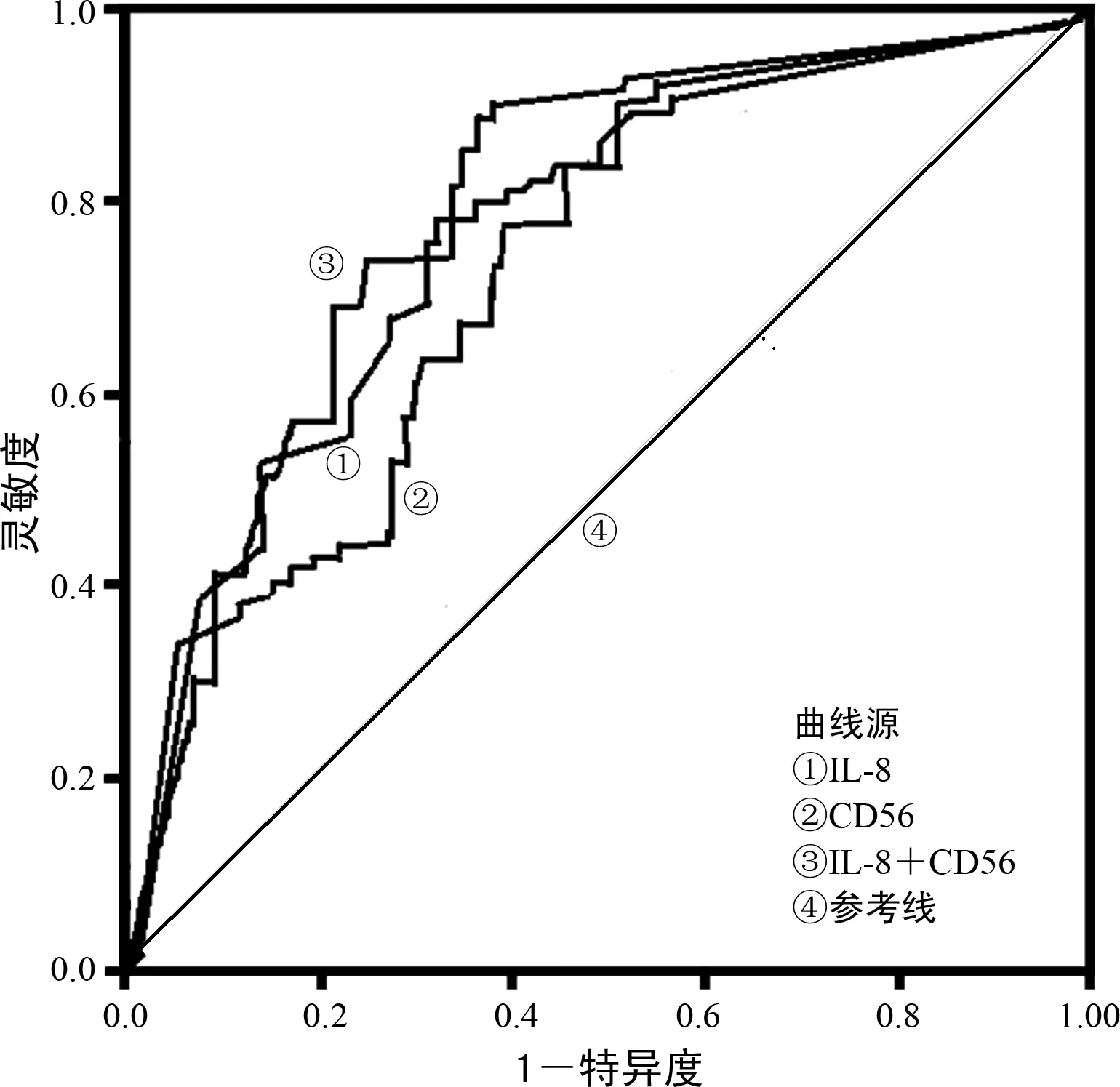
图1 IL-8、CD56单独及联合诊断MM的ROC曲线
3 讨 论
MM患者常伴发肾功能异常、骨骼受损、免疫功能低下等症状,目前,临床对于该病的治疗,虽可改善患者预后,但完全治愈较为困难[9]。临床资料显示,MM患者存在B、T细胞免疫缺陷,尤其是在B细胞向浆细胞分化过程中,存在细胞膜表面Ig、表面抗原大量丢失现象[10]。CD56为跨膜Ig,其在细胞的生长、迁移过程中发挥重要作用[11]。有研究报道,CD56在MM肿瘤细胞中表达水平较高,可能成为髓外病变的预测指标[12]。IL-8为炎症趋化因子,临床资料显示,IL-8表达于MM患者骨髓基质细胞中,可诱导骨髓瘤细胞趋化[13]。
本研究发现,与对照组比较,MM组骨髓组织中IL-8和CD56的阳性表达率明显更高(P<0.05),提示IL-8和CD56在MM患者骨髓组织中呈高表达。通过分析IL-8和CD56与MM患者临床特征关系,本研究发现,不同D-S分期的MM患者骨髓组中IL-8、CD56的阳性表达率不同,Ⅱ期和Ⅲ期MM患者骨髓组织中IL-8、CD56的阳性表达率均高于Ⅰ期(P<0.05),Ⅲ期MM患者骨髓组织中CD56的阳性表达率高于Ⅱ期(P<0.05),提示骨髓组织中IL-8、CD56阳性表达率随MM的D-S分期增高而升高。分析其机制可能为:(1)IL-8可能通过影响骨髓瘤浆细胞增殖及骨髓环境,刺激浆细胞繁殖、迁移;(2)CD56可能在骨髓瘤细胞分化过程中脱落,致使骨髓瘤细胞与基质细胞不能黏附,骨髓瘤细胞进入血浆,致骨髓瘤细胞转移。陈思衍等[14]研究发现,MM患者骨髓组织中IL-8的阳性表达率较高,且骨髓瘤分期越高,IL-8阳性表达率越高。张彩霞等[15]研究报道,CD56在MM细胞表面呈阳性表达。孙欢等[16]研究发现,CD56的表达与MM患者临床分期有关。以上研究结果提示,IL-8和CD56对评估MM的病情变化、临床分期等具有一定参考价值。
本研究显示,IL-8和CD56联合检测诊断MM的AUC为0.836,高于IL-8、CD56单独检测诊断MM的0.788、0.754,提示IL-8和CD56联合检测诊断MM的效能更高,IL-8、CD56可作为MM的临床诊断评价指标。黄垚等[17]研究报道,CD56与MM的免疫特征、临床分期有关,其可作为评价MM Ig分型的指标。
综上所述,MM患者骨髓组织中IL-8、CD56的阳性表达率较高,且其表达与MM的D-S分期有关,IL-8和CD56联合检测可用于MM的临床诊断。
