柏木人工林林窗位置对香椿细根分解及土壤真菌群落多样性的影响
2022-04-25李德会李相君吴庆贵尹海峰李贤伟
李德会,李相君,吴庆贵,尹海峰,李贤伟,*
1 绵阳师范学院生态安全与保护四川省重点实验室,绵阳 621000
2 四川农业大学林学院,成都 611030
土壤真菌是森林生态系统中凋落物的主要分解者,作为植物-土壤互作效应的媒介之一[1],在有机碳降解、N/P转换等过程中发挥着重要作用[2—3]。真菌生态功能的实现取决于其群落多样性和功能动态,这一过程既与真菌自身相关,也受环境干扰的影响[1—3]。在大尺度空间背景下,土壤真菌群落主要受温度和海拔梯度影响[4—5];土壤理化性质等因子决定着真菌物种生存环境,亦对群落组成和多样性产生具体影响,使群落呈现出小空间尺度异质性[6—8]。
细根是植物水养吸收的主要器官,其生命周期短,周转速率快[9—10]。细根分解是植物与土壤进行养分物质循环和能量流动的重要进程[2]。在凋落物底物分解过程中真菌群落经历了一系列类群或种群变化[11—12],其群落结构和多样性在有机质分解[13]、植物生长[1]、促进养分循环和能量流动等生态过程中均发挥着重要作用[3,11,14—15]。
林窗是森林群落中由于自然灾害和群落演替导致优势树种死亡后在林冠层形成的空隙[16—17]。林窗(包括人工林窗)形成后会导致微地形、光环境、温湿度、土壤养分和水分状况等生态因子发生改变,其对土壤生态过程的调控机制较为复杂[18—20]。林窗内不同位置亦对土壤真菌群落特征和功能产生影响[3,6]。Yang等[21]采用磷酸脂肪酸方法发现土壤微生物活性从林窗中心到郁闭林下逐渐增强,相同尺度林窗内边缘位置微生物量在碳氮含量上显著高于内部[22],土壤微生物量和功能多样性[23]、土壤真菌类群聚集和网络关系也存在位置梯度效应[6]。较多研究证实林窗形成后土壤理化性质异质性对土壤真菌群落产生影响,但对于参与细根分解的土壤真菌如何响应林窗内不同位置差异的研究鲜见报导。
本文研究区现存柏木(Cupressusfunebris)人工林系20世纪80年代在川中丘陵区营造的“长江防护林一期”工程,成林后缺乏管理措施,树种单一,生态系统功能低下,呈现出退化趋势,严重影响了森林综合效益的发挥[24—25]。在我国生态文明发展的整体框架下,采用科学措施对柏木人工林开展林分结构调控与功能提升,已成为当下重要的科学议题。香椿(Toonasinensis),芸香目楝科香椿属落叶乔木,对环境条件耐受性好,兼具食用药用价值,是柏木人工林林分结构调整引入的主要乡土树种。本文以川中丘陵区30a生柏木人工林中2014年开设的200 m2林窗为研究对象,探讨林窗内位置异质性对香椿细根分解2a时土壤真菌群落多样性变化的影响,了解土壤地下生态进程对林窗位置异质性的响应,探索林窗式干扰对柏木人工林养分物质循环的微生物影响机制,为实现森林质量精准提升提供理论依据。
1 材料与方法
1.1 研究区概况及试验样地设置
研究区位于四川省德阳市旌阳区和新镇,地处川中丘陵区北部边缘,属四川盆地中亚热带湿润季风气候区,现存柏木人工林平均树高6.8 m、平均胸径8.2 cm、郁闭度>0.8,单位蓄积量不足50 m3/hm2,远低于全国平均水平(83.63 m3/hm2),属于典型的低产低效林[17]。
试验样地位于和新镇永兴村(104°25′30″—104° 25′45″E,31°04′08″—31°04′15″N),海拔510—530m,土壤类型为紫色土。2014年3月在研究区内选择位于山体中坡位、坡向西南向、坡度20°—25°、立地条件相同、属同一造林批次、生长状况及经营管理水平基本一致的柏木林进行林窗式疏伐改造后植入3a生香椿(供试样地香椿现存状况见表1),各林窗间隔一个树高(6 m)以上[25]。林窗为南北向长、东西向短的近似椭圆形,两轴相交点为中心,沿中心点向外拓展3/4区域为边缘区(图1)。林窗面积计算A=πLW/4,分别设定为200 m2(20 m×14 m)、150 m2(18 m×11 m)、100 m2(15 m×9 m)、50 m2(12 m×6 m)。为探索香椿细根分解2a时土壤真菌群落多样性对林窗内位置异质性的响应,以研究区内最大尺度林窗(200 m2)对象,设置重复样地3个,每个样地内设定中心位置(Gap center, GC)、边缘位置(Gap boarder, GB)3个,以未开窗的柏木郁闭林(Closed canopy, CC)为对照。

表1 200 m2林窗内不同位置上香椿现状表
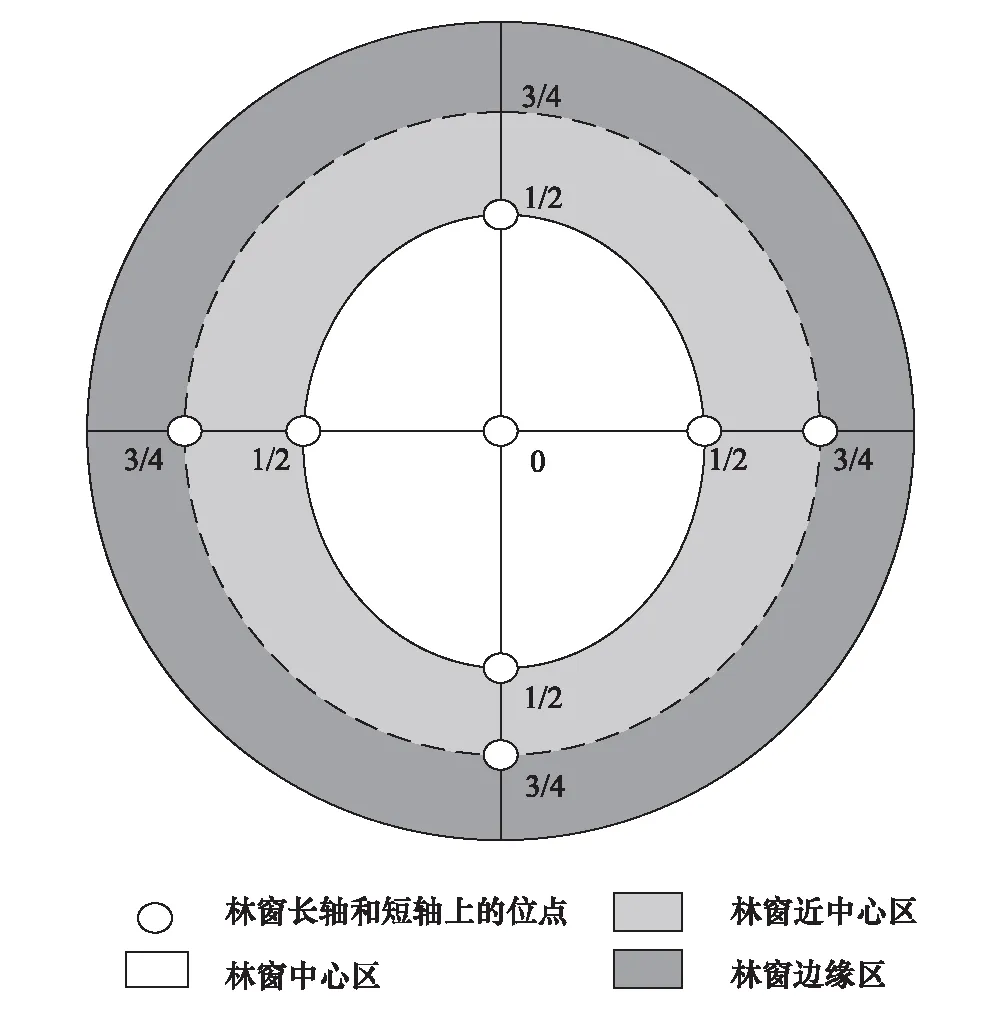
图1 柏木人工林林窗内位置分区示意图
1.2 野外试验设计及样品采集
2016年8月,使用根钻挖掘法获取5a生香椿细根样品(直径<2 mm),洗净后于70 °C下烘干至恒重,剪成<2 cm的小段充分混合称取4 g,放入10×20 cm、孔径100 μm的尼龙分解袋中并封口和标记。11月在引入香椿的试验林窗内选取中心、边缘位置和柏木纯林各3个样点,每个样点埋设4个分解袋。通过计算单位面积土层细根分布量,于每个分解袋内装入原位土壤250 g与细根样品充分混合后回埋至细根主要分布土层,观察分解2a时林窗位置对细根降解速率及土壤真菌群落多样性的影响。2018年11月,采集分解袋内土壤样品,使用50 mL无菌离心管装取样品后于4 ℃保存并快速带回实验室(中国科学院成都生物所微生物分子与生理生态实验室)进行高通量测序分析,剩余土壤样品作理化性质分析,并对香椿细根样品进行质量损失及养分含量测定。
1.3 土壤理化性质和细根养分含量测定
土壤温度(ST)、土壤含水量(SWC)测定采用Thermochron iButton Device(DS1921-G, Maxim,Integrated, San Jose, CA, USA)连续记录;采用电位法测定土壤pH值;采用重铬酸钾氧化容量法测定土壤有机质、植物组织碳含量;采用凯氏定氮法测定土壤、植物组织全氮含量;采用碳酸氢钠-盐酸浸提——钼锑抗比色法测定土壤速效磷;采用原子分光光度计法测定组织钙、镁含量(LY/T1271—1999);木质素、纤维素、半纤维含量测定采用“范式中性洗涤纤维法”,采用重铬酸钾硫酸亚铁加热法测定洗涤后的木质素含量,采用重铬酸钾硫酸亚铁滴定法测定纤维素含量,采用碘铜法测定半纤维含量。香椿细根干物质残留率计算:W=Xt/X0×100%,式中W为细根残留率(%),Xt为分解t阶段香椿细根残留质量(g),X0为初始干物质量(g)。细根分解率:Dw=1-W;养分元素质量残留率:N=Nt/N0×100%=(Xt×Ct)/(X0×C0)×100%,式中N表示养分元素质量残留率(%),Nt为分解t时间养分元素储量(g),N0为初始养分元素储量(g),Ct为解t时间养分元素浓度(%),C0为初始养分元素浓度(%)。细根养分元素释放率:DN=1-N。
1.4 土壤真菌DNA提取、扩增、测序
采用MO BIO强力土壤DNA提取试剂盒(MO BIO Laboratories, Carlsbad, CA, USA)提取土壤样本基因组;以稀释后的基因组DNA为模板,使用带Barcode的特异引物和高效高保真的酶(TaKaRa, Dalian)进行PCR扩增,使用正向引物ITS4(5′|TCCTCCGCTTATTGATATGC- 3′)和反向引物gITS7F(5′| GTGARTCATCGARTCTTTG- 3′)对真菌ITS2区段进行PCR扩增(扩增体系包括:PCR MIX12.5μL,ITS4引物1 μL,gITS7引物1 μL,DNA1 μL,ddH2O9.5 μL;PCR反应条件为94 ℃预变性5 min,34个循环:“94℃变性30 s,56 ℃退火30 s,68℃延伸45 s,72℃终延伸10 min”,两次PCR扩增反应后混合;使用1%的琼脂糖凝胶电泳检测PCR产物,胶回收试剂盒(DNA Gel Extraction Kit)回收目的条带,使用Nanodrop测定浓度和质量,根据PCR回收产物浓度进行等量混样;TruSeq®DNA PCR|Free Sample Preparation Kit建库试剂盒进行文库构建并定量,文库合格后由中科院成都生物所环境基因组高通量测序平台使用MiSeqTM测序仪(Illumina, San Diego, CA, USA)上机测序。
1.5 生物信息数据统计与分析
Paired-end序列拼接:使用FLASh(V1.2.7, http://ccb.jhu.edu/software/FLASH/)对每个样品reads进行拼接获取原始Tags数据(Raw Tags);序列质量控制:将拼接后原始Tags严格过滤处理得到高质量的Tags数据(Clean Tags,参照QIIME V1.9.0,http://qiime.org/scripts/split_libraries_fastq.html的Tags质量控制流程),利用Usearch软件(v8.0,http://drive5.com/uparse/)检测嵌合体序列,去除后得到最终的有效数据(Effective Tags);聚类:使用QIIME对全部有效数据进行聚类(cd-hit方法),默认以97%相似性将序列聚类成为OUT(Operational Taxonomic Units),选取OTU出现频数最高的代表性序列,去除只有1条序列的Singleton;利用QIIME对OTU代表序列进行物种注释(https//unite.uc.ee);使用FUNGuild进行真菌生态营养模式预测;使用ggplot2绘制影响因子在林窗位置间的变化情况;采用非参数多元方差分析(PERMANOVA/Adonis)、随机置换(Randomized Permutation Test)检验不同位置微环境异质性和环境因子差异情况;利用QIIMEv1.9计算α多样性指数:Chao1指数(Chao1)、观测到的OTU数(Observed OTUs)、香农指数(Shannon)、辛普森指数(Simpson),采用随机置换检验α多样性指数在不同位置变化是否显著;通过多元分散置换(Permutational Test of Multiyariate Dispersions, PERMDISP,999次迭代)、非参数多元方差分析(Adonis)、相似性分析(ANOSIM)、多响应置换过程分析(Multi Response Permutation Procedure, MRPP)、主坐标分析(PCoA)检验真菌群落β多样性差异性对林窗位置的响应;采用非丰度加权分析(unweighted UniFrac)描述各降解阶段不同位置间特有种和共有种,使用Mantel test(partial Mantel test)、冗余分析(Redundancy analysis, RDA)检测生物和非生物因子与真菌群落组成的相关性,并计算相关性系数,判断驱动真菌群落组成变化的关键因子及影响程度。
2 结果与分析
2.1 不同林窗位置土壤理化性质和细根养分含量变化
3个供试林窗位置之间存在显著的空间异质性(P<0.001)(图2),土壤理化性质在不同位置上差异显著(P<0.05)(表2)。土壤温度从GC到CC位置逐渐降低,土壤湿度则呈上升趋势;受研究区成土母质影响,不同位置土壤pH值均在8.0左右;观察到GB位置土壤速效磷、土壤有机质、土壤全氮含量最高,CC位置最低。
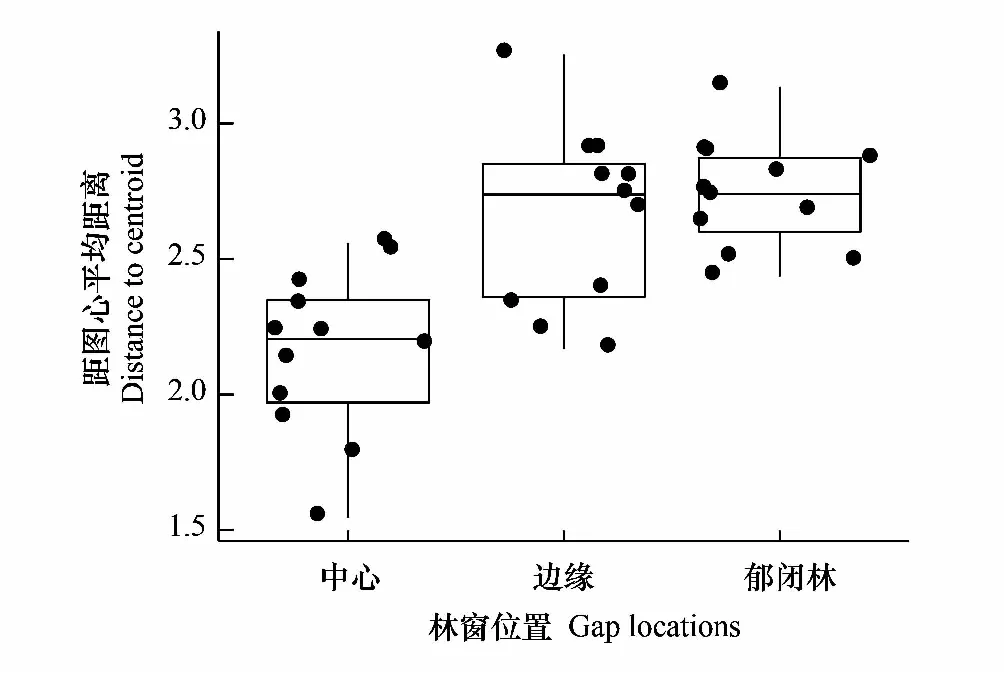
图2 多元置换分析显示林窗位置环境差异
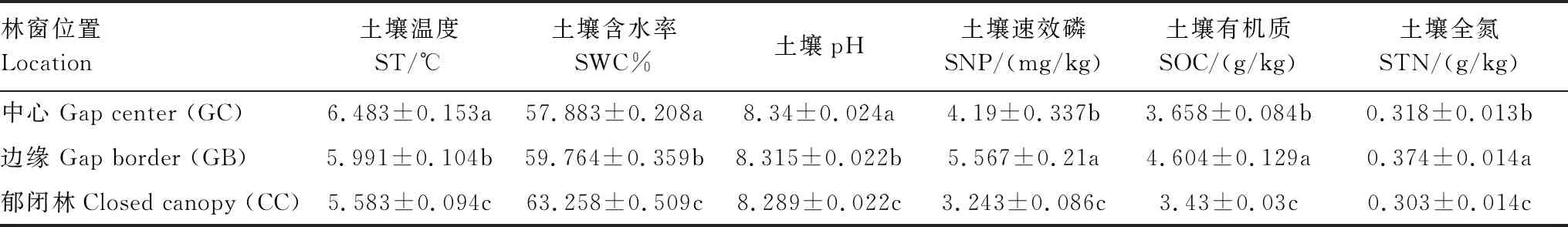
表2 土壤理化性质在林窗位置间的变化
观察到3个位置上香椿细根分解速率各异,GB位置降解速率最高,质量损失率为40.86%,GC和CC位置降解速率分别为27.89%和27.48%,GB位置细根降解速率显著高于GC和CC位置(P<0.05)。细根组织中固定(储存)的各类养分元素含量伴随着降解过程的持续而改变,木质素、纤维素、半纤维素含量逐渐降低,碳、氮以积累为主,钙、镁则交替进行释放和积累(表3)。
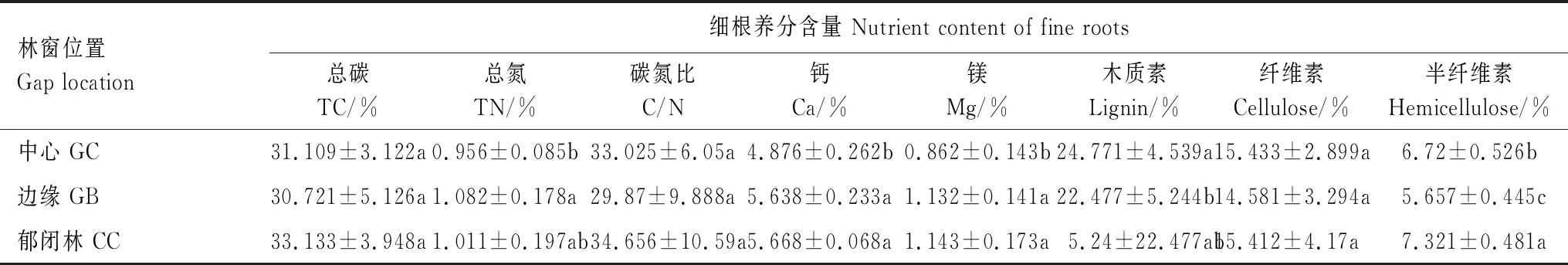
表3 细根养分含量在林窗位置间的变化
2.2 不同林窗位置土壤真菌类群构成
3个林窗位置细根样品中共检测出9684条真菌物种OTUs,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota)及球菌门(Glomeromycota)。在GC位置样品中检测出5门、19纲、62目、187属真菌;在GB位置样品中检测出5门、17纲、62目、198属真菌;在CC位置检测出5门、18纲、59目、192属真菌。子囊菌门和担子菌门是3个供试位置的优势真菌类群(图3),但在门水平层次不同位置间真菌物种构成及相对丰度差异不显著(R2=0.217,P=0.216;R2=0.039,P=0.814;R2=0.074,P=0.477)。基于FUNGuild进行真菌群落营养模式预测显示,腐生类、病原类营养模式在不同位置上呈现出明显差异(表4),腐生类真菌相对丰度从GB到CC呈降低趋势。在目水平上相对丰度值前11的类群中,散囊菌目(Eurotiales)、肉座菌目(Hypocreales)、粪壳菌目(Sordariales)、刺盾炱目(Chaetothyriales)及伞菌目(Agaricales)是供试位置上的优势类群(图3),其相对丰度存在位置差异,Geoglossales、圆盘菌目(Orbiliales)目真菌类群相对丰度在GB和GC之间差异显著,小囊菌目(Microascales)、Sordariales、瓶口衣目(Verrucariales)真菌在GC和CC位置间具有显著差异(P<0.05);Geoglossales、Orbiliales、Pleosporales目真菌相对丰度在GC和GB间有显著差异(P<0.05)。如图3所示,圆盘菌属(Orbilia)、曲霉属(Aspergillus)、枝顶孢霉属(Acremonium)、圆孢霉属(Staphylotrichum)、毛壳属(Chaetomium)属真菌相对丰度在GB和CC位置间存在差异显著(P<0.05),青霉属(Penicillium)、藤仓赤霉属(Gibberella)属相对丰度在GC和GB位置间存在显著差异;而在GC和CC位置,观察到Orbilia、Gibberella、Penicillium属真菌类群有显著的相对丰度差异。
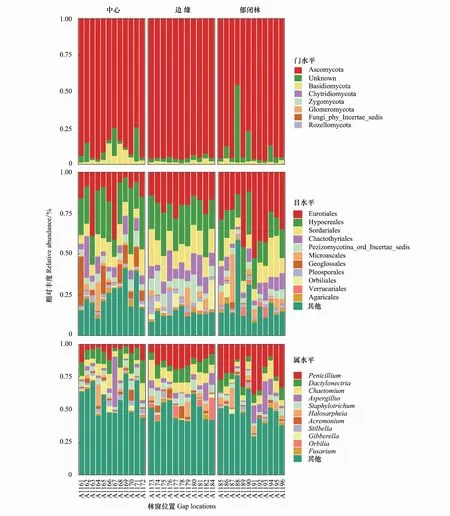
图3 不同林窗位置间真菌群落相对丰度组成
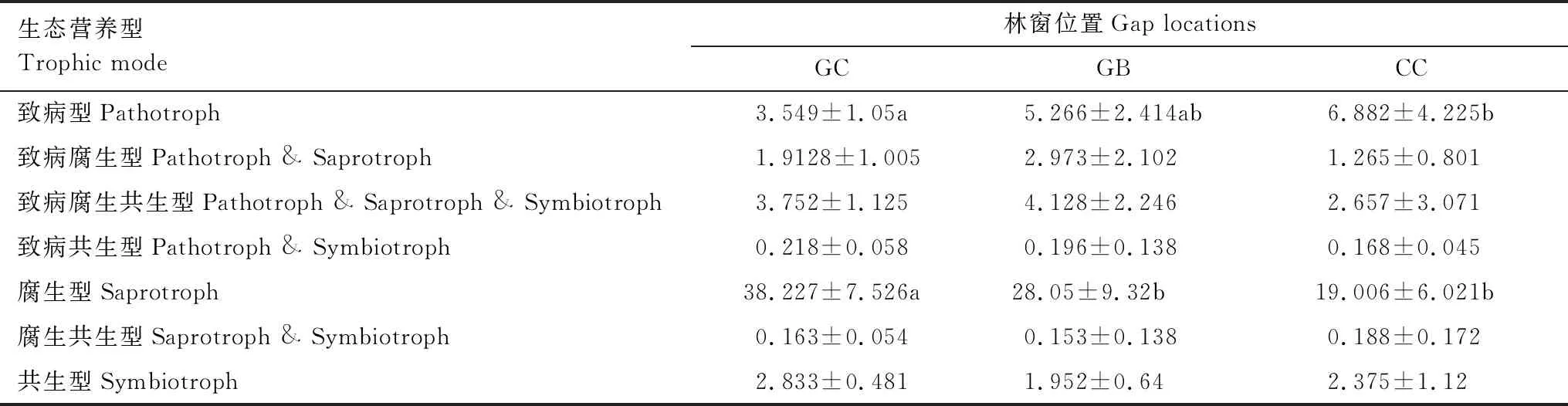
表4 不同位置真菌群落生态营养型相对丰度
非丰度加权分析(unweighted UniFrac)表明OTU水平真菌群落成员在不同林窗位置间的共有种和特有种均存在差异(图4)。在CC林窗位置的特有种数量最高(307),在GB林窗位置的特有种数量最低(187);3个林窗位置的共有种有855个,在GC和CC位置间共有种为250个,在GB和GC位置间的共有种数量最少(190)。
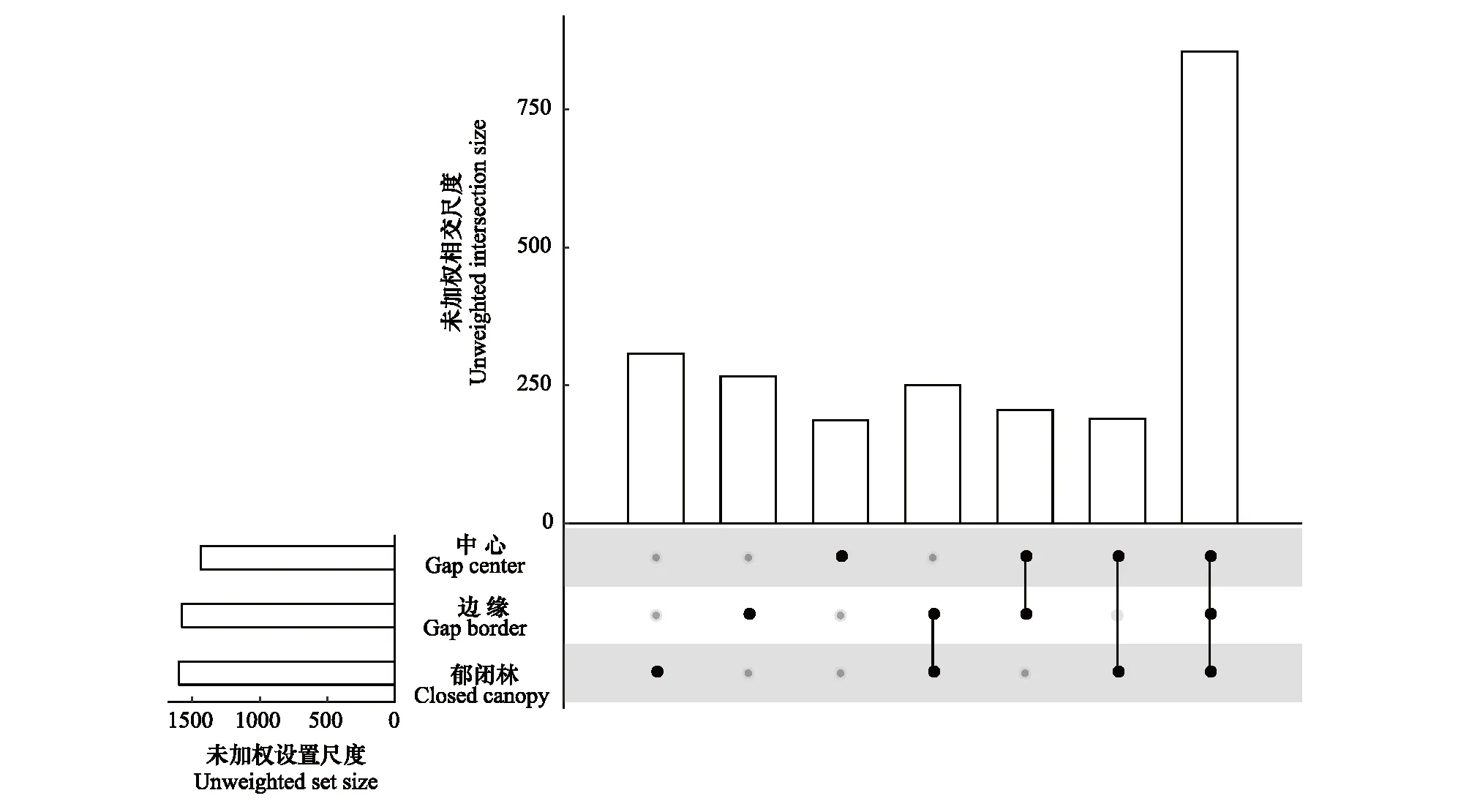
图4 不同林窗位置真菌群落共有种/特有种分布
2.3 不同林窗位置真菌群落α多样性变化及其与环境相关性
Spearman′s秩相关分析显示出3个林窗位置的真菌群落α多样性指数与影响因子之间的相关性(表5)。相对于植物养分含量,真菌群落α多样性指数与土壤理化性质之间具有较明显的相关性,STN与Simpon指数呈极显著正相关(P<0.01),SNP与Simpon指数、Shannon指数呈显著正相关(P<0.05)。表中数值代表生物和非生物因子对α多样性指数的影响程度,其中细根组织Ca含量对多样性指数影响程度最高。
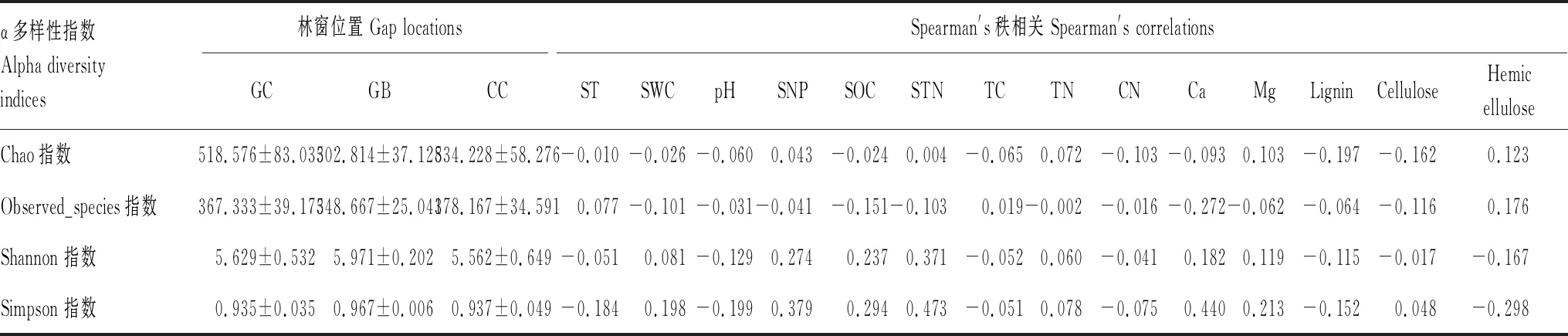
表5 不同林窗位置真菌群落α多样性指数与影响因子间的相关性
2.4 不同林窗位置真菌群落β多样性变化
使用多元分散置换分析(PERMDISP)检测发现,真菌群落β多样性在不同林窗位置间存在差异(图5)。GB位置β多样性最高、CC位置最低,意味着在GB位置的真菌群落异质化程度最高,而在CC林窗位置的真菌群落同质化程度较高,PCoA分析显示GC位置的真菌群落β多样性介于GB和CC之间(图5)。通过PERMANOVA、ANOSIM及MRPP分析发现(表6),在GB和CC、GC和CC位置间真菌群落构成均存在显著差异差,在GB和GC位置间真菌群落组成则无显著差异。
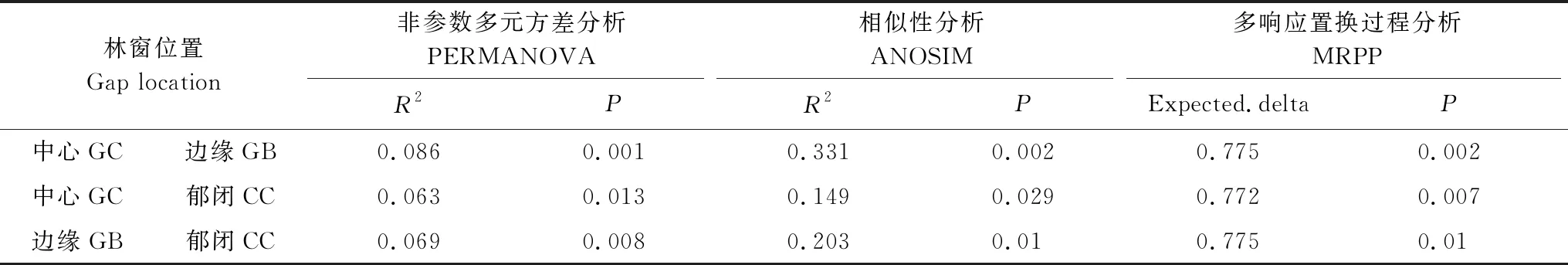
表6 真菌群落组成在不同林窗位置间差异性检验
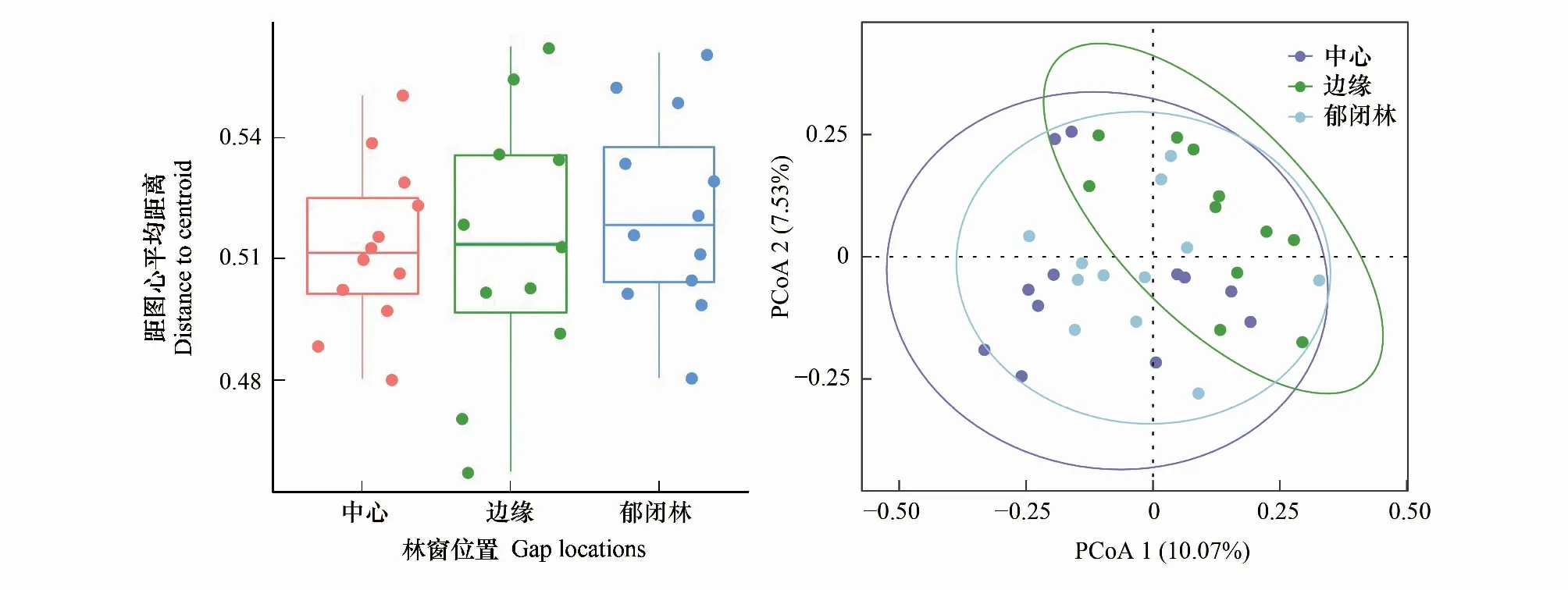
图5 不同林窗位置间真菌群落β多样性变化
通过Mantel test检验分析,发现大部分细根组织养分含量和土壤理化性质与真菌群落存在正相关关系(图6),C/N、ST及SWC与真菌群落呈显著相关(P<0.05),SNP、SOC、STN、TC与真菌群落有极显著相关性(P<0.01)。经partial Mantel test检验分析发现,当环境因子被单独控制时,仅有SNP、SOC、STN与真菌群落之间呈显著相关(P<0.05,STN:P<0.01)。
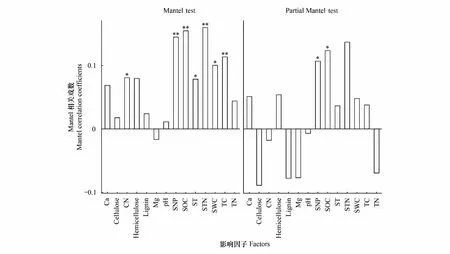
图6 环境影子对真菌群落影响(Mantel test,和偏Mantel test分析)
经冗余分析发现,较多环境因子对真菌群落的影响程度达到极显著水平(P<0.01),表明经过2a时间真菌群落对环境异质性的适应能力越来越强(图7)。土壤pH(R2=0.143,P=0.001)、ST(R2=0.52,P=0.001)是GC位置上重要的非生物影响因子;细根组织钙含量(R2=0.468,P=0.001)、半纤维素含量(R2=0.457,P=0.001)、木质素含量(R2=0.086,P=0.203)分别对CC林窗位置真菌群落产生主要影响;在GB林窗位置,SOC(R2=0.651,P=0.001)、STN(R2=0.607,P=0.001)是该位置真菌群落的重要影响因子。
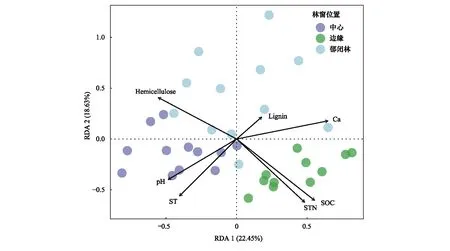
图7 不同林窗位置环境因子变化对真菌群落的影响(冗余分析)
3 讨论
3.1 不同林窗位置土壤理化性质的变化
大量研究表明,森林中一旦形成林窗,太阳辐射直接进入林窗内部,显著增加了林窗内近地面大气温度和土壤温度。本研究发现林窗内中心位置土壤温度显著高于林窗边缘和郁闭林下,这与大多数关于林窗位置对土壤温度的研究结果相一致[6,23,26]。受太阳辐射、降水、蒸发等因素的影响,土壤湿度在林窗内和郁闭林下存在明显差异,土壤湿度亦会随林窗尺度、位置而发生改变。有研究发现林窗中心土壤湿度最低,郁闭林下土壤湿度最高,这主要与郁闭林下植被生长有关[6]。受研究区海拔及成土母质的影响,土壤pH值变化对林窗的响应不及土壤温湿度积极[19,27]。土壤中营养元素主要来自于凋落物的分解,本研究中SOC、SNP、STN含量在GC和GB林窗位置存在显著差异,这是由于林窗形成后有效改善了林地的光照和水分条件,温度升高可促进土壤养分矿化、提高养分可利用性和微生物活性,从而促进凋落物的分解,增加土壤养分[6,28]。
3.2 不同林窗位置香椿细根降解速率和养分释放变化
细根分解是植物与土壤进行能量流动和物质交换的复杂生态过程,既有物理和化学作用(如水溶性物质的淋溶作用),也有生物因素(如土壤动物啃食、土壤微生物降解)。细根通常遵循渐进衰减模式,初期主要是一些水溶性物质(如蔗糖、淀粉)的淋溶作用,从而导致细根质量快速损失[29—30];伴随着分解时间的持续,纤维素、单宁、木质素等难溶性物质大量存在,细根分解速率放缓,这些难分解物质只能由土壤微生物中部分具有胞外酶特征的真菌类群所分解[31];当木质素等物质被降解后,细根组织在生长中储存的养分会完全释放到土壤中,这又是一个质量快速损失的过程[30]。
环境条件、基质特征和降解者降解能力是细根分解的三大主要驱动因素。本研究发现,在3个供试林窗位置的香椿细根降解速率存在显著差异,GB位置细根降解速率显著高于GC和CC位置(P<0.05)。与郁闭林下相比,林窗形成后改变了林内水热条件和降解者的群落结构[20]。林窗内不同位置间土壤理化性质的异质性,对土壤微生物活性[32]、种类分布[33]产生影响,从而影响真菌类群的生长[34—35]和竞争[36]等生命活动,最终决定着根系的降解速率和途径[31],进而导致林窗内不同位置的细根降解速率存在显著差异。林成芳等[37]分析认为,细根降解主要受底物质量、土壤温度、水分及微生物等的影响。细根干物质残留率与细根中纤维素和木质素的浓度呈正相关[18]。
3.3 不同林窗位置真菌群落结构的变化
林窗的形成及其位置对真菌群结构存在不同程度影响。本研究发现在3个供试位置的优势真菌类群均为Ascomycota门和Basidiomycota门,包含大量具有不同环境适应性的物种[38—39]。Ascomycota门包括大量腐生和寄生营养类型真菌,在土壤中以腐生营养型为主[38,40]。Glomeromycota门真菌主要以丛枝菌根和内生菌根功能与植物形成共生关系[41],从而在根系养分吸收[42]、植物生长等过程中起到重要作用。本研究将分解袋埋设于0—15 cm土层中,这也是香椿细根主要分布区域,在2a时间尺度下部分活细根穿透尼龙网袋,故而在分解袋土壤中检测到少量球囊菌门真菌类群。真菌营养模式可以反映群落组成的变化,Eurotiales和Agaricales目是土壤中重要的腐生真菌类群,对植物残体中木质素和纤维素具有较强的降解能力。Chaetothyriales目真菌类群多为植物寄生菌[43],Microascales、Sordariales及Hypocreales目真菌具有腐生性和病理性两种营养类型[6],其相对丰度在不同林窗位置呈现差异变化。Sordariales目真菌类群属于寡营养策略者[44],在林窗边缘位置上丰度较高;Microascales目是林窗中心的主要腐生性真菌类群。Penicillium、Aspergillus、Chaetomium、Dactylonectria及Staphylotrichum属真菌是3个林窗位置的优势真菌类群。Penicillium属真菌通过降解凋落物中有机质实现其对纤维素的降解功能[45—46],Aspergillus属真菌类群则通过产生能够降解木质纤维素的酶广泛参与植物凋落物的降解过程[46—48]。Chaetomium、Dactylonectria及Staphylotrichum属真菌在各林窗位置的丰度值也较高,Chaetomium属真菌在纤维素降解过程中具有重要生态功能,其常出现在凋落物降解的早期或中期[49],而Dactylonectria属真菌是重要的植物病原体类群[50]。
3.4 不同林窗位置的真菌群落多样性
经过2a的试验周期研究,未发现不同林窗位置间真菌群落α多样性存在显著变化趋势。与在海拔梯度[51]、土层深度[15]等大空间尺度下的研究结论有所不同,真菌群落α多样性对环境异质性具有一定程度的抵抗力[52],通过这种能力阻止真菌群落中α多样性在不同环境的损失,使群落内物种丰富度和均匀度得以维持[8]。真菌群落α多样性指数在不同林窗位置间无显著差异,但土壤理化性质和细根养分含量却对真菌群落α多样性指数存在差异性影响。由于存在太阳辐射、降水、植被类型的差异,不同林窗位置的土壤理化性质的不同则导致微环境异质性,从而对真菌群落β多样性产生影响,GB林窗位置真菌群落β多样性相对较高,CC林窗位置最低。真菌群落β多样性大小表征群落组成的同质化/异质化程度,在小空间尺度下更具有应用效果[53]。研究发现边缘受到的太阳辐射强度介于林窗中心和郁闭林下之间,其拥有更适宜的土壤温湿度和风强度,从而对真菌群落组成结构产生影响[6]。与环境因子的相关性分析显示,土壤物理性质对真菌群落β多样性的影响较大,土壤温湿度调节地下生态系统中香椿细根降解、菌丝扩展、子实体形成[54]、孢子萌发[55]和释放[35]等过程。GB林窗位置适宜的温湿度为真菌类群生长和繁殖提供了良好条件,从而导致拥有最高的真菌群落异质化特征,符合边缘效应追踪物种资源需要理论[56]。特有种/共有种数量可以解释真菌群落β多样性“量”的变化[54],GB林窗位置特有种数量最少,意味着该位置环境条件对真菌群落有着较宽幅度的生态位支持力度。GC林窗位置特有种数量最高,相对于其它林窗位置,其土壤温度较高湿度较低,这可能会增加真菌群落的生存压力[3],只有部分对恶劣环境具有较强耐受能力的真菌类群可以生存[57]。
3.5 环境因子对真菌群落多样性的影响
真菌属于异养生物[5],其生长和繁殖依靠土壤养分有效性,环境通过决定/选择过程影响真菌群落的组成和结构[53],较多研究就环境选择对真菌群落的聚集和结构进行了阐述[6—8]。太阳辐射使得GC林窗位置土壤温度较高湿度较低,由于缺乏凋落物[58]和根系分泌物输入[59],SNP、STN、SOC等土壤养分含量和有效性在GC林窗位置相对较低。经Mantel test和partial Mantel test分析显示,pH、SWC、ST、SNP、STN等土壤理化性质对真菌群落β多样性影响较大。土壤pH、SWC、ST对土壤微生物群落存在重要影响[3,57,60]。Liu等[4]对中国西南地区不同海拔高度山脉真菌群落多样性的研究发现,土壤pH值是真菌群落在海拔高度梯度间呈高度多样性变化的主要驱动因子。真菌在pH5—9中均能生长,其对土壤pH值的适应范围较细菌广;Shen等[61]和于天赫等[62]的研究也证实了土壤pH值对真菌群落多样性的影响,Lauber等[63]发现土壤pH值越高,Ascomycota门丰度相应越高。
Peltoniemi等[57]通过田间控制试验研究了模拟增温和降低地下水位对土壤真菌群落的影响,发现增温对真菌群落影响不大;而将模拟增温调整至+8 ℃时,升温处理显著改变了降解真菌种类的组成和结构,提高了群落多样性[64]。GC位置土壤温度最高而群落多样性最低,这是由于研究中GC位置土壤增温幅度小,而控制试验一般会设置较大的温度梯度差异。SWC通常与ST协同作用,经partial Mantel test分析发现,当土壤理化因子被单独控制时,SWC是真菌群落多样性变化重要的驱动因子,这与Zhang等[65]、Yergeau等[66]和Chu等[67]研究结果一致。尽管有研究显示大部分真菌偏好湿润环境[3,16,57],但适中的湿度更适合真菌群落发展[6,57],这也解释了GB位置真菌群落β多样性相对较高的原因。
土壤养分含量差异也会影响真菌群落,林窗中土壤养分含量变化既受季节影响,也受植被生长影响[18]。不同林窗位置间土壤养分循环各异,植物降解过程中碳、氮、磷、钾等含量在不同林窗位置间存在显著差异[32],通常GC位置由于植物养分输入量和根际分泌物量较GB和CC低,导致GC位置土壤养分含量较低[59]。真菌生长依靠土壤养分有效性,GC位置养分有效性尤其是SNP较低,形成了真菌生长相对恶劣的环境条件,仅部分适应类群可以生存,这对真菌群落来说意味着生存压力加大[3,57],这个结论解释了真菌群落β多样性在不同位置间变化的原因。
4 结论
人工林窗形成后受太阳辐射和降水等因素的影响,林窗内不同位置间微环境存在异质性,从而使植物细根降解速率在各位置间存在差异,边缘位置降解速率显著高于林窗中心和郁闭林。真菌群落构成及丰度变化因林窗位置不同而存在差异,优势真菌类群对细根降解过程起着重要的调控作用,林窗边缘对真菌种类组成及优势类群丰度变化的影响最为突出,意味着真菌群落和环境因子之间存在密切的反馈机制。林窗位置对真菌群落α多样性无显著影响,但对真菌群落β多样性存在显著影响,土壤含水量、pH值及SNP含量在林窗位置间的异质性对真菌物种组成和群落多样性产生重要影响。林窗位置不同导致的土壤理化性质的异质性对β多样性存在积极影响。适度考虑林窗所表现的生态效应,深入探究林窗式改造对真菌群落特征的作用机制,清晰认识林窗改造与柏木人工林地下物质循环的关系,可为柏木人工林生态服务功能提升的实践提供理论依据。
