冻融循环对金川泥炭沼泽土壤微生物量及群落结构的影响
2022-04-25孙嘉鸿董彦民王升忠汪祖丞徐志伟
孙嘉鸿,郭 彤,董彦民,王升忠,2,3,4,汪祖丞,2,3,4,徐志伟,2,3,4,*
1 东北师范大学地理科学学院,长白山地理过程与生态安全教育部重点实验室,长春 130024
2 东北师范大学泥炭沼泽研究所,长春 130024
3 东北师范大学长白山湿地与生态吉林省联合重点实验室,长春 130024
4 东北师范大学国家环境保护湿地生态与植被恢复重点实验室,长春 130024
土壤的冻融作用作为土壤内部的重要物理过程,是全球中高纬度及高海拔地区普遍存在的自然现象。冻融过程会改变土壤结构、破坏土壤和凋落物中微生物及动植物残体细胞,促进土壤底物和养分的释放[1],是影响土壤碳氮等元素生物地球化学过程的重要因素。全球变暖将会导致土壤的冻融频率变化[2]、冻融强度改变[3]和冻融时间缩短[4],这必将会引起土壤微生物及其参与的土壤碳、氮循环过程的变化[5]。因此,冻融作用对土壤微生物的影响已经成为全球关注的热点问题[6—7]。
土壤微生物是生态系统中的重要生物组分,在土壤有机质分解、矿化及营养元素循环等方面发挥着重要作用[8—9],并对环境变化十分敏感[10]。土壤微生物量碳、氮(MBC和MBN)表征土壤中所有活体微生物中碳和氮的总量,是反映微生物量大小的重要指标[11]。磷脂脂肪酸(PLFA)是生物活细胞的重要膜组分的构成成分,随着微生物死亡而迅速分解,用以表征活体微生物,并可以提供微生物群落结构和组成的信息。研究表明,随着冻融次数的增加,土壤微生物碳、氮含量呈现降低、先降低后升高或者先升高后降低的变化趋势[12—15]。同时,冻融作用通过致死作用或者降低可溶性养分含量来改变土壤微生物群落结构[16—18]。微生物死亡后细胞破裂释放出有机质为存活微生物提供碳源与能量[19—20],适应冻融环境的微生物群占据群落的优势地位,微生物群落结构随即改变。然而,有关冻融作用对土壤微生物的影响更多的集中在对土壤MBC、MBN的影响,且不同冻融作用对不同土层的MBC、MBN的影响存在差异,并较少关注冻融循环过程中土壤不同类型微生物群落数量及结构的变化。因此,冻融过程对土壤微生物群落的变化机制尚不明确。
尽管泥炭地占地面积不到陆地表面积的3%,但其碳储量却占全球土壤碳储量的1/3[21—22],是陆地生态系统最重要的碳库之一。随着全球变暖,季节性冻土区冻融过程的改变对势必会对泥炭沼泽土壤碳循环过程有重要影响。长白山地位于东北及华北北部温带中-深季节冻土亚区,是我国泥炭沼泽最主要的分布区之一,冻融作用频繁。本文以金川泥炭沼泽为研究对象,由于不同深度土壤受冻融的影响不同,分别在采样地采集表层(0—15 cm)和深层(15—30 cm)的土壤样品,通过室内冻融模拟实验,测定土壤微生物碳、氮含量及磷脂脂肪酸含量,揭示不同冻融模式下泥炭沼泽土壤微生物量及微生物群落结构的变化特征,以其为全球气候变化背景下泥炭沼泽冻融过程中碳循环的微生物机制研究提供科学依据。
1 材料与方法
1.1 研究区概况
金川泥炭沼泽(42°20′42.58″N—42°21′9.27″ N,126°21′48.61″E—126°22′37.74″E)位于吉林省通化市辉南县金川镇,是第四纪火山口湖发育的泥炭地,海拔为613—616 m。金川泥炭沼泽的泥炭层厚度一般为4—6 m,最厚可达9 m。该区属于温带大陆性季风气候区,年平均气温为3.3℃,7月最高平均气温22.4℃,1月最低平均气温-18℃。初霜期在9月中旬,中霜在5月下旬,年降水量为1054 mm。泥炭地为季节性积水,积水约为10 cm,降水集中在7—8月,无霜期约为134 d,气候湿冷。泥炭沼泽内主要植物群落类型为臌囊薹草群落和油桦群落,臌囊薹草群落居中且大面积分布,油桦群落分布在外缘[23—24]。
1.2 样品采集与处理
在金川泥炭沼泽中心部位设置3个间隔50 m的5 m×5 m样方采样点,采用多点混合法于2019年1月份利用直径为15 cm的泥炭钻(冰芯钻),在每个样方随机取5个点,共采集15钻,采集土壤深度为30 cm。将采集好的土壤分为0—15 cm和15—30 cm两层,分别装入自封袋,尽快带回实验室并放4℃冷藏保存。培养实验前,去除土壤中的杂草和植物根系,并分别将两个土层的样品混合均匀,4℃冷藏备用。另取一部分土壤自然风干后,研磨过筛后用于土壤理化性质的测定,土壤理化性质见表1。

表1 土壤基本理化性质
1.3 实验设计
称取50 g(相当于风干土重)混合均匀的土壤样品置于500 mL玻璃培养瓶中,根据野外实际含水量情况用去离子水调节所有土壤样品含水量为最大持水量的60%,并将全部土壤样品在室温(20℃)下预培养1周,定期称重并补充损失的水分。预配养使微生物从低温环境苏醒,在冻融培养实验前保持较为稳定的状态,虽然微生物会因此发生改变,但土壤样品经过一致处理后排除其他干扰变量,主要观测冻融作用对微生物的数量及群落结构的影响。结合金川泥炭沼泽冻融期间实际情况,设置-5—5℃与-10—10℃两个冻融幅度,-10℃接近采样地冬季的平均气温,-5℃则是依据全球变暖的大背景下温度升高设定的。-5—5℃与-10—10℃即把土壤样品分别放入-5℃和-10℃低温培养箱中培养24 h,再分别调节温度为5℃和10℃使其融化24 h,作为一次冻融循环。本实验设置15次冻融循环,共培养30天。培养过程中,分别在冻融循环的第0、1、3、5、7、15次后取出培养瓶,测定土壤磷脂脂肪酸含量、土壤微生物碳、氮(MBC和MBN)、土壤可溶性有机碳、氮(DOC和DON)。将经过1、3、5、7、15次冻融循环处理后的土壤活性有机碳、氮和不同类型磷脂脂肪酸含量与未经过冻融处理的FTC(0)对比。
1.4 磷脂脂肪酸及活性有机碳、氮组分测定
土壤微生物群落的测定采用磷脂脂肪酸法,将相当于4 g干重的土壤分别加入3.0 mL磷酸缓冲液、6.0 mL氯仿、12 mL甲醇,避光震荡2 h,在3000 r/min下离心10 min,转移上清液到装有12 mL三氯甲烷,12 mL磷酸缓冲液的分液漏斗中,再向土壤中加入相同体积的磷酸缓冲液、氯仿和甲醇溶液,手工摇动并震荡30 min,离心,再次将上清液转移到分液漏斗中,最后将分液漏斗摇动2 min,静置过夜,避光保存。 第二天,将分液漏斗中下层溶液收集入大试管(50 mL)中,收集的液体30—32℃水浴,用高纯氮气吹干(氮吹仪),试管内浓缩后样品用2份500 μL三氯甲烷转移浓缩磷脂到萃取小柱(硅胶柱),洗脱液依次采用5 mL三氯甲烷,10 mL丙酮,5 mL甲醇,并收集甲醇相,吹干。在吹干后的样品中加入1 mL的1:1甲醇甲苯及1 mL 0.2 mol/L氢氧化钾,摇匀,37℃水浴加热15 min(水浴锅中),最后用正己烷萃取,收集正己烷相并吹干。运用美国MIDI公司研发的Sherlock MIS 4.5全自动系统鉴定微生物细胞中磷脂脂肪酸成分,根据其分子结构划分为不同微生物类群并进行定量分析。将15:0、17:0、i15:0、a15:0、i16:0、i17:0、16:1ω7c、cy17:0、cy19:0表征为细菌;i15:0, a15:0, i16:0, i17:0表征为革兰氏阴性菌;16:1ω7c, cy17:0, cy19:0表征为革兰氏阳性菌;18:1ω9c, 18:2ω6表征为真菌;10Me16:0, 10Me18:0表征为放线菌[25—33]。
土壤MBC与MBN采用改进的氯仿熏蒸K2SO4浸提法测定[34—35]。取10 g土壤样品用三氯甲烷熏蒸24 h,用0.5 mol/L 的K2SO4浸提熏蒸和未熏蒸的样品约30 min,应用MultiN/C 2100 TOC仪碳模块测定浸提液总有机碳浓度,氮模块测定浸提液总有机氮浓度。使用以下公式进行MBC与MBN[36—37]的计算:
MBC =Ec/0.45
MBN=En/0.54
式中,MBC为微生物量碳,MBN为微生物量氮,单位均为mg/kg。Ec为熏蒸与未熏蒸样品浸提液测定出的有机碳差值,En为熏蒸与未熏蒸样品浸提液测定出的有机氮差值。0.45为微生物量碳熏蒸提取法的转换系数,0.54为微生物量氮的转化系数。
土壤DOC与DON测定:称1 g新鲜土壤置于离心管中,加50 mL去离子水,常温下振荡浸提5 h,用高速离心机以8000 r/min离心5 min,上清液过0.45 μm滤膜用Multi N/C 2100 TOC仪(德国耶拿)测定[38]。
1.5 统计分析
采用双因素方差分析法,分析不同深度下,冻融幅度和冻融次数主效应及交互效应对土壤磷脂脂肪酸含量、微生物量碳、氮含量的影响。采用Pearson相关分析法,分析土壤磷脂脂肪酸含量与土壤活性有机碳氮组分的关系。双因素方差分析及相关分析利用Excel 2003和SPSS 16.0软件进行,并利用Origin 2019软件绘图。
2 结果
2.1 土壤微生物碳、氮含量的变化
双因素方差分析结果表明,冻融次数和冻融幅度及其交互作用对土壤MBC含量有显著影响(P<0.0001),而只有冻融次数对15—30 cm土壤MBN含量有显著影响(P<0.001)(表2)。-5—5℃冻融模式下,随着冻融次数的增加,土壤MBC含量表现为逐渐增加(图1)。-5—5℃冻融作用下0—15 cm和15—30 cm土壤MBC含量分别在15次冻融循环后达到了最大值,分别为4362.4 mg/kg和2804.44 mg/kg;-10—10℃冻融作用下,0—15 cm土壤MBC含量在7次冻融循环后达到了最大值16978.1 mg/kg,15—30 cm土壤MBC含量在7次冻融循环明显增加(8084.4 mg/kg),15次冻融循环后达到了最大值8096.6 mg/kg。与冻融前相比,在-5—5℃冻融作用下0—15 cm和15—30 cm土壤MBC含量分别增加了80.2%、100.6%;-10—10℃冻融作用下,0—15 cm和15—30 cm土壤MBC含量分别增加了4.3倍和4.8倍。两种冻融模式对土壤MBC的影响表现为-10—10℃>-5—5℃,15—30 cm>0—15 cm。

表2 冻融幅度和冻融次数对土壤不同类型磷脂脂肪酸含量和微生物碳、氮含量影响的方差分析
两种冻融模式下,随冻融次数的增加,0—15 cm土壤MBN表现为先增加后降低的变化趋势,而15—30 cm土壤MBN则表现为先降低后增加的变化趋势。-5—5℃冻融模式下,15次冻融循环后,0—15 cm土壤MBN含量与冻融前相比无明显变化(图1);而-10—10℃冻融模式下,0—15 cm土壤MBN 7次冻融循环后达到最大值199.6 mg/kg,随后降低,15次冻融结束后土壤MBN为58.86 mg/kg,与冻融前相比0—15 cm土壤MBN含量降低了63%(图1)。-5—5℃和-10—10℃冻融作用下,15—30 cm土壤MBN在冻融循环结束后分别减少了60.6%和54.4%。
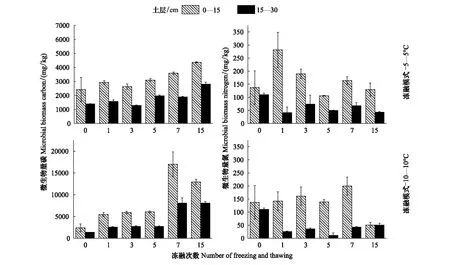
图1 -5—5℃和-10—10℃处理下不同冻融次数土壤微生物碳、氮含量变化
2.2 土壤磷脂脂肪酸含量的变化
冻融幅度对0—15 cm土壤总PLFAs及细菌、G+、G-PLFAs含量无显著影响,而冻融幅度、冻融次数及二者的交互作用对0—15 cm土壤真菌、放线菌、F/B、G+/G-及15—30 cm土壤不同类型PLFAs含量均具有显著影响(P<0.05)(表2)。-5—5℃冻融作用下,0—15 cm和15—30 cm土壤各类型PLFAs含量在冻融循环初期(前3次冻融循环)无显著变化,但随后逐渐降低(图2,图3)。15次冻融循环后,与冻融前相比,0—15 cm土壤总PLFAs、细菌、真菌、放线菌、G+、G-PLFAs分别降低了57.8%、56.7%、60.6%、58.6%、53.8%、58.9%,而15—30 cm土壤中上述各类型PLFAs含量分别降低了79%、86.5%、56.6%、72.8%、93.5%、75.8%。两种土层土壤微生物PLFAs含量对-5—5℃冻融作用的响应表现为15—30 cm>0—15 cm。
-10—10℃冻融作用下,土壤各类型PLFAs含量呈现先降低后增加的变化趋势,但仍低于冻融前的PLFAs含量(图2,图3)。-10—10℃冻融作用下,与冻融前相比,0—15 cm土壤中总PLFAs、细菌、真菌、放线菌、G+、G-PLFAs分别减少了50.4%、39.8%、46.1%、100%、34.4%、44.6%,而15—30 cm土壤中上述各类型PLFAs含量分别降低了75%、39.7%、40.4%、62.6%、36.1%、44.6%。综上,两种冻融幅度对土壤各类型PLFAs含量的影响表现为-5—5℃>-10—10℃。不同土层土壤PLFAs含量对-10—10℃冻融作用的响应因微生物类型而异,总PLFAs表现为0—15 cm<15—30 cm,而真菌和放线菌PLFAs表现为0—15 cm>15—30 cm。

图2 -5—5℃和-10—10℃处理下不同冻融次数土壤各类型磷脂脂肪酸含量变化
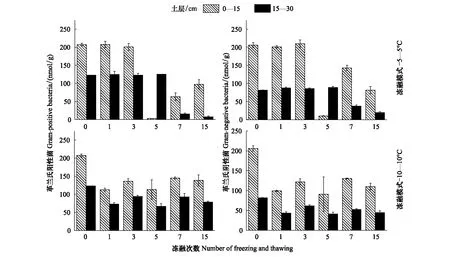
图3 -5—5℃和-10—10℃处理下不同冻融次数土壤革兰氏阳性菌和革兰氏阴性菌磷脂脂肪酸含量变化
冻融幅度、冻融次数及二者的交互作用对土壤真菌/细菌比(F/B)及革兰氏阳性菌/革兰氏阴性菌比(G+/G-)均具有显著影响(P<0.01)(表2)。-5—5℃冻融初期(3次冻融循环)土壤F/B无显著变化,并在5次冻融循环后达到最大值,随后降低;15—30 cm土壤F/B则在5次冻融循环作用后逐渐增加。(见图4)-5—5℃冻融循环结束后,0—15 cm土壤F/B减少了9.3%,15—30 cm土壤F/B增加了1.26倍。在-10—10℃冻融作用下,0—15 cm与15—30 cm土壤F/B变化幅度相对较小,冻融结束后分别减少了11.4%和1.9%。

图4 -5—5℃和-10—10℃处理下不同冻融次数土壤真菌/细菌和革兰氏阳性菌/革兰氏阴性菌含量变化
-5—5℃冻融作用下,0—15 cm土壤G+/G-表现为先降低后增加的变化趋势,15—30 cm土壤G+/G-在冻融初期无显著变化,5次冻融循环后显著降低;0—15 cm增加了18.2%,而15—30 cm土壤减少了73.4%。-10—10℃冻融作用下,0—15 cm和15—30 cm土壤G+/G-分别增加了24.4%和17.2%。
2.3 土壤微生物磷脂脂肪酸与土壤活性有机碳氮组分的关系
土壤各类型磷脂脂肪酸含量与土壤微生物碳、氮及可溶性有机碳、氮的相关分析结果显示,土壤MBN含量与土壤总PLFAs、G+、G-、细菌、真菌、放线菌PLFAs含量呈显著正相关关系(P<0.01),而与土壤G+/G-呈显著负相关(P<0.05)。土壤MBC含量与土壤G+含量呈显著正相关,而与放线菌含量呈显著负相关关系(P<0.01)。土壤总PLFAs、G+、G-、细菌、真菌、放线菌PLFAs含量与土壤DOC呈显著负相关关系,但与土壤DON含量无显著相关关系(表3)。
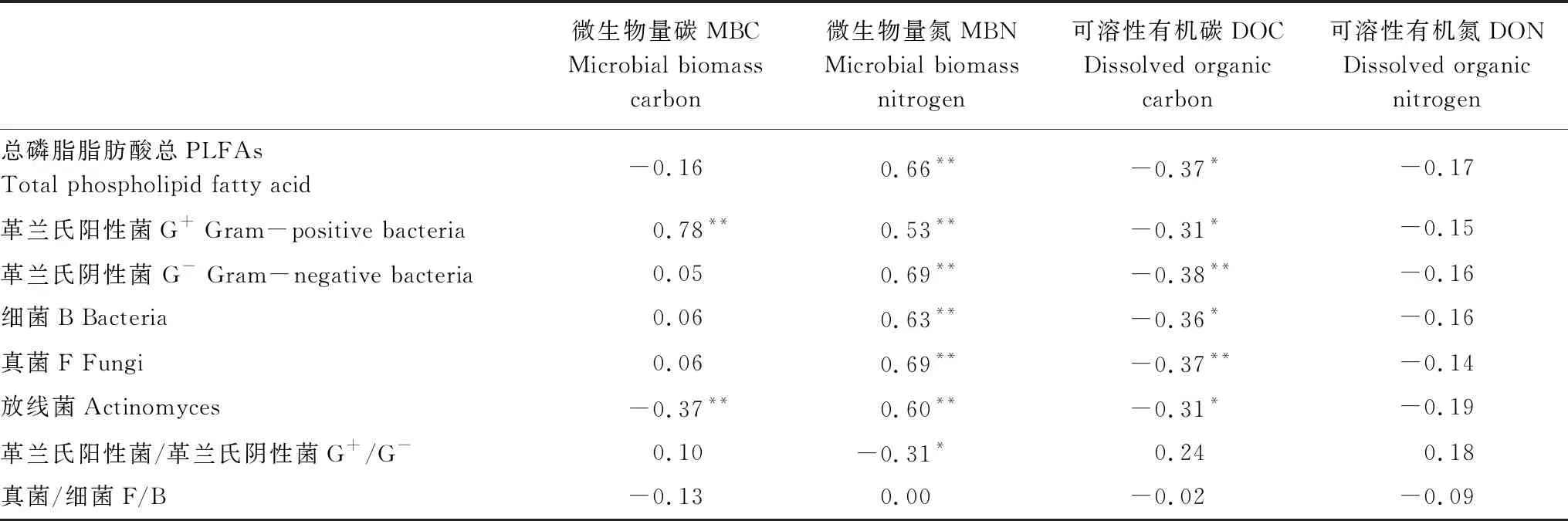
表3 微生物群落和碳氮组分之间的相关性
3 讨论
3.1 冻融作用对土壤微生物碳、氮的影响
冻融作用对土壤MBC和MBN含量的影响在不同生态系统和不同土层之间存在差异。本研究中,两种不同冻融强度下泥炭沼泽土壤MBC含量在15次冻融结束后均较冻融前显著增加,与李龙对长白山森林土壤的研究结果一致[39]。随着冻融次数的增加,土壤MBC含量变化趋势是先增加后降低,这与任伊滨对小兴安岭湿地研究结果相同[15]。通过PLFA数据也可以看出,在短期冻融时间内微生物对冻融作用的响应不敏感,微生物数量基本保持稳定,说明微生物在此阶段受冻融作用的影响较小,活性较强。冻融作用将土壤中的大团聚体打碎成小团聚体,这一过程中土壤有机质得以释放,此时微生物利用周围环境中积累的有机物,使得土壤MBC在短期冻融时间内含量逐渐上升。随冻融次数的增加,在5次冻融作用结束后,微生物群落数量减少,但MBC含量仍然增加说明虽然有部分微生物死亡,但死亡的微生物释放出的有机质为存活微生物提供了营养物质[19—20]。然而,土壤MBC含量的增加并不是无限制的,在-10—10℃冻融作用下,7次冻融循环MBC含量达到了最大值,随后降低,这与在森林生态系统的研究结果相同[40—41]。土壤MBC降低的原因可能是随时间增加死亡细胞的有机质及团聚体破碎后的有机质不足以维持存活细胞的生命活动,经过7次大幅度的冻融循环后,得不到营养供给的部分细胞死亡。研究结果与预想的MBC含量受冻融作用影响会降低正好相反,原因可能是微生物对冻融环境的适应性较强,主要因为采样时间及采样点的气候条件存在差异。本研究研究区属季节性冻土区,土壤样品为2019年1月底采集,采样时土壤平均温度为-7.3℃,土壤经过冬季的冻结作用,不能适应低温的土壤微生物大部分死亡,耐低温的土壤微生物在秋季冻融后微生物抗寒性较强可以生存[42]。这也可以解释为什么MBC含量在-5—5℃一直增加,在-10—10℃的7次冻融作用后下降。-10—10℃冻融作用下对MBC含量的变幅的影响也大于-5—5℃,因为温度变化幅度增大,死亡微生物细胞释放出的有机质对存活微生物的刺激作用也就越强,MBC含量变幅较大。徐俊俊对青藏高原高寒草甸土壤的研究发现冻融作用使MBN含量先降低后增加[14],而本研究中的两种冻融模式下,15次冻融作用后,与冻融作用前相比土壤MBN含量降低。0—15 cm土壤MBN变化趋势为先增加后降低,可能是因为冻融交替过程使土壤中的有机质释放出来,激发部分酶的活性,促进微生物对氮的固持作用,使土壤中微生物量氮含量有所增加[43—44]。15—30 cm土壤MBN含量变化为先降低后增加,这是因为野外环境中深层土壤受冻融交替的影响小,在培养实验中更易受冻融作用影响而死亡。15次冻融结束后MBN含量均显著降低(-5—5℃,0—15 cm土壤除外),这可能是氮在土壤中不稳定极易发生矿化作用,冻融循环有利于土壤矿质氮的增加[19],且长期的冻融循环不利于微生物对无机氮的固持[45]。
3.2 冻融作用对土壤微生物磷脂脂肪酸的影响
两种冻融模式下,各类型微生物PLFAs含量均显著降低。不同幅度的冻融作用对微生物群落结构及数量的影响不同。研究表明大幅度冻融作用可显著降低微生物数量,促进更多的可溶性有机碳的释放[46],而相对较小幅度的冻融作用可以杀死更少的土壤微生物[47—48],本研究中,-5—5℃冻融作用下,各土壤微生物PLFAs含量变幅大于-10—10℃的冻融作用(放线菌除外),这与本研究中土壤DOC含量经15次冻融循环显著增加(表4)的研究结果相一致。土壤营养物质供应不足使微生物难以维持自身代谢和存活[49],-5—5℃冻融循环后期营养物质供应低于-10—10℃,这可以从土壤MBC含量变幅进一步证明。冻融作用对不同土层的土壤微生物PLFAs含量的影响也存在差异。由于泥炭沼泽表层土壤在野外条件下受冻融作用的影响更为频繁,土壤微生物产生适应性,对室内冻融交替作用并不敏感。因此,两种冻融作用下,土壤微生物PLFAs含量的变化幅度表现为0—15 cm<15—30 cm。
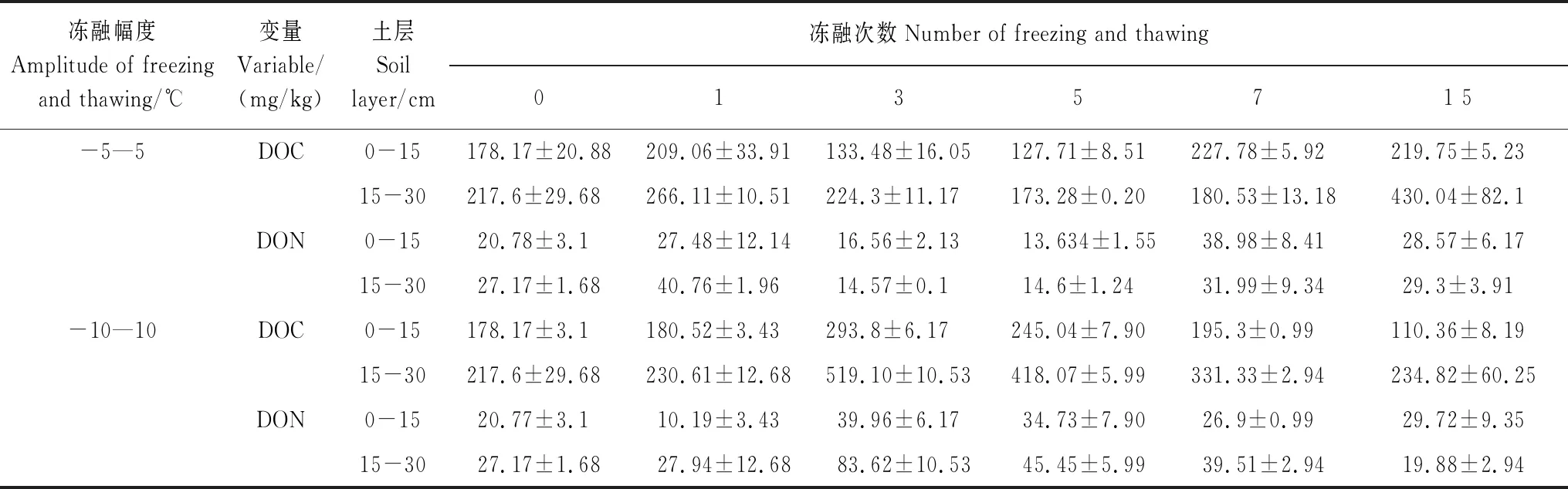
表4 -5—5℃和-10—10℃处理下不同冻融次数土壤可溶性有机碳、氮含量变化
本研究中,-5—5℃,0—15 cm土壤F/B先增加后降低,而15—30 cm土壤F/B在冻融结束后显著增加,表明冻融作用显著改变了土壤微生物群落结构。细菌和真菌在环境中有着不同生长策略以及生态位,因此他们对冻融交替作用的响应可能不同[50]。冻融期土壤水分相对缺乏限制了细菌生长,而真菌菌丝体能利用土壤周围吸附的未动水以保持自身生理代谢活性,对于恶劣环境的适应能力及在物质和能量的积累效率方面,真菌明显优于细菌[51]。有研究发现冻融交替后的微生物群落优势种从细菌逐渐转向真菌[52]。相对于细菌,真菌对低温的抗性更强,随着冻融交替作用的进行,土壤F/B呈增加趋势[53],这与本文研究结果一致。真菌比细菌的碳存储能力高,土壤F/B比的增加表明随着冻融交替的进行,土壤有机质的分解过程可能会减缓[54]。本研究中-10—10℃冻融作用增加了土壤G+/G-比。土壤G+对环境胁迫的适应力相对较强[55],能够更好地适应冻融交替环境,成为优势群落。然而,-5—5℃冻融作用下15—30 cm土壤G+/G-比在冻融后期下降,其原因有待进一步解释。
微生物群落结构主要受土壤物理性质(水分和导电率)和化学性质(pH和土壤溶解有机碳)的影响[50]。土壤MBN含量与土壤微生物群落呈显著正相关关系,可以通过MBN含量与微生物细胞壁组成成分氨基糖呈负相关进一步证实[44]。冻融作用通过破坏微生物细胞壁降低微生物数量使土壤氮素释放,氮素的释放又加剧了氮的矿化作用,微生物量氮与微生物群落的数量随之降低。Ren等人[42]通过冗余分析发现微生物群落与DOC之间存在着显著相关性。秋季冻融可能通过土壤微生物的分解促进DOC的释放,这与Haei等人[3]研究一致,研究表明土壤细菌生长速率与DOC含量呈负相关。本研究发现真菌、细菌、放线菌与DOC呈显著负相关。这可能是冻融交替导致一部分微生物死亡并分解,从而释放出一些小分子有机质,增加了土壤DOC含量。
4 结论
(1)15次冻融交替作用后,两种冻融幅度下土壤微生物碳(MBC)含量均显著增加;而土壤微生物量氮(MBN)含量、各类型微生物磷脂脂肪酸含量均显著降低。冻融作用增加了土壤F/B比值。
(2)根据15次冻融结束后结果,不同冻融模式对土壤磷脂脂肪酸含量的影响表现为-5—5℃>-10—10℃,而对土壤MBC的影响则表现为-10—10℃>-5—5℃。两种冻融模式对不同土层微生物量碳与大部分微生物磷脂脂肪酸的影响均表现为15—30 cm>0—15 cm。
(3)多种微生物磷脂脂肪酸含量与MBN含量呈正相关关系,与DOC含量呈负相关关系,表明冻融作用下,土壤微生物的死亡增加了土壤可溶性有机碳的含量。
