高位直肠癌辅助性放疗的问题与争议探讨*
2022-04-24马智伟综述朱苏雨审校
马智伟 综述 朱苏雨 审校
作者单位:①南华大学衡阳医学院,湖南省肿瘤医院协作培养基地(湖南省衡阳市421001);②湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院腹部放疗科
目前,国内外尚缺乏低中高位直肠癌统一诊断标准,根据欧洲肿瘤内科学会(ESMO)2017 指南的建议,通过硬质肠镜测量,将肿瘤下缘距肛缘0~5 cm、5~10 cm、10~15 cm 分别划分为低、中、高位直肠癌,目前对于低中位局部晚期的直肠癌,新辅助放化疗或新辅助大分割放疗+手术+术后的辅助化疗已成为标准的治疗方案[1]。但是对于高位的局部晚期直肠癌,放疗的作用仍未明确。
直肠肿瘤的位置对于肿瘤学结局有明确的影响,但目前单独针对高位局部晚期直肠癌放疗的研究较少,且缺乏大型的前瞻性随机对照临床研究,大多数回顾性研究通常对比的是高位与中低位直肠癌的结局,这种对比缺乏一定的可靠性,且不同的研究中对于高位直肠癌的诊断标准并不完全一致,难以比较其结果。
另外,在直肠全系膜切除术(total mesorectal excision,TME)时代,局部晚期直肠癌5年的局部复发率已降至5%~10%,高位直肠癌甚至更低[2],而面对放疗带来的胃肠道、泌尿系统及性功能等不良反应,高位直肠癌放疗是否仍有价值,如何平衡高位直肠癌放疗获益与不良反应的影响,如何精准的识别出高位直肠癌放化疗真正获益的人群从而避免治疗不足或治疗过度是目前亟待解决的问题。
1 高位直肠癌的定义
目前,对高位直肠癌缺乏统一的定义,国内外不同指南对于高位直肠癌的划分及治疗原则存在分歧。2018年美国国立综合癌症网络(NCCN)指南对直肠癌的定义进行更新,从过去肠镜下距肛缘12 cm 内的肿瘤更新为磁共振上骶岬与耻骨联合上缘虚拟连线下方的肿瘤,其中肿块最低缘在腹膜反折之上者定义为高位直肠癌,而2017年ESMO 指南对于直肠癌的界限划分为15 cm,肿块下缘距肛门10~15 cm 者定义为高位直肠癌。中国结直肠诊疗规范2020 版与NCCN 指南均不建议距肛缘>12 cm的直肠癌行放疗,而ESMO 根据肿瘤距肛缘的距离、T 分期、N 分期、EMVI、MRF、侧方淋巴结状态进行危险分层,认为对于复发风险高的患者,即使是高位直肠癌也应该行放疗[1,3-4]。
2 高位直肠癌术前局部分期
术前分期不充分是高位直肠癌个体化治疗的一大障碍,准确的术前分期对于直肠癌治疗方案的选择极为重要,治疗前精准的磁共振成像是局部分期最为重要的手段,对于肿瘤位置、直肠系膜筋膜及邻近组织器官的受侵情况等均有较好的判断,可用于识别不良预后因素[1,5],但磁共振也存在分期不足及分期过度的问题,尤其是针对T3N0 的患者。Guillem 等[6]针对术前MRI 或超声内镜分期为T3N0 的患者进行分析,结果提示术后病理有22%的患者淋巴结阳性,由于新辅助治疗对降低阳性淋巴结数目和转移均有一定的作用,因此实际上可能会有更多的患者分期不足,建议术前MRI 或超声内镜分期为T3N0 的患者接受术前放化疗。但是在国外一项研究中,患者被随机分为术前和术后治疗组,结果提示有18%的术后治疗组患者术前超声内镜分期为T3/4 或N+,术后病理分期为Ⅰ期,意味着这部分患者可能存在过度治疗[7]。刘婕等[8]的研究提示上段直肠癌T 分期的准确性仅75%,较中低位直肠癌更易被低估分期。另外,上段直肠前方与两侧均为腹膜覆盖,后侧为直肠系膜筋膜,而腹膜反折以下的中低位直肠完全被直肠系膜筋膜覆盖。因此,当腹膜反折以下的中低位直肠癌侵及肠壁全层时为T3,而上段直肠癌侵及全层时则需明确是前方与两侧的腹膜受侵还是后方的直肠系膜筋膜受侵,因为前者为T4,后者则为T3,而T3N0 的患者相较于其他局部晚期的患者,有更好的预后。
3 高位直肠癌新辅助放疗
3.1 新辅助放疗的利与弊
相较于中低位直肠癌,高位直肠癌本身局部复发率更低,预后较好[2,9-10],而面对新辅助放化疗带来的不良反应,放疗是否能获益尚缺乏统一定论,在制定个体化的治疗方案时如何平衡放疗的益处与并发症值得深思。对于局部晚期中低位直肠癌,新辅助治疗的优势在于降低局部复发的风险,提高病理完全缓解率、根治性切除率,增加保肛的机会[7]。高位直肠癌虽然不存在保肛的顾虑,但是新辅助放化疗是否能降低局部复发率,带来远期生存获益仍不明确。有研究提示,高位直肠癌术前长程放化疗可使67%的患者实现降期,尤其是Ⅲ期的患者,而新辅助放化疗后的降期是高位直肠癌局部控制、总生存的独立预测因素,这意味着局部晚期高位直肠癌新辅助放化疗可能获得局部控制及总生存的益处[11-12]。
新辅助放疗的不足之处主要在于放疗的不良反应及其对手术造成的影响,放疗的不良反应包括盆腔放疗引起的早期反应和晚期反应。早期反应主要包括放射性直肠炎、放射性皮肤炎、膀胱炎等,晚期则主要包括排便、排尿功能障碍、胃肠道功能障碍,在女性患者中还可能引起卵巢衰竭和不孕,放疗后肠道水肿或纤维化也会导致手术难度增大,手术并发症增加[13-15]。Treder 等[11]的一项描述性研究观察局部晚期高位直肠癌行新辅助长程放化疗的疗效及不良反应,入组的54 例患者中,尽管Ⅲ期患者比例较高(78%),但是整体耐受较好,其中,3~4 级的血液学不良反应、胃肠道不良反应、皮肤不良反应分别为6%、8%、2%,但术后吻合口漏的发生达到了20%。Herman 等[16]研究也提示胃肠道症状在放化疗结束后1 个月即恢复到基线水平(−0.33,P=0.920 5)。
3.2 支持新辅助放疗
英国的MRC CR07 研究及德国CAO/ARO/AIO-94 研究确立了直肠癌新辅助放疗优于术后辅助放疗的地位,两项研究的亚组分析均提示高位直肠癌可能从术前放疗中获益。其中来自英国的研究结果显示,高位直肠癌术前短程放化疗组与其他组对比,3年局部复发率分别为1.2%vs.6.2%(HR=0.19);来自德国的研究显示,高位直肠癌患者术前行长程放化疗与单独手术相比,5年的局部复发率分别为2.5%vs.10.4%,10年随访优势依旧存在[7,17-18]。在Stockholm Ⅱ临床试验中,将高位直肠癌随机分为术前短程放疗和单纯手术组,结果显示两组的局部复发率为 5%vs.21%(P=0.01),放疗显示出明显的优势[19]。
Bernstein 等[20]研究提示环周切缘距离≤2 mm 是距肛缘6~15 cm 的T2/3 期高位直肠癌的不良预后因素,应考虑作为新辅助治疗的指征。另外,Wo 等[21]综合分析相关研究,指出直肠癌肿瘤浸润深度、分化不良、淋巴脉管受侵、治疗前高CEA 水平(>5 ng/mL)、环周切缘阳性以及分期为低位T3N0,均为局部复发的高危因素,而这部分患者可能从放疗中获益。
3.3 反对新辅助放疗
2001年荷兰的TME 研究确立了新辅助放化疗在局部晚期直肠癌治疗中的地位,结果提示高位直肠癌的局部复发率本身明显低于中低位直肠癌。对肿瘤不同部位进行分层分析,术前短程放疗对于减少中低位直肠癌的局部复发效果显著,但是对于高位直肠癌,放疗的作用并不显著,中位随访2年、6年,其局部复发率分别为1.3%vs.3.8%(P= 0.17),3.7%vs.6.2%(P=0.122)[2,22]。2005年瑞士的一项临床试验,对比术前短程放疗联合手术和单纯手术,探索放疗对局部复发和总生存的长期影响,结果提示对于不同部位的肿瘤,放疗均有降低局部复发的疗效,但是对于距肛缘≥11 cm的高位直肠癌,放疗相较于单纯手术,局部控制的效果并不显著,其局部复发率分别为8 %vs.12 %(P= 0.3)[23]。Zhang 等[24]针对471 例局部晚期的中高位直肠癌,对比新辅助长程放化疗与手术,中位随访57 个月,5年的总生存及局部复发均无显著差异。类似的,一项探讨高位直肠癌最佳治疗模式的研究指出,无论是手术+辅助化疗的结肠癌模式还是术前放化疗+手术+化疗的直肠癌模式,均对高位直肠癌局部复发及总生存无显著影响,新辅助放化疗可能引起更多的手术并发症[25]。一项Meta 分析提示对于接受根治性切除的上段直肠癌患者,与单独手术相比,新辅助短程放疗并未带来进一步肿瘤学结局的获益,也未发现并发症及晚期不良反应增加,因此放疗的获益值得更进一步的研究[26]。一项多中心回顾性研究纳入127 例局部晚期高位直肠癌患者,比较新辅助放化疗与单独手术术后并发症及肿瘤学结局,结果提示两组5年总生存和无复发生存无显著差异,放化疗组的术后总体并发症和严重并发症发生率更高(60%vs.30%,P<0.001;17%vs.1%,P=0.002)[27]。
综合目前国内外研究,局部晚期高位直肠癌术前放化疗可进一步降低局部复发率,尽管部分研究提示局部复发率的降低并未达到统计学意义,相关研究详见表1。但同时考虑到放疗的不良反应、患者依从性、经济因素等原因,高位直肠癌新辅助放疗的获益仍需进一步探究。对于长程与短程放疗的选择,尽管部分长程与短程放疗对比的研究中入组了少量高位直肠癌患者[28-29],但是缺乏单独针对高位直肠癌患者进行的预后分析,因此难以判断高位直肠癌患者长程与短程放疗的优劣。整体来讲,短程放疗在病理缓解率、降低远处转移率方面优于长程同步放化疗,顺应性及耐受性可,而长程放疗降期的效果更好。

表1 高位直肠癌组新辅助放疗相关研究
4 高位直肠癌辅助放疗
对于中低位直肠癌,术后病理提示为局部晚期、高危局部复发者,术前未予以新辅助放疗者,术后应予以辅助放疗[4]。对于高位直肠癌患者,是否也需追加辅助放化疗尚缺乏统一定论。术后辅助放疗相较于术前辅助放疗,患者的3、4 级急性和慢性放疗不良反应明显增加[7],耐受性和顺应性进一步下降,因此基于风险分层有针对性地选择术后放疗可能更具意义。ESMO 指南建议,对于T4b、pN2 且结外侵犯靠近直肠系膜筋膜、低质量TME 手术、脉管受侵、环周切缘阳性的患者,即使是高位直肠癌,也应行术后放疗[1]。部分机构的研究认为具有不良预后因素者,应行辅助放化疗,也有部分研究认为术后追加放疗并不能改善患者总生存,反而导致并发症增加。相关研究详见表2。
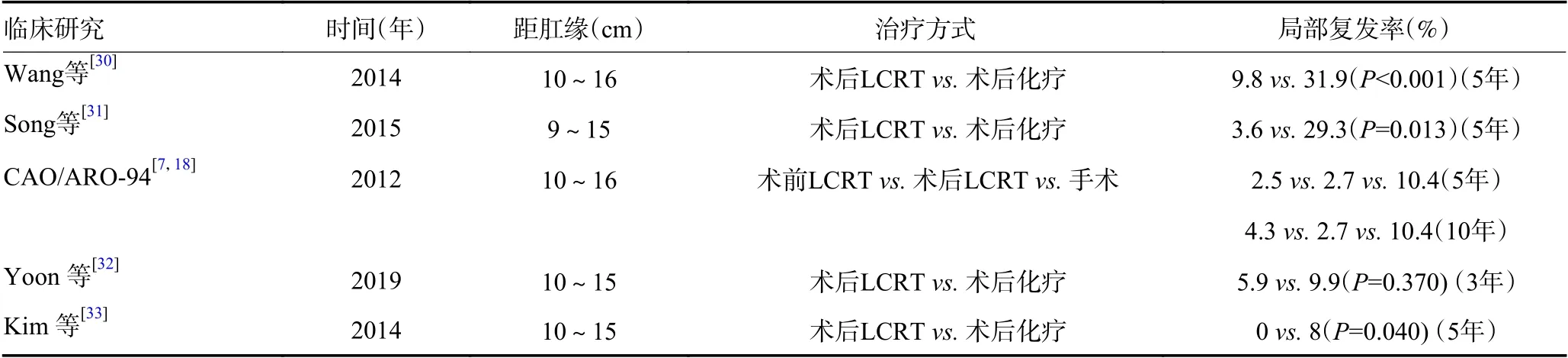
表2 高位直肠癌辅助放疗相关研究
国内一项研究入组547 例行根治手术后的局部晚期高位直肠癌患者(肠镜示肿块下缘距肛门10~16 cm),根据肿瘤沉积TD(有或无分别为0 或2 分),T 分期(T3vs.T4avs.T4b,分别为0、1、2 分),淋巴结转移比例LNMR(0vs.1~19%vs.≥20%,分别为0、1、2 分) 制订预后分组;通过计算上述指标,分为好(0~1 分,n=281),一般(2~3 分,n=181),差(4~6 分,n=85)3 组,结果显示出明显的5年总生存(overall survival,OS)率的差异(86.2%vs.77.5%vs.56.9%,P<0.001),尽管放疗对于好和一般两组未显示出显著性差异,但是对于预后差组,放疗显著改善了总生存(63.4%vs.33.3%,P<0.001)、无局部复发生存率(90.2%vs.68.1%,P<0.001)和无远处转移生存率(63.4%vs.31.6%,P<0.001)[30]。同样,国外一项研究证实,对于有较差预后因素的高位直肠癌患者(pT4,pN2,分化不良和CRM+),术后放化疗可以改善5年的局部控制(96.4%vs.70.7%,P= 0.013),对于5年OS 术后放化疗也有一定的获益趋势(74.5%vs.46.1%,P= 0.074)[31]。另外,Choi 等[34]的一项研究对术后病理分期为局部晚期的中高位直肠癌进行术后长程放疗,将吻合口排除在照射野外来减少盆腔照射野的范围,结果提示吻合口及放疗相关并发症均有所减少,且不会增加局部复发率,3年局部复发率为2%,这或许为局部晚期高位直肠癌放疗平衡局部复发的改善与不良反应的增加提供了一种选择。
Yoon 等[32]的研究对比局部晚期高位直肠癌术后行长程辅助放化疗和单独手术的肿瘤学结局,放化疗组与手术组3年局部无复发生存率分别为94.1%和90.1%(P=0.370),无病生存期无明显差异,术后放疗并不能进一步控制局部复发,但是研究并未基于术后风险分层进一步分析。Kim 等[33]回顾性分析了209例局部晚期上段直肠癌患者术后辅助放疗的价值,结果提示术后放疗与单独手术两组远处转移及总生存并无显著差异,而考虑到术后放疗盆腔复发者的中位生存期更短,提出术后辅助放疗的应用值得考虑。
5 结语与展望
综上所述,对于局部晚期高位直肠癌,尽管目前尚存诸多争议,对于术前新辅助放疗的适应人群尚缺乏统一共识,但术前放疗优于术后放疗已是事实,未来随着影像技术的发展,对于术前分期的准确性会进一步提高,基于危险分层的个体化治疗会进一步规范。另外,考虑到术前分期的不充分,根治性手术切除质量无法保证等相关因素,对于部分术后病理提示同时伴有高危因素的患者,如环周切缘阳性、T4b、淋巴结转移率高、神经脉管侵犯等建议结合患者情况选择性行辅助放疗,然而这部分观点主要来自于各个机构的回顾性研究,未来还需国内外更多的前瞻性随机对照临床试验的数据加以验证以帮助选择局部晚期高位直肠癌的最优治疗模式。
