18F-FDG PET/CT代谢参数与非小细胞肺癌PD-L1表达相关性研究*
2022-04-24徐鑫李继会戴娜章斌桑士标邓胜明
徐鑫 李继会 戴娜 章斌 桑士标 邓胜明②
作者单位:①苏州大学附属第一医院核医学科(苏州市215006);②放射医学与辐射防护国家重点实验室
肺癌是世界上发病率和死亡率最高的恶性肿瘤,其中80%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。70% 的NSCLC 患者确诊时即为晚期,其5年生存率仅为16%[2]。近年来,随着分子生物学的发展,免疫治疗在改善NSCLC 患者预后生存方面逐渐发挥重要作用,其中程序性死亡-受体1 (programmed cell death-1,PD-1)和程序性死亡配体1(programmed cell death-ligand 1,PD-L1)为肺癌免疫治疗的热点。有研究报道了抗PD-1/PD-L1 免疫治疗能够明显改善晚期PD-L1 高表达NSCLC 患者的预后生存[3]。PD-L1 蛋白在肺癌细胞中的表达可能是免疫治疗的预后生物标志物。因此, PD-L1表达状态对NSCLC 患者的诊疗至关重要。
氟代脱氧葡萄糖正电子发射计算机断层显像(18Ffluorodeoxyglucose positron emission computed tomography,18F-FDG PET/CT)能够量化肿瘤的葡萄糖代谢,被广泛应用于肺癌的诊断、疗效评价及预后评估[4]。活跃的糖代谢可能与肿瘤细胞膜过表达的葡萄糖转运体1(glucose transporter-1,GLUT-1)相关,有研究报道了NSCLC 患者PD-L1表达与Glut1 和糖酵解相关酶有关[5]。提示NSCLC 患者FDG 摄取可能与PDL1表达有关。因此,本研究旨在分析代谢参数与PDL1表达的相关性。
1 材料与方法
1.1 临床资料
回顾性分析2019年3月至2021年7月苏州大学附属第一医院行18F-FDG PET/CT 显像的241 例NSCLC 患者,包括腺癌(adenocarcinoma,ADC)和鳞癌(squamous cell carcinoma,SCC)。纳入标准:1)病理证实为ADC 或SCC;2)显像前未行任何抗肿瘤治疗。排除标准:1)除肺癌外,有其他恶性肿瘤病史;2)免疫组织化学结果不完整的样本。本研究经本院伦理委员会审批通过。
241 例患者中161 例行肺癌根治术,80 例行放化疗或免疫治疗。回顾性分析患者的临床病理特征,包括年龄、性别、吸烟史、细胞增殖核抗原(Ki-67)表达、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变、磨玻璃影(ground-glass opacity,GGO)、空洞、毛刺等。临床分期使用国际肺癌研究学会(IASLC)制订的第8 版肺癌分期标准[6]。
1.2 方法
1.2.1 实验室检查 采用免疫组织化学法分析PDL1 蛋白表达水平,一抗为单克隆小鼠抗人PD-L1 抗体(克隆22C3,稀释:1∶50,Dako)。评判标准:在至少有100 个活的肿瘤细胞癌巢中,部分或完整膜染色(≥1+)的肿瘤细胞占样本中所有肿瘤细胞的百分比为肿瘤比例评分(TPS)。以1% 作为临界值,TPS≥1%为PD-L1 阳性,<1% 为PD-L1 阴性;以50% 作为临界值,TPS≥50%为PD-L1 高表达,<50%为PD-L1 低表达[7]。
在至少1 000 个肿瘤细胞中Ki-67 阳性细胞的百分比来评估 Ki-67 增殖指数,≥20%的肿瘤细胞核染色为高表达,<20%为低表达[8]。
1.2.2 PET/CT 图像采集 PET/CT 图像采集设备为GE Discovery TMSTE 16 PET/CT 扫描仪。正电子显像剂为18F-FDG 放化学纯度>95%。显像前需要禁食>6 h ,空腹血糖 <11.1 mmol/L。静脉注射18F-FDG(3.7~4.4 MBq/kg),静息45~60 min后显像。首先采集低剂量CT 图像(采集电压140 kV,电流120 mA,层厚3.75 mm,螺距1.75,旋转时间0.8 s)。然后采集PET 图像(7~10 床位,2~3 min/床位)。再通过OSEM 迭代法进行重建(重建层厚3.27 mm),并通过CT 图像对 PET 图像进行衰减校正,最后得到PET/CT 融合图像。
1.2.3 图像分析 临床经验丰富的两名核医学医师使用Advantage Workstation 4.3 05 工作站进行PET/CT 图像阅片。勾画最大层面感兴趣区,获得肺癌原发灶标准摄取值(standardized uptake value,SUV),取其最大值(SUVmax),平均值(SUVmean);依据欧洲核医学协会最新推荐[9],将41%SUVmax作为阈值勾画肿瘤代谢体积(tumor metabolic volume,MTV),MTV与SUVmean的乘积为糖酵解总量(total lesion glycolysis,TLG)。
1.3 统计学分析
采用 SPSS 22.0 软件进行统计学分析,正态分布的计量资料以±s表示,非正态分布的计量资料以中位数表示。Pearsonχ2检验比较分类变量的统计学差异;独立样本t检验和Mann-WhitneyU检验比较连续变量的统计学差异。Spearman 相关检验分析不同变量之间的相关性。受试者工作特征(receiver operating characteristic,ROC)曲线分析SUVmax的最佳临界值。PD-L1表达与肺癌临床病理特征的关系采用Logistic 回归进行单因素和多因素分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者的临床特征
本研究共纳入241 例NSCLC 患者,平均年龄(64.29±8.85)岁,年龄范围(32~85)岁。241 例患者中,其中男性168 例,女性73 例;有吸烟史70 例,无吸烟史171 例;腺癌172 例,鳞癌69 例;中央型肺癌57 例,周围型肺癌184 例;含有GGO 成分44 例,不含GGO 成分197 例;有空洞43 例,无空洞198 例;有毛刺112 例,无毛刺129 例;淋巴结转移115 例,淋巴结未转移126 例;远处转移38 例,无远处转移203 例;Ⅰ期81 例,Ⅱ期41 例,Ⅲ期82 例,Ⅳ期37 例;ALK阳性14 例,阴性227 例;Ki-67 高表达186 例,低表达55 例。
以PD-L1表达状态进行分组:PD-L1 阳性153例,阴性88 例,其中腺癌PD-L1 阳性率56.98%(98/172),鳞癌PD-L1 阳性率79.71%(55/69);PD-L1高表达54 例,低表达187 例,其中腺癌PD-L1 高表达率17.44%(30/172),鳞癌PD-L1 高表达率34.78%(24/69)(图1,表1)。
2.2 PD-L1表达与NSCLC 临床病理特征的相关性
PD-L1 阳性组与阴性组:性别、Ki-67、T 分期、临床分期、GGO、病理分型、SUVmax、TLG 与PD-L1表达相关(P<0.05)。PD-L1 阳性组SUVmax、TLG 均高于阴性组(P<0.05),组间MTV 无明显统计学差异。鳞癌PD-L1 阳性率高于腺癌(79.71%vs.56.98%,P<0.05)。多因素分析表明,SUVmax、GGO 是NSCLC患者PD-L1 阳性的独立预测因素(OR=0.911,95%CI:0.865~0.960,P<0.05;OR=0.486,95%CI:0.240~0.960,P<0.05)(表1,2)。
PD-L1 高表达组与低表达组:性别、Ki-67、发病部位、空洞、病理分型、SUVmax、MTV、TLG 与PDL1表达相关(P<0.05)。PD-L1 高表达组SUVmax、MTV、TLG 均高于低表达组(P<0.05)。鳞癌PD-L1高表达率高于腺癌(34.78%vs.17.44%,P<0.05)。多因素分析表明:SUVmax、Ki-67 是NSCLC 患者PD-L1高表达的独立预测因素(OR=0.922,95%CI:0.874~0.972,P<0.05 ;OR=5.992 ,95%CI :1.348 ~26.630,P<0.05)(表1,2)。
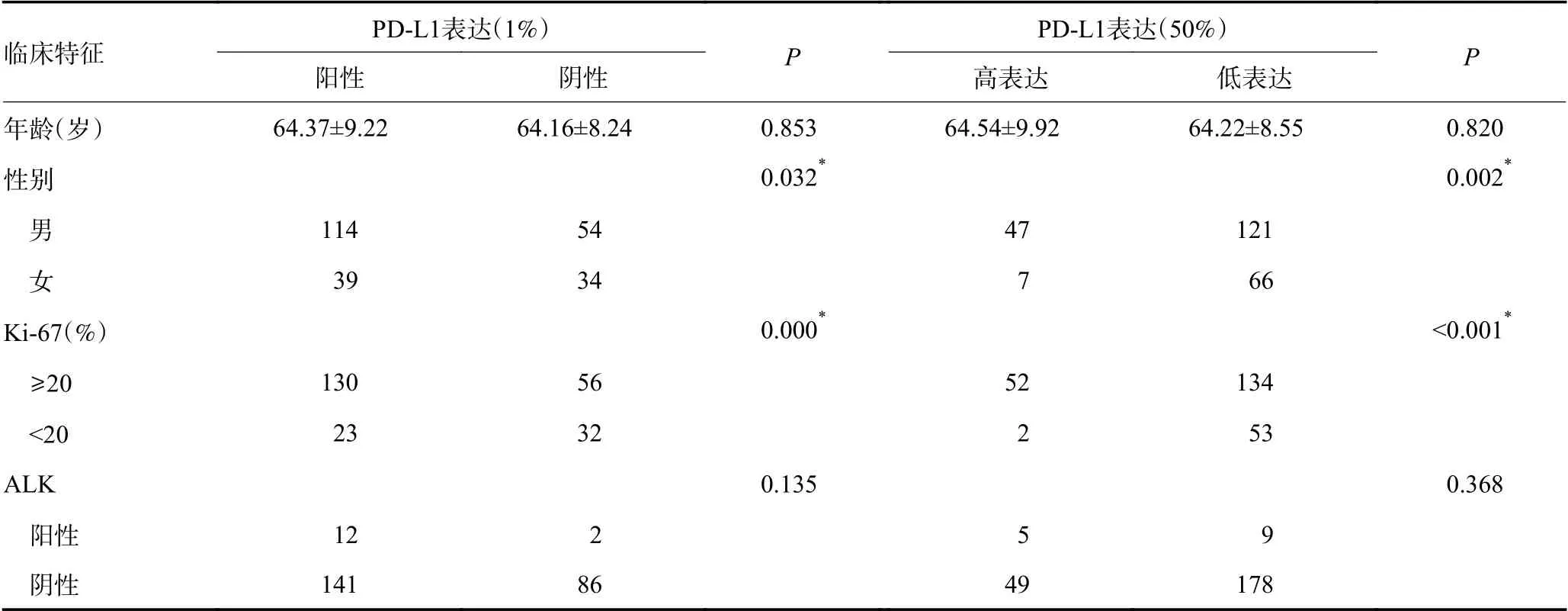
表1 PD-L1表达与NSCLC 患者临床病理特征的相关性
2.3 PD-L1表达与NSCLC 亚型临床病理特征的相关性
2.3.1 PD-L1表达与腺癌临床病理特征的相关性 PD-L1 阳性组与阴性组: Ki-67、GGO、SUVmax与PDL1表达相关(P<0.05)。PD-L1 阳性组SUVmax高于阴性组(P<0.05),组间MTV、TLG 差异无统计学意义。多因素分析表明,SUVmax是ADC 患者PDL1 阳性的独立预测因素(OR=0.928,95%CI:0.863~0.998,P<0.05)。勾画ROC 曲线确定SUVmax最佳临界值,当SUVmax取值4.4 时,预测PD-L1 阳性的敏感性、特异性分别为83.7%、41.9%(AUC:0.659,P<0.001)(图2,表3)。在ALK 阴性腺癌亚组中,多因素分析表明:SUVmax是ADC 患者PD-L1 阳性的独立预测因素(OR=0.925,95%CI:0.860~0.996,P<0.05)(表4);ALK 阳性腺癌仅12 例,暂不纳入统计学分析。
PD-L1 高表达组与低表达组:性别、Ki-67、SUVmax与PD-L1表达相关(P<0.05)。PD-L1 高表达组SUVmax高于低表达组(P<0.05),组间MTV、TLG差异无统计学意义。多因素分析表明,SUVmax、性别是ADC 患者PD-L1 高表达的独立预测因素(OR=0.878,95%CI:0.811~0.949,P<0.05;OR=3.220,95%CI:1.124~9.223,P<0.05)。勾画ROC 曲线确定SUVmax最佳临界值,当SUVmax取值6.85 时,预测PD-L1 高表达敏感性、特异性分别为93.3%、54.9%(AUC:0.773,P<0.001)(图2,表3)。在ALK 阴性腺癌亚组中,多因素分析表明:空洞、SUVmax是ADC 患者PDL1 高表达的独立预测因素(OR=3.351,95%CI:1.100~10.208,P<0.05;OR=0.886,95%CI:0.811~0.967,P<0.05)(表4)。
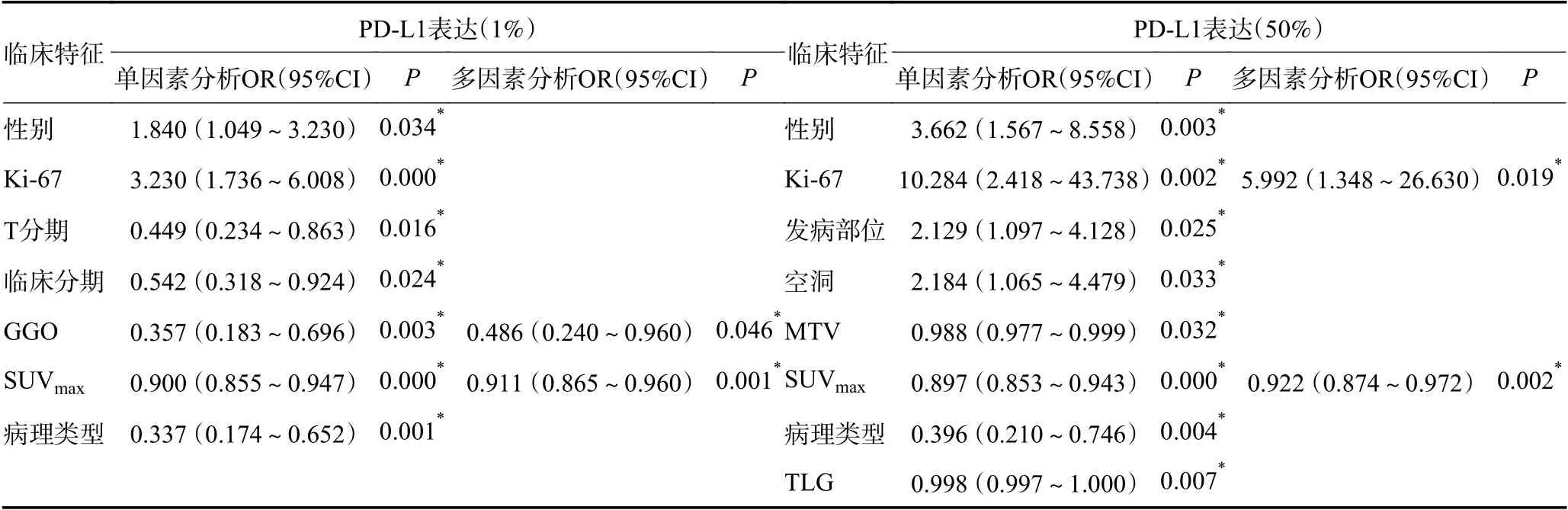
表2 单因素和多因素分析PD-L1表达与NSCLC 临床病理特征的关系
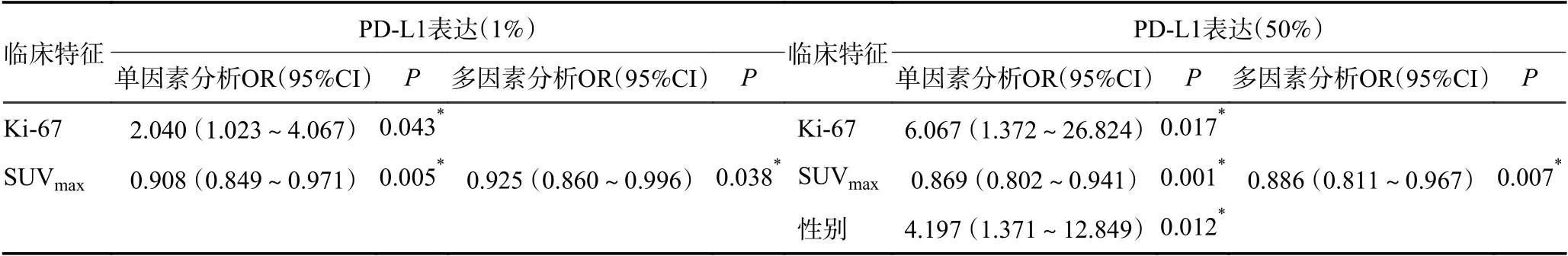
表4 单因素和多因素分析PD-L1表达与ALK 阴性腺癌临床病理特征的关系 (续表4)
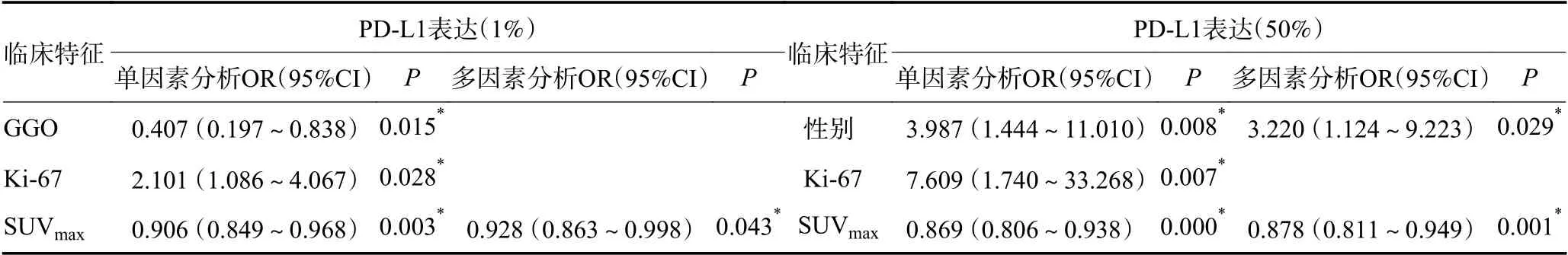
表3 单因素和多因素分析PD-L1表达与腺癌临床病理特征的关系

表4 单因素和多因素分析PD-L1表达与ALK 阴性腺癌临床病理特征的关系
2.3.2 PD-L1表达与鳞癌临床病理特征的关系 PDL1 阳性组与阴性组:单因素和多因素分析均表明SUVmax、MTV、TLG 与PD-L1表达无明显相关性(P>0.05)。
PD-L1 高表达组与低表达组:单因素和多因素分析均表明SUVmax、MTV、TLG 与PD-L1表达无明显相关性(P>0.05)。
3 讨论
免疫疗法改变了 NSCLC 患者的治疗策略,抗PD-1/PD-L1 免疫治疗能够改善PD-L1 高表达的晚期NSCLC 患者预后[10]。 然而,一次标准取样检查获得的肿瘤组织随机样本不能完全反映基因型信息,重复侵入性检查进一步增加了患者负荷,易引起不必要的医疗纠纷。因此,亟需一种预测PD-L1表达的无创生物标志物。研究表明SUVmax能够预测肺癌患者PDL1表达,在腺癌中SUVmax不仅是PD-L1 阳性的独立预测因素,也是其高表达的独立预测因素。
本研究分析了不同PD-L1表达状态下(1%和50%)代谢参数与PD-L1 的相关性,发现SUVmax是NSCLC 患者PD-L1 阳性的独立预测因素,这与先前研究结论一致[11-13],SUVmax亦是NSCLC 患者PD-L1高表达的独立预测因素,与部分研究结果一致[14-15]。然而,Jreige 等[16]研究发现PD-L1 的表达与SUVmax、MTV、TLG 均无明显相关性。这与大部分研究结果不符,原因可能是该研究仅纳入49 例NSCLC 病例,其观点有待大样本进一步证实。
SUVmax与PD-L1 的相关性可能与肿瘤浸润T淋巴细胞(tumor-infiltrating lymphocytes,TIL)糖代谢的改变有关。研究发现,肿瘤免疫逃逸与肿瘤微环境内的肿瘤代谢重编程密切相关[17-21]。1)在肿瘤微环境中代谢重编程使肿瘤细胞与免疫细胞竞争葡萄糖,导致被浸润的免疫细胞因糖代谢降低而失去抗肿瘤功能;2)代谢重编程通过调控糖酵解水平改变肿瘤微环境的pH 值,不利于抗原呈递细胞和T 细胞的成熟和激活[22]。Chang 等[23]研究进一步证实了肿瘤大量消耗葡萄糖可能导致T 淋巴细胞糖酵解能力减弱,进一步限制其发挥免疫功能,是肿瘤进展的原因之一。他们直接阻断PD-L1,肿瘤细胞糖酵解相关酶的活性随之降低,糖酵解受抑制,这间接反映了PD-L1 在肿瘤糖代谢中的作用。PD-1/PD-L1 通路通过影响糖代谢来抑制淋巴细胞增殖和细胞因子的产生,诱导淋巴细胞凋亡和免疫耐受,在免疫抑制中发挥重要作用[24-26]。
在腺癌亚组分析中,SUVmax不仅是PD-L1 阳性的独立预测因素,也是其高表达的独立预测因素,这与先前研究结论相近[11-14,27]。在ALK 阴性腺癌中,SUVmax也能预测PD-L1表达状态。在鳞癌亚组分析中,SUVmax与PD-L1表达均无明显相关性。与本次研究结论不同,Takada 等[11]研究表明SUVmax均能预测腺癌和鳞癌PD-L1 的表达。而在神经内分泌肿瘤患者中,SUVmax与PD-L1表达无相关性。Zhao 等[13]亚组分析也发现:SUVmax是预测鳞癌PD-L1 阳性表达的唯一独立预测因素。与本研究结果的差异可能由多种因素引起。首先,FDG 的摄取受肺癌组织学亚型的影响[28],不同组织类型中,SUVmax与PD-L1表达的相关性可能存在差异。其次,本研究中,鳞癌病例较少,扩大样本量可能得出阳性结果。
此外,本研究还存在一定的局限性。1)PD-L1表达的检测方法多样。目前,已有4 种PD-L1 检测方法被美国食品药品监督管理局(FDA)批准投入临床使用,分别为基于Dako 平台的28-8、22C3 和基于Vantana 平台的SP142 和SP263 单克隆抗体。不同的免疫组化方法可能会影响诊断的准确性[29-30]。本研究仅采用了1 种单克隆抗体(22C3),需要不同检测方法的对比分析以提高结果的可信度;2)本研究为单一机构的回顾性研究,需要多中心研究进一步验证。
在ADC 中,SUVmax是PD-L1 阳性的独立预测因素,也是PD-L1 高表达的独立预测因素。18F-FDG PET/CT 显像的代谢参数能够预测ADC 患者PD-L1表达状态,为免疫治疗提供依据。
