我国H9N2亚型禽流感病毒血凝素蛋白145和153位抗原位点变异分析
2022-04-24陈子轩全柯吉陈素娟彭大新刘秀梵
陈子轩,张 楠,胡 群,全柯吉,秦 涛,陈素娟*,彭大新*,刘秀梵
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
H9N2亚型禽流感病毒(avian influenza virus, AIV)于1966年首次在美国威斯康星州被发现。我国于1992年在广东首次报道发现H9N2亚型AIV,并随之在南方各省迅速传播。目前是中国流行最广泛的低致病性AIV,可和其他病原发生混合感染造成死亡率上升,引起严重的经济损失。此外,它可为新出现的重配病毒如H7N9亚型AIV等提供供体基因[1],同时报道显示有部分家禽养殖从业者血清呈H9亚型AIV抗体阳性,因此病毒的传播也存在很大的公共卫生隐患[2]。
为防控我国H9N2亚型禽流感,以A/Chicken/Shanghai/F/1998(H9N2)为代表的全病毒灭活疫苗在家禽养殖中广泛使用[3]。目前,主要流行的毒株属于h9.4.2.5谱系,HA基因的遗传进化分析表明,当前流行株与疫苗株的核苷酸遗传距离较远[4-5]。基于交叉血凝抑制和交叉微量中和试验的抗原图谱分析研究中,流行株和疫苗株可形成不同的抗原分群,疫苗株的免疫血清难以有效中和抗原差异大的流行株,疫苗株与流行株不匹配,从而导致了免疫失败[6]。在疫苗的免疫压力下,AIV更易发生抗原漂移[7]。因此,探究H9N2亚型 AIV抗原变异的分子基础是解析当前流行株抗原性改变的关键。
目前,虽已报道了H9N2 AIV抗原位点鉴定的相关研究,并将HA蛋白头部的抗原区域分为两个独立表位[8]。但前人鉴定的与抗原性相关的位点在自然流行株中很多都保守,不足以解释我国当前H9N2亚型AIV流行株抗原性改变的原因[9]。因此,本研究利用研制的单抗对抗原位点进行了鉴定,并对本实验室2017—2019年分离的H9N2亚型AIV进行了抗原谱分析,分析相关抗原位点的变异规律。
1 材料与方法
1.1 病毒和单抗
H9N2亚型AIV A/chicken/Shanghai/F/1998(F98)毒株为本实验室保存。其相应单抗2E4[10]和2D6[11]为本实验室制备。
1.2 血凝抑制试验和中和试验
血凝抑制试验(hemagglutinin inhibition,HI)按照世界动物卫生组织(World Organization for Animal Health,OIE)的标准进行操作。微中和试验按照文献[12]进行操作,利用Reed-Muench法计算病毒在CEF细胞上的TCID50,再将2 000 TCID50·mL-1的病毒工作液与等体积的两倍倍比稀释的抗体进行孵育,其中每种稀释度设置3个重复,37 ℃孵育1.5 h后,按照100 μL·孔-1接种于长有CEF细胞的96孔细胞板中,37 ℃吸附1 h后,再换液为含有2 μg·mL-1TPCK胰酶的M199培养基培养,72 h后通过测定上清HA效价判定结果。HA效价为阴性的抗体最高稀释度为该抗体的中和效价。
1.3 单抗逃逸突变株的筛选和抗原位点的鉴定
根据文献报道[13-14]并做适当改进开展逃逸突变株筛选,将0.1 mL 的106TCID50的F98病毒与0.5 mL单克隆抗体进行混合,室温孵育1 h后,将抗原抗体混合物接种于9~11日龄的SPF鸡胚(n=3),72 h后收取具有HA效价的尿囊液,所收获病毒尿囊液通过有限稀释法进行进一步筛选。将稀释至10-3的阳性尿囊液0.1 mL与单抗0.5 mL混合,室温孵育1 h后,将抗原抗体混合物再稀释至10-1、10-2、10-3、10-4稀释度,200 μL·胚-1接种鸡胚(n=3),72 h后收取最高稀释度的有HA效价的尿囊液。再按上述有限稀释法重复筛选1次。
提取纯化后病毒的RNA,利用RT-PCR扩增HA基因片段,电泳切胶测序。使用MegAlign软件比对逃逸株和母本毒株F98的氨基酸序列差异。
1.4 抗原谱分析
使用MEGAX软件中的MUSCLE将实验室2017—2019年度分离的H9N2亚型AIVHA基因进行序列比对,绘制Neighbor-joining遗传进化树,Bootstrap设置为1 000进行检验。使用iTOL对遗传进化树进行美化[15]。根据遗传进化树选择代表性H9N2亚型AIV毒株,通过HI效价确定单抗与病毒的反应性。
1.5 HA基因序列比对
在全球流感数据共享平台(Global Initiative on Sharing Avian Influenza Data,GISAID,https://platform.gisaid.org/epi3/frontend#2a8325)中下载从1996—2021年度(截至6月5日)中国地区禽类中分离的H9N2 AIVHA基因序列,使用Phylosuite软件中的MATFF进行序列比对,统计145和153位点的氨基酸变异情况。
1.6 位点模拟分析
以蛋白质三维结构数据库(PDB, https:/www.wwpdb.org/)中的H9N2亚型病毒HA1分子晶体结构(编号:1 JSD.1.A)为模板,在网站SWISS-MODLE(https://www.swissmodel.expasy.org/interactive)将F98 HA1蛋白序列用Alignment Mode方法建模。生成的HA1分子用pymol软件进一步分析和修饰。
2 结 果
2.1 单抗2E4和2D6的生物学特性
2E4和2D6针对母本毒株F98的HI效价均为213;微量中和试验结果显示,2E4和2D6针对F98的中和效价分别为1∶10 240和1∶2 560(表1)。

表1 单抗的生物学特性
2.2 单抗逃逸突变株的筛选和抗原位点的鉴定
在单抗2E4和2D6作用下收获的阳性尿囊液,再在鸡胚中经过两轮有限稀释法的纯化后获得了两株突变株(m2E4-1和m2D6-1),对应筛选抗体的HI效价均≤22(表2)。进一步对突变株m2E4-1和m2D6-1的HA基因与母本毒株F98的HA基因进行比对,发现m2E4-1在434位核苷酸位点发生G→A的突变,导致145位氨基酸位点产生了S→N的替换,由此形成了145—147位NGT模式的潜在糖基化位点。m2D6-1在459位发生A→T的突变,相应的出现了D153E的氨基酸替换(表3)。

表2 逃逸株与单克隆抗体交叉血凝抑制结果

表3 抗原位点鉴定结果
2.3 抗原谱分析
2017—2019年度分离的H9N2亚型AIVHA基因遗传进化树显示分离株均属于h9.4.2.5谱系(图1)。

●.参考株;△.抗原谱分析毒株
在遗传进化树上,将毒株划分为两个大分支Group 1(32/109)和Group 2(77/109),两个Group 的组间平均遗传距离为7.22%(图1)。
从Group 1挑选的5株代表株和Group 2挑选的16株代表株测定与单抗的反应性。Group 1的毒株与单抗2E4的HI效价均≥27,与单抗2D6的HI效价均≥210;Group 2中所有毒株与单抗2E4的HI效价均在20~22,A/chicken/Jiangyin/JY110712/2018和A/chicken/Jiangyin/JY010220/2019毒株与单抗2D6的HI效价分别为25和24以外,其余14株毒株HI效价均为20(表4)。
比对用于抗原谱分析毒株的HA基因的145位和153位氨基酸发现,Group 1毒株的HA蛋白在145位和153位均分别为S(5/5)和D(5/5),Group 2毒株HA蛋白145位均突变为D(16/16),153位突变为G(15/16)。但A/chicken/Jiangyin/JY110712/2018与单抗2D6的HI效价为25,但是其153位却为D(表4)。

表4 单抗2E4、2D6抗原谱分析结果和145位、153位氨基酸位点的突变情况
2.4 禽源H9N2亚型AIV相应位点自然突变率分析
自GISAID中下载的禽源H9N2毒株AIV HA蛋白序列,对145位分析后发现,在1996—2009年和2010—2014年分离株中,含145S的分离株都占57%,在2015—2021年分离株中,含145D的分离株占68%。在1996—2009年和2010—2014年分离株中,含145N的分离株分别占6%和10%,2015—2021年无含145N的分离株。对153位分析后发现,含153D的分离株在1996—2009年和2010—2014年中分别占57%和53%,含153G的分离株在2015—2021年占66%。鸡源和鸭源毒株变化趋势一致(图2)。

图2 禽源H9N2 亚型AIV HA蛋白145和153位氨基酸位点的自然突变率
2.5 抗原位点结构模拟分析
从HA1分子的模拟构象可以看出,145和153位均位于分子的头部的受体结合区域(receptor binding site,RBS)附近(图3)。与145S相比,145 N和145D的残基侧链更长,突出HA1分子表面。与153D相比,153E和153G的残基侧链更长,突出HA1分子表面。
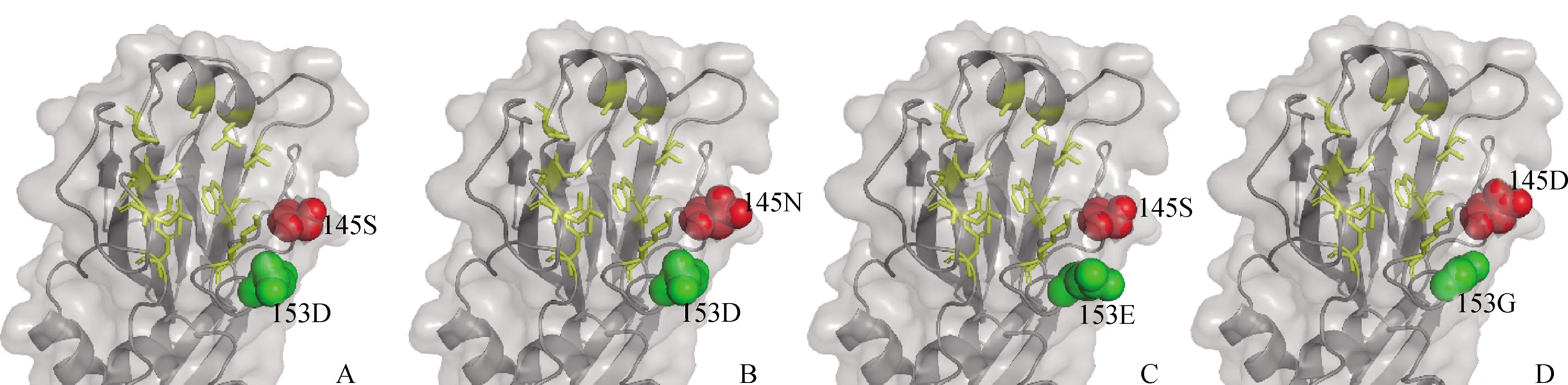
A.F98 HA1(145S 153D)分子模拟构象;B.F98 HA1(145N 153D)分子模拟构象;C.F98 HA1(145S 153E)分子模拟构象;D.F98 HA1(145D 153G)分子模拟构象。黄色:Y109、S148、W161、T163、N191、P194、A198、L202、Q234和G236为RBS区域
3 讨 论
H9亚型AIV是我国感染最广泛的低致病性AIV,目前的H9亚型毒株在各种选择压力下已经发生了变异,导致抗原性出现了改变。从本实验室前期制备的H9N2亚型AIV HA蛋白单抗中选取了两株HI效价高的单抗,经过鉴定也有很高的微中和效价。将F98毒株与单抗孵育后在SPF鸡胚中传代,筛选到逃逸突变株m2E4-1和m2D6-1,其HA蛋白分别拥有S145 N和D153E的突变。Kaverin等[16]将鉴定的抗原位点划分成了Site Ⅰ、Site Ⅱ和Overlapping 3个区域,其中145位于Site Ⅰ和Site Ⅱ重叠的Overlapping区域,153位于Site Ⅱ区域。单抗2E4对m2D6-1的HI效价为29,单抗2D6对m2E4-1的HI效价为210,和母本毒株相比略有降低,证明这两个抗原位点相互影响较小,与Kaverin等[16]的结果相一致。
S145N的突变使得HA蛋白在145—147位产生了1个NGT氨基酸模式的潜在糖基化位点。研究表明,在毒株的HA分子对唾液酸受体处于高亲和力时,HA分子头部RBS附近的糖基化位点会影响病毒对细胞的入侵,从而产生对疫苗免疫的逃逸[17]。朱寅彪等[13]也利用一株HI中和效价很高(分别为214和104.3)的HA单抗筛选到S145N的单抗逃逸突变体,另外他发现HA基因为145T的毒株也可以发生逃逸,而我们的抗原谱分析中发现拥有145D突变的毒株也会引起单抗逃逸,因此糖基化不是该位点逃逸单抗的唯一机制。并且145和153两个位点均位于HA1分子的头部RBS附近,推测单抗的中和效果来源于识别了RBS附近的表位,从而屏蔽RBS与唾液酸受体的结合[18]。并且相对于F98毒株145S和153D的结构,突变后的氨基酸因为相比于原模式氨基酸侧链更长,更突出于HA1分子的表面,可能会直接影响到与抗体的结合能力[19]。
申松玮等[20]将2017—2018年度分离的H9N2亚型AIVHA基因划分为两个组,其组间遗传距离为6.71%。笔者划分的Group 1和Group 2的组间遗传距离为7.22%,与其基本一致。申松玮等[20]对两个组代表株的交叉HI结果进行R值评估后发现,两个组内抗原性相近,但两组间的抗原性不同,可分为两个抗原型。本研究HI抗原谱分析显示示,Group 1内毒株与单抗的反应性好,而Group 2内毒株与单抗的反应性差,单抗2E4反应谱与基因分型一致,表明单抗2E4可用于当前H9N2亚型AIV的抗原分型。在145位,Group 1代表株均为S,Group 2代表株均为D;在153位,Group 1代表株均为D,Group 2代表株除1株外其余均为G。可见S145D的替换在两个Group 中的符合性更高,145位更适合作为鉴定病毒抗原变异的分子靶标。
朱寅彪等[13]发现含145N的病毒在鸡源和鹌鹑源的自然分离率为10%左右(截至2015年),这与作者分析的2014年之前145N占比相一致。但1996—2021年间禽源H9N2亚型AIV分析显示近年来含145D和153G的突变株占比分别为68%和66%,说明Group 2抗原型已成为流行的主要抗原型。因此利用单抗2E4对流行株进行抗原分型,加强对145位氨基酸位点的检测尤为重要。
4 结 论
单抗2E4与2D6分别识别H9N2亚型禽流感病毒HA头部的145位和153位抗原位点。我国流行株中存在两种抗原群,单抗2E4可以对两种抗原群进行区分,抗原位点145位是鉴别Group 1和Group 2抗原群差异的分子靶标之一,为H9N2亚型禽流感的防控提供了疫苗选择依据。
