牛腺病毒3型的研究进展
2022-04-24何姝凡
何姝凡,岳 华,2,汤 承,2,刘 杰,2*
(1.西南民族大学畜牧兽医学院,成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041)
牛腺病毒3型(bovine adenovirus type 3,BAdV-3)为腺病毒科(Adenoviridae)哺乳动物腺病毒属(Mastadenovirus)的成员,为无囊膜的线性双链DNA病毒,可引起牛发热、呼吸道症状、犊牛肺炎和轻微肠道症状,是导致牛呼吸道疾病的重要病原之一[1-2]。牛呼吸道疾病综合征(bovine respiratory disease complex, BRDC)是由多种病原体混合感染引起的一类危害严重的牛呼吸系统疾病[3],该病在世界范围内广泛存在,据统计养牛业中65%的疾病与牛的呼吸道疾病相关,感染率达100%,死亡率可达35%或更高,该病每年给全世界养牛业造成巨大的经济损失[4]。先前的研究认为导致BRDC的病毒主要有牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛副流感3型病毒(bovine parainfluenza virus type 3,BPIV3)、牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)、牛病毒性腹泻-黏膜病病毒(bovine viral diarrhoea virus,BVDV)等[5-7]。但最近陆续有研究报道BAdV-3在出现BRDC症状的牛群中被广泛检出,并且与该病的发生显著相关(P<0.000 1)[8-9]。本实验室对四川11个引种肉牛场暴发的BRDC进行病原学检测,结果显示,BAdV-3的阳性率高达78.7%,并成功分离到1株纤突基因(fiber)存在缺失和替换的BAdV-3毒株(BO/YB24/17/CH),并且证实该缺失型在我国具有广泛的地域分布[10]。由此可见BAdV-3也是引发BRDC的一个重要病毒性病原,在我国可能存在独特的进化趋势,应引起足够的重视。因此本文综述了BAdV-3在生物学特性、流行病学、致病性、检测技术等方面的国内外最新进展,以期为后续科学研究以及相关疾病的有效防控提供参考。
1 BAdV-3的生物学特性
1.1 结构
BAdV-3为无囊膜包裹的线性双链DNA病毒,核衣壳呈二十面体立体对称,直径为70~90 nm。其核衣壳由252个壳粒组成,包括240个六邻体(hexon)和12个五邻体(penton)。六邻体是二十面体的20个面和棱的主要组成部分,五邻体是由宽7 nm的基部与由基部外伸出的长约15 nm的纤突(fiber)组成,位于病毒粒子的12个顶端。纤突分为三个结构域:尾区(tail)、轴区(shaft)和旋钮区(knob),其长度因不同的血清型而异,knob区位于顶端是一个直径4 nm的球状物,血凝素(HA)也位于该部位,病毒感染细胞时knob区首先与细胞受体结合。
1.2 基因组特征及编码蛋白
1.2.1 基因组结构 BAdV-3的基因组全长约为34 kb, 其中G+C的比例约为54%,A+T的含量约为46%[11]。基因组的5′和3′两端各有一段约195 bp的反向末端重复序列(inverted terminal repeats,ITR)。根据病毒入侵细胞之后各个基因表达时间的差异,将其分为早期基因(E1~E4)、中期基因(plX、IVa2)和晚期基因(L1~L7)(图1)。
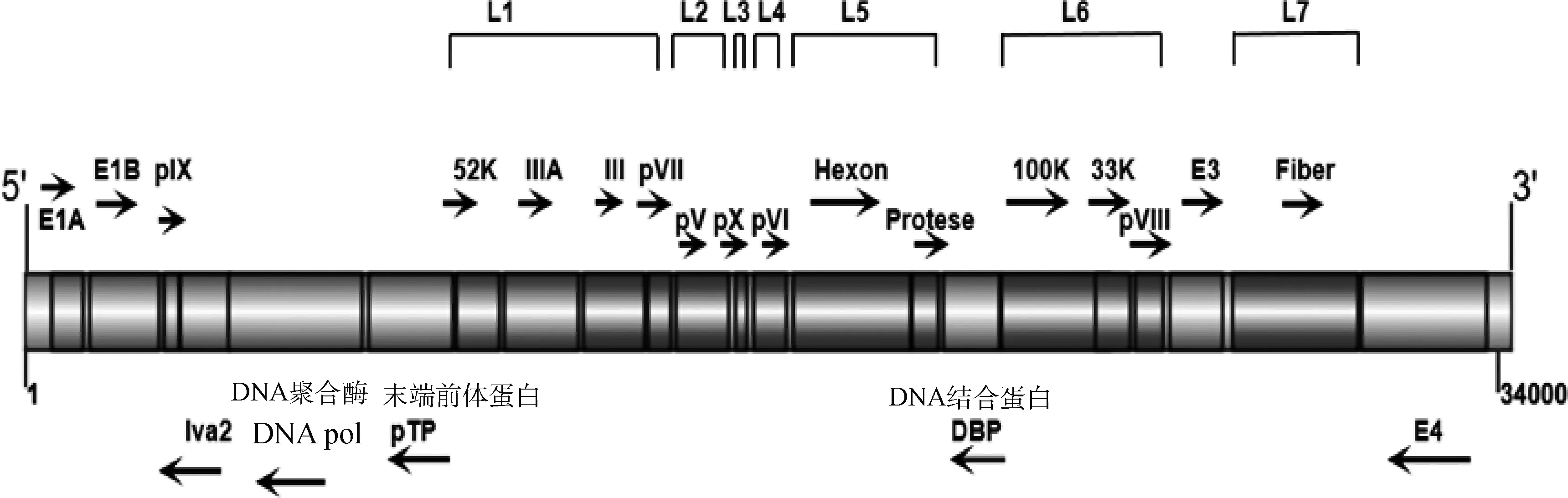
图1 BAdV-3的基因组结构模式图
早期基因E1区位于基因组左末端,主要参与病毒的复制,可以进一步分为E1A和E1B。病毒进入细胞核后,细胞转录因子首先与E1A区上游的增强子结合,表达E1A蛋白,该蛋白的作用包括两个方面:1)调节细胞代谢,使病毒更易在细胞中复制,2)激活 E1B等其他早期转录单位的启动子[12]。最近的研究发现BAdV-3 E1区编码了一种新的结构蛋白155R,但该结构蛋白不参与病毒的复制[13],其具体作用还有待进一步研究;E2区包括E2A和E2B,E2A编码DNA结合蛋白(DNA binding protein, DBP),E2B编码DNA聚合酶(Pol)和末端前体蛋白(pTP)。3个蛋白参与了病毒的复制以及诱导晚期基因的转录和翻译;E3区编码两种蛋白284R和121R,虽然不参与病毒基因组的复制,但其产物可抑制MHC Ⅰ类抗原的呈递以及肿瘤坏死因子的表达,从而破坏宿主的免疫防御机制[14];E4区位于基因组3′端的末端,包含5个开放阅读框(ORF1~ORF5),其编码蛋白在不同层面上参与了病毒感染过程。E4区域缺失的病毒在DNA复制、晚期mRNA合成以及宿主细胞蛋白合成等方面存在严重缺陷[15]。
中期基因主要编码两种结构蛋白:pIX蛋白和IVa2蛋白。pIX蛋白是病毒粒子的一种结构成分,含有125个氨基,起着转录激活因子的作用[16]。IVa2 蛋白功能为促进主要晚期启动子(MLP)的活化,并且参与核/核仁定位以及与PV蛋白的相互作用[17-18]。此外IVa2 蛋白还可作为ATP酶为腺病毒基因组包装到衣壳中提供动力[19]。
晚期基因 L1区包含52K、IIIA、III(penton)和pVII四种蛋白。52K蛋白含有331个氨基酸,与其他腺病毒相比,相似性为21%~61%。IIIA蛋白是病毒粒子上的一种磷蛋白,参与形成六邻体多肽,在病毒组装过程中被病毒蛋白酶水解[20]。III蛋白与纤突蛋白一起组成五邻体,在病毒入侵宿主细胞中起着重要的作用。pVII蛋白是构成腺病毒核心的主要蛋白,参与了腺病毒基因组进入细胞核以及子代DNA包装到衣壳的过程。也有报道证明BAdV-3能将pVII蛋白转移到宿主细胞的线粒体上,通过抑制线粒体膜电位(MMP)的丢失和增加线粒体Ca2+和ATP的产生来干扰细胞凋亡[21-23]。L2区只编码pV蛋白,含有423个氨基酸。pV蛋白是病毒颗粒正常组装所必需的,当其缺失会影响衣壳的完整性,从而导致BAdV-3的感染性消失[24];L3区编码pX蛋白,pX蛋白中心结构域富含碱性氨基酸,该区域可能介导了与病毒DNA的结合[25];L4 区编码pVI 蛋白,包含263个氨基酸,是病毒粒子衣壳的组成成分;L5区域编码六邻体蛋白和蛋白酶。L6区域编码结构蛋白pVIII和非结构蛋白100K、33K。pVIII是一种六邻体相关蛋白,在病毒感染过程中起着重要的作用,其与真核生物启动因子6(eIF6)的相互作用可能有助于在腺病毒感染的后期阶段优先翻译腺病毒基因[26]。33K蛋白是一种多功能蛋白,在病毒感染过程中与100K和pV蛋白发生相互作用[27]。100K蛋白能将六邻体多肽折叠,所以也称为六邻体组装蛋白。L7区域主要编码纤突蛋白。
1.2.2 BAdV-3的主要蛋白 在此着重介绍DNA结合蛋白、六邻体蛋白和纤突蛋白。
1.2.2.1 DNA结合蛋白基因及其编码蛋白:DBP基因长度约为1 298 bp,编码432个氨基酸,主要参与病毒DNA的复制。DBP含有一个可变的氨基端结构域和一个保守的羧基端结构域。N-末端为弱保守区域,能被广泛磷酸化,其对于DNA复制是非必需的,但它含有核定位信号(NLS),决定着宿主的特异性。非磷酸化的C-末端结构域在各种血清型中高度保守,具有核酸结合特性,它们在DNA结合和复制以及主要晚期启动子(MLP)的转录激活中起重要作用。在DNA复制过程中,DBP具有催化DNA解旋,使得DNA双链不稳定的能力,所以又称之为螺旋失稳蛋白。在链的延伸过程中DBP能保护置换合成的单链不受核酸酶的攻击,增加DNA聚合酶的合成速率[28-29]。
1.2.2.2 六邻体基因及其编码的蛋白:Hexon基因长度为2 706~2 733 bp,编码约910个氨基酸,是BAdV-3的主要抗原蛋白。Hexon是BAdV-3最保守的基因之一,不同型别的六邻体相似性可以达到78%~95%,因此常被选作PCR检测BAdV-3的靶基因。型特异性和群特异性表位位于这些保守区域,可作为病毒感染性疾病诊断的靶抗原位点[30]。Hexon的分子结构为紧密排列的同源三聚体,每个亚基被锁定在适当的位置,形成保护病毒粒子内部的蛋白外壳。Hexon分子的塔区由3个loop环构成(L1、L2、L4),L1和L2环中的氨基酸序列存在多个位置高度可变,被定义为7个高变区(HVRs)。中和抗原表位存在于这7个HVRs上,产生的中和抗体具有型别特异性,可以使其不再被同型的腺病毒所感染[31-32]。研究表明,人腺病毒3型(HAdV-3)病毒HVRs的变异可能会破坏因先前感染而获得的免疫,发生免疫逃避[33]。
1.2.2.3 纤突基因及其编码的蛋白:BAdV-3完整的fiber基因长度为2 931 bp,编码976个氨基酸,主要参与病毒与细胞表面受体的初始附着。Fiber包含3个结构域:尾区(tail)、轴区(shaft)和旋钮区(knob)。尾区高度保守,以非共价方式与多肽III连接,共同构成五邻体。旋钮区为氨基酸羧基末端片段折叠而成的直径为4 nm的球状物,能与细胞受体结合,同时其上含有抗原表位,能产生抗BAdV-3的中和抗体,与六邻体一起参与诱导宿主的免疫应答。两个末端结构域之间的区域为轴区,含有 46.5 个重复基序[34-36]。目前研究表明轴区的长短以及旋钮区的变异对病毒的组织嗜性和免疫逃避起决定性作用。Shayakhmetov等[37]通过构建一系列含有轴区长短不一的腺病毒5型的衣壳载体,发现这些载体在细胞吸附和感染方面存在显著差异。Wu和Tikoo[38]发现通过用人腺病毒5型(HAdV-5)替换BAdV-3的knob区域后,病毒组织嗜性发生了改变,对非牛源的细胞系也易感。而Myhre等[39]通过缺失HAdV-5的knob区后发现,可以使重组病毒具有逃避中和抗体的作用。
1.3 遗传与进化
目前,GenBank中有11个BAdV-3全基因组数据和13个hexon和fiber基因序列,其中10个全基因组数据来自国外,其相似性为100%(登录号为AC_000002.1、AX338887.1、AR178749.1、AF030154.1、BD133132.1、BD409754.1、DD453126.1、DL136070.1、NC001876.1和 HV975272.1),只有1个全基因组来自中国(登录号为JN381195.1),为朱远茂等于2009年在黑龙江的1头患有呼吸道疾病病牛的鼻拭子分离得到,命名为 HLJ0955株。中国毒株与国外毒株核苷酸相似性为95.5%,主要差异表现为HLJ0955株的ITR区、E1B区和E4 ORF1区与国外毒株相比存在碱基缺失。在13个完整的hexon和fiber序列中,包括了本实验室登录的BO/YB24/17/CH株(登录号为MN912513.1和MN912514.1)。Hexon基因之间的核苷酸和氨基酸相似性分别为90.10%~100.00%和92.9%~100.0%,fiber基因之间的核苷酸和氨基酸相似性分别为83.17%~100.00%和71.27%~100.00%。对BAdV-3基因组以及完整的hexon和fiber基因序列构建系统发育树分析发现,中国的两株BAdV-3毒株与国外毒株有明显差异,聚为不同的分支上,表明BAdV-3在我国有不同的遗传进化方向(图2、图3)。
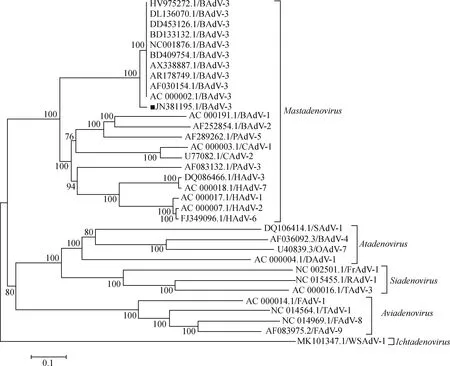
GenBank登录号和病毒名称的缩写在分支的末端(B.牛;C.犬;F.禽;Fr.青蛙;H.人;O.羊;P.猪;T.火鸡;WS.白鲟;■.中国毒株 HLJ0955 的序列)
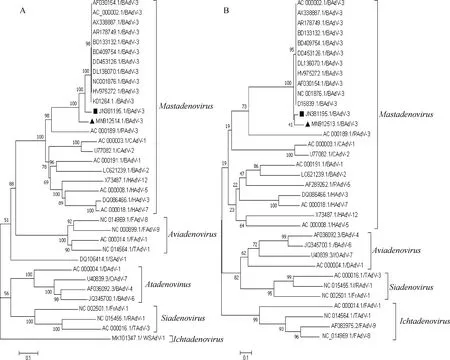
A.Hexon基因进化分析;B.Fiber基因进化分析;GenBank登录号和病毒名称的缩写在分支的末端(B.牛;C.犬;F.禽;Fr.青蛙;H.人;O.羊;P.猪;T.火鸡;WS.白鲟;▲.BO/YB24/17/CH毒株;■.HLJ0955毒株)
1.4 体外培养特性
BAdV-3 能够在牛肾细胞系(MDBK)生长良好,也能在牛鼻甲细胞(BTu)、鹿鼻甲细胞(DTu)、牛甲状腺细胞(CTY)、牛睾丸细胞(CT)中增殖[40-42],并产生特征性细胞病变:细胞肿胀变圆,颗粒增多,折光性变强,拉丝、细胞膜萎缩聚集,形成嗜碱性或嗜酸性核内包涵体,最后自瓶壁脱落。牛肾细胞系是BAdV-3最易感的细胞系,因此作为常用的体外细胞模型。
2 BAdV-3流行与病毒分离
自1965年Darbyshire等[43]首次从健康牛结膜中分离到BAdV-3,BAdV-3已在多个国家被检出,包括英国、美国、日本、伊朗、土耳其、芬兰、巴西、中国等,地域涵盖亚洲、欧洲、非洲、南美洲、北美洲[9,44-46]。血清学调查显示在伊朗、波兰、比利时等地的牛群中抗体阳性率为46.7%~61.9%[47-49],而Yeilba等[50]对土耳其部分牛场的未免疫的牛群进行了血清学调查,研究表明 BAdV-3特异性中和抗体阳性率竟高达92.3%。最近日本学者Ng等[8]对50头有BRDC症状的加州乳牛通过宏基因组学的方法对其鼻拭子中的病毒进行检测,结果显示BAdV-3在鼻腔分泌物中阳性检出率高达48%,与BRDC的发生显著相关(P<0.000 1),说明BAdV-3不仅呈现高检出率,并且与呼吸道疾病的发生有紧密联系。2009年,国内首次报道从黑龙江的1头患有呼吸道疾病病牛的鼻拭子中分离到1株BAdV-3,证实了国内 BAdV-3 的存在[51]。随后严昊等[52]对哈尔滨市周边地区的牛场进行了检测,BAdV-3 血清阳性率为20.6%。2015年,杨萌[53]对我国咸阳市部分奶牛场进行血清学调查,阳性率为46.65%,说明BAdV-3已在国内普遍流行。2018年,本实验室对四川省11个引种肉牛场中患BRDC的牛进行检测,对采集的108份BRDC临床样本进行荧光定量PCR检测,BAdV-3检出率高达78.7%,并成功分离到1株fiber基因存在缺失和变异的BAdV-3毒株(BO/YB24/17/CH),其在fiber shaft区域缺失79个氨基酸并有55个独特的氨基酸替换,knob 区域有16个独特的氨基酸替换(图4)。进一步流行病学调查结果显示该缺失株在引种肉牛中普遍存在,且来自5个省区(山东、辽宁、山西、黑龙江和内蒙古自治区),具有广泛的地域分布,这可能反映了BAdV-3在我国具有独特的进化趋势[10]。并且张颖慧等[54]对这批BRDC样本进行混合感染调查,结果共检测出9种呼吸道常见病原,包括牛病毒性腹泻病毒(BVDV)、牛传染性鼻气管炎病毒(IBRV)、牛副流感病毒3型(BPIV3)、牛支原体(M.bovis)和溶血性曼氏杆菌(M.haemolytica)等,表明BAdV-3常与其他病毒混合感染。此外,BAdV-3除了感染牛外,在异种动物山羊、绵羊以及羊驼中也有检测到BAdV-3阳性抗体,表明BAdV-3可能存在跨种间传播[55-56]。
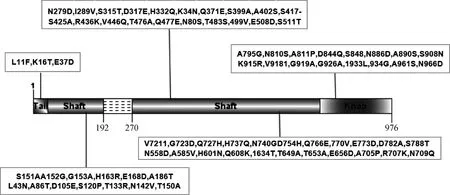
虚线表示BO/YB24/17/CH的轴区192~270位氨基酸缺失;黑框内显示BO/YB24/17/CH与所有现有的9个BAdV-3完整fiber序列相比独特的氨基酸突变
3 BAdV-3的致病性
BAdV-3在自然条件下主要感染牛,常常伴随其他呼吸道病原混合感染,单独感染时临床表现轻微,主要引起呼吸道症状和肠道症状。不同年龄的牛均可感染BAdV-3,但不同年龄表现出的症状有所不同,成年牛通常无症状或仅有温和的上呼吸道症状,犊牛则可表现出明显的临床症状。对新生犊牛进行人工攻毒试验,可导致犊牛出现肺炎、双向热、呼吸困难、食欲减退等症状[57]。BAdV-3感染牛的病理变化主要局限于肺,组织病理学变化表现为炎症细胞浸润、坏死性支气管炎,Ⅱ型肺泡细胞增生、肺泡壁增厚等[58]。Narita 等[59]通过支气管插管的方法对1周龄和3月龄的小牛进行BAdV-3攻毒试验,攻毒后均出现坏死性支气管炎和肺泡炎,并伴有炎症细胞的浸润和Ⅱ型肺细胞增生,仅在一周龄小牛退化的上皮细胞中检测到核内包涵体、BAdV-3抗原和病毒颗粒。此外,BAdV-3还对实验动物有致病性。Mittal等[60]通过滴鼻接种棉鼠发现,BAdV-3能够在棉鼠肺和气管有限复制,病理组织学变化表现为肺泡上皮细胞脱落和坏死、支气管上皮细胞增生、嗜酸性包涵体、肺泡内Ⅱ型增生性肺炎以及淋巴细胞浸润,与BAdV-3在牛上的症状一致。史鸿飞[61]对中国分离到的BAdV-3 HLJ0955株进行致病性的研究,分别人工感染了BALB/c小鼠和豚鼠,发现病毒主要在肺进行复制,且病毒在豚鼠体内存在的时间更长、病毒载量也更高,豚鼠对BAdV-3的敏感性显著高于BALB/c小鼠。用分离得到的fiber基因缺失株对BALB/c小鼠进行致病性研究,发现病毒能造成肺出血点和脾肿大,且可以在小鼠全身各个组织器官及血液内被检测到,这与之前报道该病毒仅限于肺组织增殖有所不同,这可能与fiber基因变异导致病毒组织嗜性发生改变有关[10]。
4 BAdV-3检测技术
由于引起牛呼吸系统感染的病毒性疾病在临床症状上都比较相似,表现为呼吸困难、精神倦怠、食欲不振等,很难从临床表现上将这些病毒感染加以区分。因此,必须依靠实验室方法进行检测。目前主要从病原学检测和抗体检测来对BAdV-3感染进行诊断,这些方法的建立为BAdV-3的病原学和流行病学调查提供了重要工具。
4.1 病原检测
病原学的方法主要包括病毒分离、PCR方法、基于酶联免疫吸附试验的双抗体夹心法等。病毒分离是最经典也最直观的实验室检测和鉴定病毒的方法,目前已有报道BAdV-3能够从健康牛结膜中、病牛的呼吸道分泌物、眼分泌物、粪便中分离得到[43,51,53]。但该方法由于采样的时间不确定,样本中病毒的滴度可能很低且不稳定,所以使得该方法灵敏度不高。
PCR技术相对于其他方法,具有敏感性高和特异性强的特点,能够快速区分BAdV-3和其他病原。目前已有针对该病毒的普通PCR、Real-time PCR、套式PCR等多种分子生物学检测方法。朱远茂等[51]针对E2A区域的DNA结合蛋白基因序列设计了一对特异性引物用于普通PCR对病毒的检测,该方法虽然检测成本低,但是耗时较长且检测灵敏度较低。史鸿飞[61]针对E3区域建立了基于TaqMan MGB探针的Real-time荧光定量PCR,随后Ng等[8]通过宏基因测序获得BAdV-3 hexon的基因序列,并用一种含ZEN双淬灭基团的探针法Real-time PCR对样本进行BAdV-3复核。探针法方便快速、灵敏度高,但是合成探针的成本较高,不宜推广。Shen等[10]在此基础上建立了以hexon作为靶点的TB Green染料的Real-time PCR方法,该方法特异性虽不及探针法,但检测成本低,灵敏度高,适用性更强。由于牛腺病毒存在不同的血清型且往往与其他牛呼吸道病毒混合感染,Motes等[62]针对不同血清型的牛腺病毒的hexon基因建立了套式PCR方法用于牛腺病毒的分型,Kishimoto等[63]开发了一套牛呼吸道疾病相关病原的Real-time PCR检测系统,可同时检测BAdV-3等16种牛呼吸道病原。
酶联免疫吸附试验(ELISA)是利用抗原抗体特异性结合进行抗原抗体检测的方法,是免疫学经典方法之一。Isakova等[64]用BAdV-3 Hexon单克隆抗体和几种不同的哺乳动物腺病毒Hexon多克隆抗体建立了双抗体夹心法,能够检测不同血清型腺病毒,检测范围在10-9和10-8g·mL-1。严昊[52]利用重组Hexon蛋白制备抗体,建立了双抗体夹心法用于检测 BAdV-3病原, 该方法的灵敏度为101.8TCID50·mL-1,与PCR检测结果符合率为95%,用该方法对黑龙江省哈尔滨市附近牛群进行抽检,随机采取102份鼻拭子样本,共检出21份阳性样品,阳性率为20.6%。
4.2 抗体检测
针对BAdV-3抗体检测方法主要是基于酶联免疫吸附试验的间接ELISA法,Pardon、Krzysiak、Roshtkhari、Yeilba等分别通过建立间接ELISA方法对比利时、波兰、伊朗、土耳其暴发呼吸道疾病的部分牛场展开血清学调查,BAdV-3抗体阳性率分别为46.7%、60.2%、61.9%、92.3%[47-50]。杨萌[53]通过制备的全病毒作为包被抗原,建立了检测牛腺病毒的间接 ELISA 方法,并用该方法对咸阳市部分奶牛场进行血清学调查,平均阳性率为46.65%。该方法灵敏度高,特异性好,但操作相对PCR方法较繁琐,且交互反应发生的概率较高。
5 展 望
BAdV-3作为引发BRDC的一个重要病毒性病原,在我国牛群中已经普遍存在,但目前国内有关BAdV-3的基础研究和应用研究还很薄弱,今后的研究重点可以集中在以下几个方面:1)应加强对BAdV-3的分子流行病学调查,进一步对病毒进行分离鉴定、分子特征分析;2)在致病机制上,有报道证实人腺病毒感染呼吸道上皮细胞以及禽腺病毒感染肝细胞后能够诱导宿主细胞发生凋亡和自噬[65-66]。但目前直接有关BAdV-3致病机制的报道还太少,需要进一步开展研究。3)随着BAdV-3新的基因缺失和替换株的出现,可能会导致其组织嗜性的改变以及影响中和抗体的产生,这些均可导致病毒致病性发生改变。下一步应对基因变异与致病性之间的联系展开研究。4)最近有报道显示腺病毒感染能够抑制宿主的先天免疫反应[67-68]。结合我们的研究结果,BAdV-3感染引起BALB/c小鼠脾肿大,这说明BAdV-3感染能对宿主的免疫应答造成影响。而临床上BAdV-3多呈混合感染,是否其对宿主免疫功能的抑制促进了其他病原菌的继发感染值得进一步研究。5)在应用研究上,由于腺病毒具有易感染性,宿主范围广,毒性低,可以承接大片段基因等特点,常被用来研究开发疫苗载体,这是BAdV-3一个潜在的应用方向[69]。而目前针对BAdV-3自身的疫苗还很少,国内尚无合适的疫苗用于预防和控制本病。因此研发新的疫苗和相应诊断制剂具有重大的意义。
