测定海产品中5种砷形态国家标准方法的改进
2022-04-24翁城武高功敏朱鸿达黄伙水徐敦明
翁城武,高功敏,朱鸿达,黄伙水,徐敦明
(1.泉州海关综合技术服务中心,泉州 362300;2.厦门海关技术中心,厦门 361000)
砷与人类的生活息息相关,是环境中一种重要的非金属元素,在空气、土壤、沉积物和水中,主要以三氧化二砷或亚砷酸[As(Ⅲ)]、砷酸盐[As(Ⅴ)]、一甲基砷酸(MMA)和二甲基砷酸(DMA)等形式存在,在海产品中则主要以砷甜菜碱(AsB)和砷胆碱(AsC)形式存在[1-8]。不同形态砷化物的毒性不同,毒性顺序从大到小依次为As(Ⅲ)、As(Ⅴ)、As2O3、MMA、DMA、AsC、AsB,很显然,无机砷的毒性较大,有机砷的毒性较小,其中AsC 和AsB常被认为是无毒的[2]。不同形态的砷在人体内的转变决定了其致毒和去毒的机理[9],因此无论是对食品、环境样品,还是对人体体液进行砷的形态分析都是有必要的。
目前食品中砷形态的检测主要采用国家标准GB 5009.11-2014《食品安全国家标准 食品中总砷及无机砷的测定》。该方法前处理需放置过夜,再热提取2.5 h,后经离心、萃取及过滤,步骤较多,耗时较长;第二法高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)中流动相需配制4种不同含量的无机盐,还须调节流动相酸度,较为复杂。针对上述问题,本工作改进了国家标准前处理方法,调整优化了国家标准中第二法的色谱条件,提出了基于微波辅助酶提取-HPLC-ICP-MS 快速测定食品中砷形态含量的方法。
1 试验部分
1.1 仪器与试剂
Agilent 1260型高效液相色谱仪-Agilent 7800型电感耦合等离子体质谱仪;Milli-Q 型超纯水系统;MARS 型微波提取仪;KQ-700VDV 型双频超声波清洗器;WFO-700 型电热恒温鼓风干燥箱;SIGMA3-18K 型台式冷冻离心机。
AsB标准溶液:38.8μg·g-1,GBW 08670。
As(Ⅲ)标准溶液:75.7μg·g-1,GBW 08666。
As(Ⅴ)标准溶液:17.5μg·g-1,GBW 08667。
MMA 标准溶液:25.1μg·g-1,GBW 08668。
DMA 标准溶液:52.9μg·g-1,GBW 08669。
标准储备溶液:分别将AsB、As(Ⅲ)、DMA、MMA 标准溶液用水稀释100倍至4支容量瓶中,将As(Ⅴ)标准溶液用水稀释50 倍至1 支容量瓶中,配制成As(Ⅲ)、DMA、MMA、AsB、As(Ⅴ)质量浓度分别为757,529,251,388,350μg·L-1的标准储备溶液。
链霉蛋白酶E 酶;三聚氰胺、磷酸二氢铵均为分析纯;无水乙醇为色谱纯;试验用水为超纯水。
1.2 仪器工作条件
1)微波提取条件 功率300 W;升温程序:0~10 min,由室温升至35 ℃,保持45 min。
2)色谱条件 Hamilton PRP-X100 色谱柱(250 mm×4.1 mm,10μm);流动相为体积比99∶1的2.0 mmol·L-1的磷酸二氢铵溶液(pH 8.0)-乙醇的混合液;等度洗脱;流量1.0 mL·min-1;进样量5μL;分析时间10 min。
3)ICP-MS条件 入射功率1 550 W;采样深度8.0 mm;载气流量1.35 L·min-1;雾化室温度2 ℃;砷检测质量数75;采集模式为时间分辨分析(TRA)模式;采集时间25 min;积分时间75As 0.7 s,峰面积定量。
1.3 试验方法
1.3.1 国家标准方法
采用GB 5009.11-2014中的前处理方法及第二法的仪器工作条件对海带样品进行5 种砷形态测定。
1.3.2 微波辅助酶提取-HPLC-ICP-MS
准确称取样品1.0 g(精确到0.001 g)于50 mL离心管中,分别加入0.004 g 链霉蛋白酶E 酶和20 mL水,置于微波提取仪中,按优化好的微波提取条件进行提取,提取液以转速8 000 r·min-1离心10 min,再经0.45μm 水性滤膜过滤即得样品溶液,以同样的方法制备空白样品溶液。按1.2 节HPLC-ICP-MS条件测定。
2 结果与讨论
2.1 色谱行为
按照色谱条件对5 种砷形态质量浓度均为1.0μg·L-1的样品溶液进行分离,分离效果见图1。
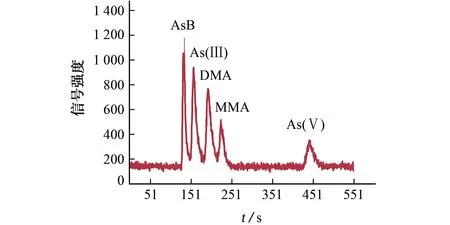
图1 5种砷形态分离色谱图Fig.1 Separation chromatogram of 5 arsenic species
2.2 提取条件的优化
试验以提取率(提取率=本方法测定值/国家标准方法测定值×100%)为指标,考察了微波提取温度、微波提取时间和酶加入量对提取率的影响。
2.2.1 微波提取温度
固定加入链霉蛋白酶E酶0.005 g和水20 mL,微波提取时间为45 min,考察了微波提取温度分别为25,35,45,55,65℃时各砷形态的提取率,结果如图2所示。
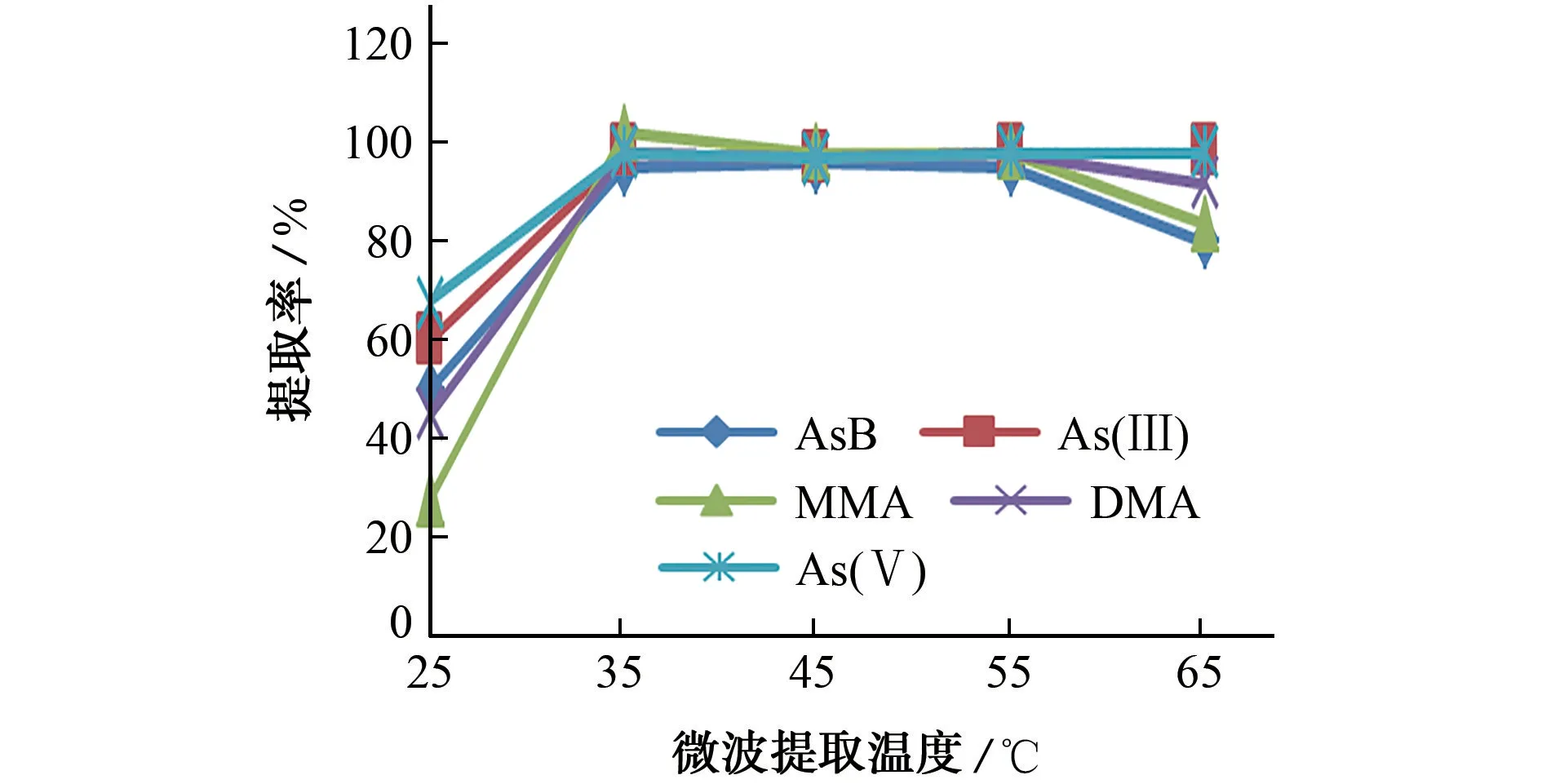
图2 微波提取温度对提取率的影响Fig.2 Effect of microwave extraction temperature on extraction rate
由图2 可知:当微波提取温度升至35 ℃时,5种砷形态的提取率达到最高值;继续升温至55 ℃,提取率基本稳定;但再继续升温,5种砷形态的提取率显著下降,这可能是链霉蛋白酶E 酶活性在高温下受抑制而失活,导致提取率降低。
2.2.2 微波提取时间
固定加入链霉蛋白酶E酶0.005 g和水20 mL,微波提取温度为35℃,考察了微波提取时间分别为20,30,40,45,50,60 min时各砷形态的提取率,结果如图3所示。
由图3可知,当微波提取45 min时,5种砷形态均基本提取完毕,因此确定最佳微波提取维持时间为45 min。
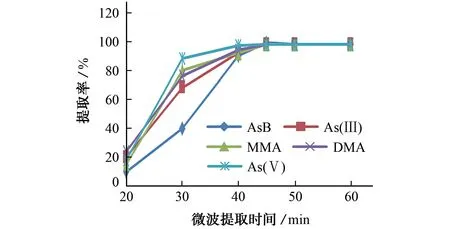
图3 微波提取时间对提取率的影响Fig.3 Effect of microwave extraction time on extraction rate
2.2.3 酶加入量
固定微波提取温度35 ℃,微波提取时间45 min,考察了酶加入量与样品质量比分别为0.1%,0.2%,0.4%,0.6%,0.8%,1.0%(即1.0 g海带样品和20 mL 水中加入酶分别为0.001,0.002,0.004,0.006,0.008,0.01 g)时各砷形态的提取率,结果如图4所示。
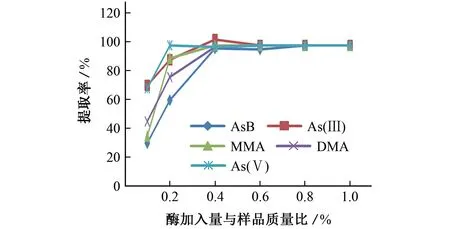
图4 酶加入量对提取率的影响Fig.4 Effect of enzyme addition on extraction rate
由图4可知:当酶加入量与样品质量比为0.2%时,仅As(Ⅴ)的提取率达到最高值;当酶加入量与样品质量比为0.4%时,AsB、As(Ⅲ)、DMA、MMA的提取率均达到最高值;再增加酶加入量,各砷形态的提取率变化不大。考虑经济因素,试验选择酶加入量与样品质量比为0.4%。
2.3 标准曲线、检出限和测定下限
分别移取适量的5种砷形态标准储备溶液,用水逐级稀释,配制成质量浓度分别为0,2.5,5.0,10.0,20.0,30.0μg·L-1的5种砷形态混合标准溶液系列,按照仪器工作条件进行测定。以5种砷形态的质量浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线。5种砷形态标准曲线的线性范围均为2.5~30.0μg·L-1,线性回归方程、相关系数见表1。
对空白样品连续平行测定11次,按3s/k(其中s为空白样品测定值的标准偏差,k为标准曲线的斜率)计算检出限,并以3倍的检出限计算测定下限,结果见表1。
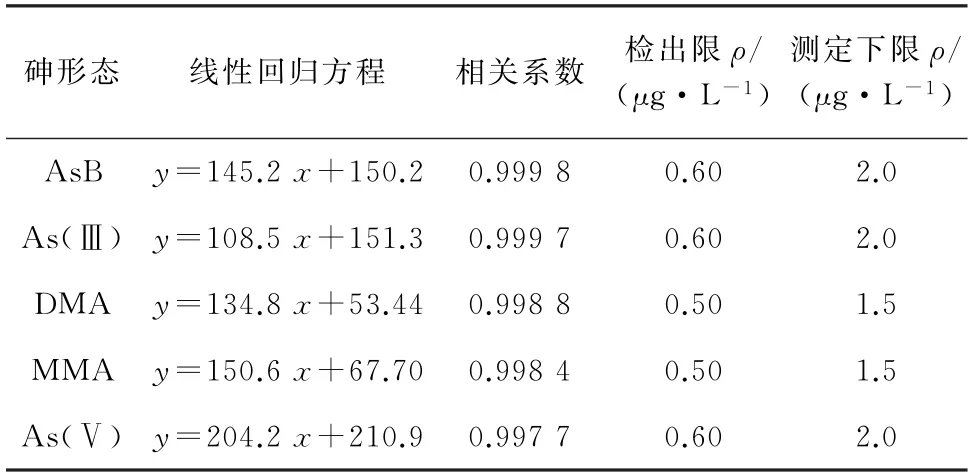
表1 线性参数、检出限和测定下限Tab.1 Linearity parameters,detection limits and lower limits of determination
2.4 精密度和回收试验
按照试验方法对海带样品进行2个浓度水平的加标回收试验,每个浓度水平平行测定5次,计算各砷形态的回收率和测定值的相对标准偏差(RSD),结果见表2。
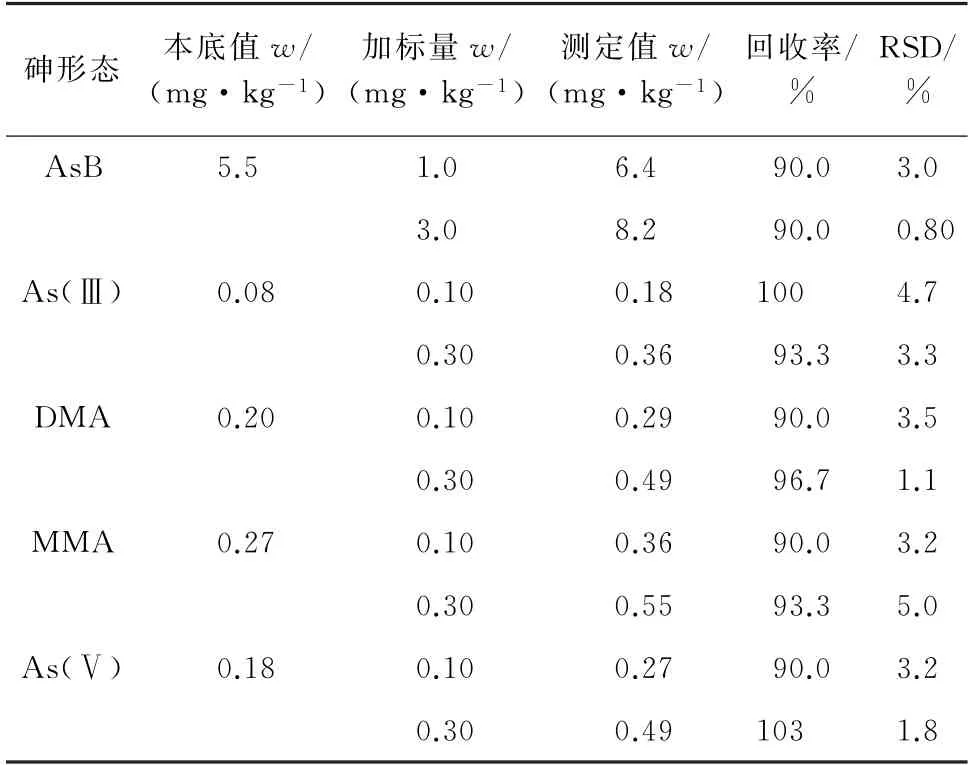
表2 精密度和回收试验结果(n=5)Tab.2 Results of tests for precision and recovery(n=5)
由表2可知,回收率为90.0%~103%,RSD 为0.80%~5.0%,说明该方法的精密度和准确度较高。
2.5 样品分析及方法比对
采用国家标准GB 5009.11-2014中的第二法和本方法对5个海带样品、4个鱿鱼干样品及2个蚝汁样品进行测定,结果见表3。
由表3可知,两种方法所得测定结果基本一致。由统计学处理分析结果可知,两种方法的检测结果无显著差异(P>0.05)。
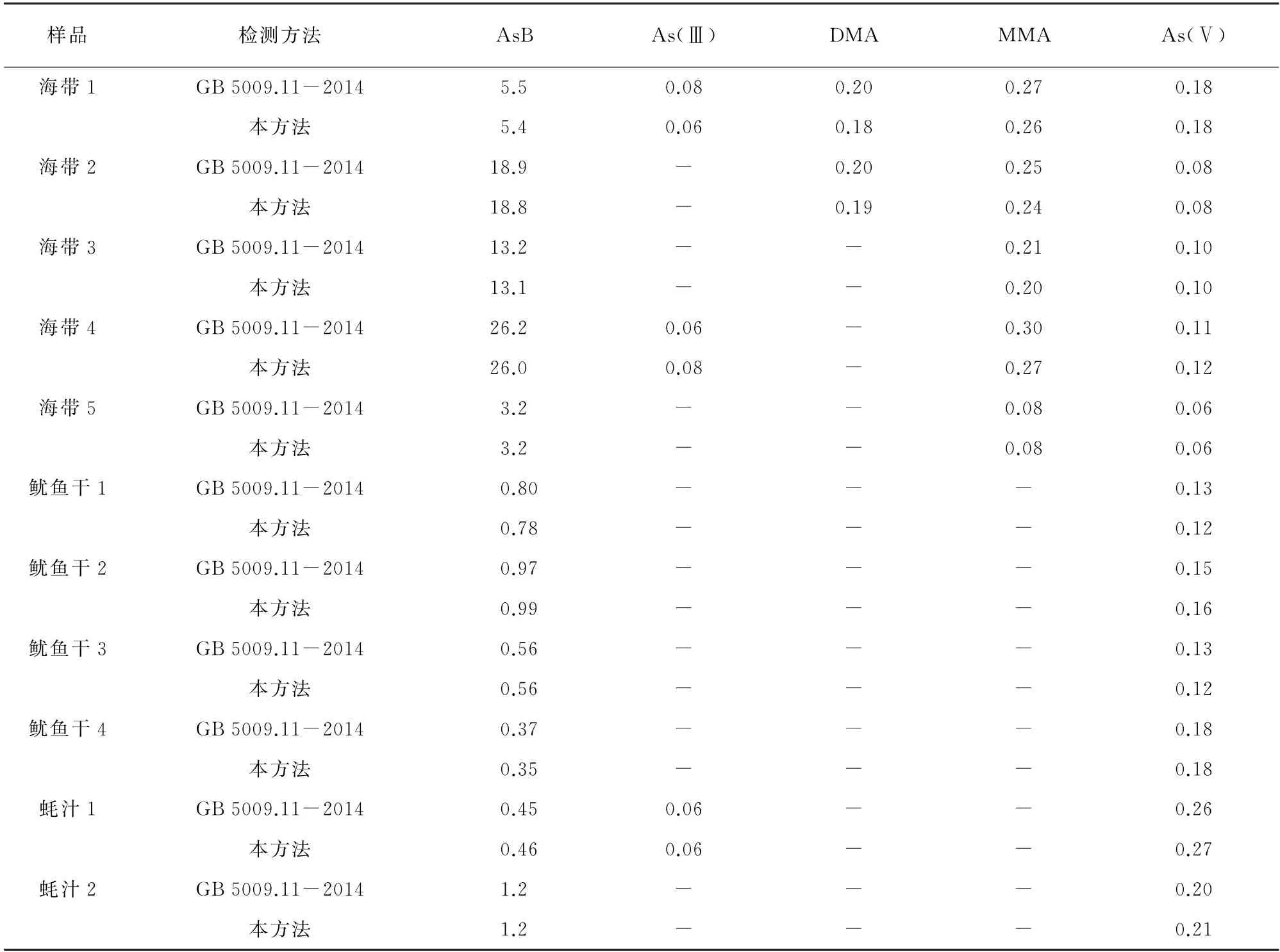
表3 样品分析结果Tab.3 Analytical results of samples mg·kg-1
本工作改进了国家标准前处理方法,调整优化了国家标准第二法的色谱条件,采用基于微波辅助酶提取-HPLC-ICP-MS 快速检测食品中砷形态的含量。该方法具有前处理简单、分离效果好、检出限低、精密度高、准确度好等优点,可作为海带、紫菜等海产品中砷形态分析的检测方法。
