慢性不可预知温和应激通过抑制JAK2-PI3K通路影响乳腺癌小鼠胸腺功能的实验研究
2022-04-24郭文琴许勰刘曦高建莉
郭文琴 许勰 刘曦 高建莉
1.浙江中医药大学药学院 杭州 310053 2.浙江中医药大学基础医学院
乳腺癌是中青年女性高发疾病之一,其发病率呈逐年上升趋势,虽然其病因尚未完全阐明,但既往研究表明,抑郁障碍等不良负性情绪与乳腺癌的发生、发展及预后密切相关[1-4]。2017年美国整合肿瘤学会(Society for Integrative Oncology,SIO)临床实践指南指出,乳腺癌患者伴发抑郁的比例为3%~34%,伴发焦虑的比例12%~47%,11%~16%的患者同时伴有焦虑和抑郁症状[5]。研究发现,抑郁症会进一步促使肿瘤恶化,极大降低患者治疗的依从性,并影响治疗效果[6]。然而,情志失调是如何促进乳腺癌的发生发展的,目前尚缺乏可靠的科学依据。
胸腺作为机体的中枢免疫器官,在维持机体正常的免疫功能中发挥重要作用。同时,人体免疫系统与中枢神经系统具有密切联系,情绪障碍和应激事件可以影响免疫功能,而免疫功能的改变也可能成为抑郁障碍的病因[7-12]。有研究表明,抑郁障碍患者体内调节性T细胞数量明显下降[13]。但情志失调对乳腺癌机体胸腺的发育及其功能的影响以及具体机制如何,尚无系统研究。
前期研究发现,胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP),作为一种白细胞介素-7(interleukin-7,IL-7)样细胞因子,在乳腺癌机体中表达增加,通过激活其下游的TSLP因子相关通路,促进肿瘤细胞的存活[14-15]。此外,抑郁症患者体内IL-7水平降低,与抑郁程度呈负相关[16]。以上结果提示,TSLP及IL-7的表达以及下游通路的激活情况,可能是研究情志失调状态下的乳腺癌机体免疫功能的关键。
为此,本研究采用慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)刺激乳腺癌小鼠,对其胸腺形态、病理变化、功能变化及相关因子和蛋白的表达进行系统的研究,以期探明情志内伤时乳腺癌小鼠胸腺功能的变化及其对乳腺癌发展的影响。
1 材料和方法
1.1 实验动物及细胞株 小鼠乳腺癌细胞株4T1由美国芝加哥大学何通川教授惠赠。5周龄无特殊病原体(specific pathogen free,SPF)级雌性BALB/c小鼠,共30只,购于上海斯莱克实验动物有限责任公司[实验动物生产许可证号:SCXK(沪)2017-0005],饲养于浙江中医药大学实验动物中心全封闭SPF环境中[实验动物使用许可证号:SYXK(浙)2021-0012],室温25℃,相对湿度40%~60%,每日光照12 h,自由摄食和饮水。本研究经过浙江中医药大学动物伦理审查(批准编号:IACUC-20210517-07)。
1.2 主要试剂 达尔伯克改良伊格尔高糖培养基(Dulbecco's modified eagle medium,DMEM) 购于美国Gibco公司(批号:8121525);胎牛血清(fetal bovine serum,FBS) 购于天杭生物公司 (批号:19110503);DNA提取酚试剂购于北京索莱宝科技有限公司(批号:1026Y011);哺乳动物基因组DNA提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)凝胶制备试剂盒、含4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色液的防荧光淬灭剂均购于碧云天生物技术研究所(批号:081020210105、082720201230、121720201228、041 221211026);血清素/5-羟色胺(5-hydroxytryptamine,5-HT)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购于生工(上海)生物工程股份有限公司(批号:H129AD0273);Rabbit anti-mouse CD3、Rabbit anti-mouse CD4、Rabbit anti-mouse CD8a抗体均购于BD Pharmingen公司(批号:1025233、0231898、3276860);Rat anti-Mouse CK5抗体购于Affinity Biosciences公司(批号:57u2005);Rabbit anti-Mouse CK8、TSLP,Goat anti-Rabbit IgG抗体均购于Abcam公司(批号:GR3181962-4、GR3728 1-1、GR3299244-3); 异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)标记的Mouse anti-Rabbit IgG、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化信号转导和转录激活因子3(phospho-signal transducer and activator of transcription 3,p-STAT3) 抗体均购于Santa Cruz公司(批号:K2017、D3015、A0521、A0723);Janus激酶2(Janus kinase 2,JAK2) 抗体、 磷酸化Janus激酶2(phospho-Janus kinase 2,p-JAK2)抗体、磷脂酰肌醇-3-激酶p110α (phosphatidylinositol-3-kinase p110α,PI3K p110α)抗体、磷酸化磷脂酰肌醇-3-激酶p85/p55(phospho-phosphatidylinositol-3-kinase p85/p55,p-PI3K p85/p55)抗体均购于Cell Signaling Technology公司(批号:13、3、9、6);F(ab’) 2-Goat Anti-Mouse IgG(H+L)Alexa Fluor 594购于达文生物有限公司(批号:GAR48810900223)。
1.3 实验方法
1.3.1 细胞培养 4T1细胞采用含10%FBS的DMEM完全培养基,置于5% CO2、37℃培养箱中培养,每2~3 d传代。
1.3.2 CUMS乳腺癌小鼠模型建立 选取健康BALB/c小鼠30只,随机分为正常组、模型组、CUMS-1组、CUMS-2组及CUMS-3组,每组6只。除模型组及正常组外, 每只小鼠每日施以CUMS:(1)夹尾3 min;(2)160 次/min水平摇晃5 min;(3)圆筒束缚3 h:将小鼠放入固定器中,限制小鼠活动,使其不能前进、后退及转身,每天夜间进行束缚;(4)倾斜鼠笼1 h。每次采用1种刺激,每日分别刺激1(CUMS-1组)、3(CUMS-2组)、5(CUMS-3组)次,随机安排,使小鼠不能预知下次的刺激,以避免产生适应,共刺激30 d。CUMS刺激5 d后,除正常组外,每只小鼠均于右侧第二对乳腺脂肪垫下接种1×107/mL 4T1细胞悬液100 μL,制备小鼠4T1乳腺癌荷瘤抑郁模型。造模48 h后,观察到接种部位有点状凸起,即为造模成功。
1.3.3 模型小鼠行为指标检测
1.3.3.1 一般状况观察 于模型建立前、模型建立后10、20及30 d分别观察各组小鼠外观体征、行为活动。
1.3.3.2 旷场实验(open field test,OFT) 模型建立后,用OFT法进行测试。自制方形敞箱,箱底面积为50 cm×50 cm,等分为25格,箱高50 cm。记录小鼠在中央区域(中间9格)及边缘区域(中央区域外周的16格)的停留时间。从小鼠4爪均进入方格开始计算,每次测定小鼠3 min内的运动情况。
1.3.3.3 强迫游泳实验(forced swimming test,FST)正式实验前1 d先行预实验训练游泳,将小鼠置于高约30 cm,直径20 cm的透明玻璃圆桶中,水深15 cm,水温(25±5)℃,确保小鼠不能跳出水槽或触及底部。正式实验时以摄像机记录小鼠6 min内的游泳过程,并对最后4 min内的不动(漂浮以及上身不动,下肢踩水算作不动)时间进行统计。
1.3.4 小鼠体质量和肿瘤体积的测量 每5 d称量小鼠体质量1次,观察并记录给药后小鼠体质量变化。用游标卡尺测量瘤体长径(length,L)和短径(width,W),单位均为mm,根据公式计算肿瘤体积(volume,V)(mm3):V=(L+W)×L×W×0.2618。
1.3.5 小鼠肿瘤质量及各脏器指数的检测 眼球取血后脱颈椎处死小鼠,剖取瘤体、胸腺、肺脏、肝脏,称量质量后拍照,计算脏器指数和肺转移率。按下列公式计算:脏器指数(%)=脏器质量(g)/体质量(g)×100%。
1.3.6 ELISA检测5-HT水平 小鼠眼球取血后断头处死,取小鼠大脑组织0.2 g,置于0.9%氯化钠溶液中冰浴匀浆,离心取上清液,依照试剂盒说明书检测5-HT水平。
1.3.7 实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction, Real-time qPCR)检测外周血单个核细胞基因组DNA中T细胞受体重排删除环(T cell receptor rearrangement excision circles,TRECs)的表达 小鼠取新鲜抗凝血,裂解红细胞后离心收集细胞沉淀。按哺乳动物基因组DNA提取试剂盒说明书提取小鼠外周血单个核细胞DNA。反应体系共20 μL,包括 2×SG Fast qPCR 10 μL,10 μmol·L-1的上下游引物各0.4μL,PCR-grade water 8.2 μL,Template cDNA 1 μL。 混匀后离心5 s,使用荧光定量PCR仪进行PCR反应。反应条件为:94℃,4 min;94 ℃,30 s;57 ℃,30 s;72 ℃,31 s,共40个循环。引物均由生工(上海)生物工程股份有限公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
1.3.8 Real-time qPCR检测胸腺中TSLP、STAT3、IL-1α、IL-5、IL-6、IL-7、IL-10、IL-12、IL-17、 叉头样转录因子p3(forkhead transcription factor p3,Foxp3)、 转化生长因子β1(transforming growth factor-β1,TGF-β1)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA表达 以组织RNA快速提取试剂盒提取胸腺RNA,按照cDNA逆转录试剂盒说明书,将RNA逆转录为cDNA。 反应体系共20 μL, 包括2×SG Fast qPCR 10 μL,10 μmol·L-1的上下游引 物各0.4 μL,PCR-grade water 8.2 μL,Template cDNA 1 μL。 混匀后离心5 s,使用荧光定量PCR仪进行PCR反应。反应条件为:94 ℃,4 min;94 ℃,30 s;57 ℃,30 s;72 ℃,31 s,共40个循环。引物均由生工(上海)生物工程股份有限公司合成,序列见表1。
1.3.9 免疫荧光法检测胸腺上皮细胞(thymus epithelial cells,TECs)分布 胸腺组织以4%中性甲醛固定48 h后,脱水,透明,浸蜡,包埋,行5 μm切片。 切片脱腊水化后,进行微波修复,0.3% H2O2室温孵育15 min,加入一抗后4℃孵育过夜;洗涤后加入荧光标记的二抗,室温避光孵育2 h;用含DAPI染色液的防荧光淬灭剂封片,以VS120-S6-W数字病理切片(荧光)扫描分析仪观察。
1.3.10 流式细胞术分析胸腺T细胞亚群 完整分离小鼠胸腺,用注射器的无菌活塞研磨胸腺组织,取胸腺细胞制成单细胞悬液,1 500 r·min-1低速离心5 min,去掉上清液,重悬细胞并洗涤1次,4℃下以1%牛血清蛋白(bovine albumin, BSA)封闭20 min。 加入CD3、CD4、CD8抗体, 冰上避光孵育30 min。 以BD C6流式细胞仪采集数据,并使用FCS Express V3进行分析,Image J软件分析荧光强度。
1.3.11 免疫印迹法检测TSLP、JAK2、p-JAK2、STAT3、p-STAT3、PI3K、p-PI3K蛋白表达 将小鼠胸腺完整取出,匀浆提取总蛋白,以蛋白浓度测定试剂盒测定总蛋白浓度(实验方法参照试剂盒说明书)。通过电泳分离,将蛋白转移至活化的聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,随后封闭,加入一抗4℃孵育过夜;洗膜3次后加入二抗,室温避光孵60 min。 化学发光(efficient chemiluminescence,ECL)试剂盒显色,利用Image J软件定量分析蛋白灰度值,以GAPDH为内参,计算蛋白相对表达量。
1.4 统计学分析 采用SPSS 20.0软件软件进行统计学分析。计数资料以百分率表示,组间比较采用χ2检验。符合正态分布的计量资料以±s表示,组间比较采用t检验;不符合正态分布的组间比较采用非参数检验分析,组内比较用单因素方差分析。以P<0.05为差异有统计学意义。OFT及FST视频以Smart 3.0软件进行分析。
2 结果
2.1 小鼠一般状况观察 造模30 d后,正常组及模型组小鼠毛色光亮,身形健硕,活动灵敏,自主活动能力良好,自主活动多;CUMS-1组及CUMS-2组小鼠毛色较粗糙,身形略消瘦,活动略迟钝,自主活动能力变差;CUMS-3组小鼠毛色粗糙,身形极消瘦,活动迟钝,自主活动能力差。
2.2 各组小鼠OFT比较 与正常组比较,模型组、CUMS-1组及CUMS-3组小鼠的中央区域停留时间均略有减少;CUMS-2组停留时间延长,但差异无统计学意义(P>0.05)。 见图1。

图1 各组小鼠运动轨迹Fig.1 Movement trajectory of each group
2.3 各组小鼠FST比较 与正常组小鼠的不动时间(80.07±46.63)s比较,模型组不动时间增加至(132.52±49.78) s、CUMS-1组增至(163.51±18.81) s,CUMS-3组增至(141.65±16.51) s,但差异均无统计学意义(P>0.05),CUMS-2组小鼠不动时间与正常组比较,差异无统计学意义(P>0.05)。
2.4 各组小鼠体质量和肿瘤体积比较 正常组与模型组小鼠体质量随饲养天数增加而增加,两组间体质量差异无统计学意义(P>0.05)。与正常组比较,造模第1~15天内CUMS-1、CUMS-2和CUMS-3组小鼠体质量均显著降低,造模第15天时降到最低,CUMS-2组下降最为明显(P<0.01),CUMS-3组次之(P<0.001),CUMS-1组下降幅度最小(P<0.01)。造模15 d后,各组体质量逐渐升高。见图2。
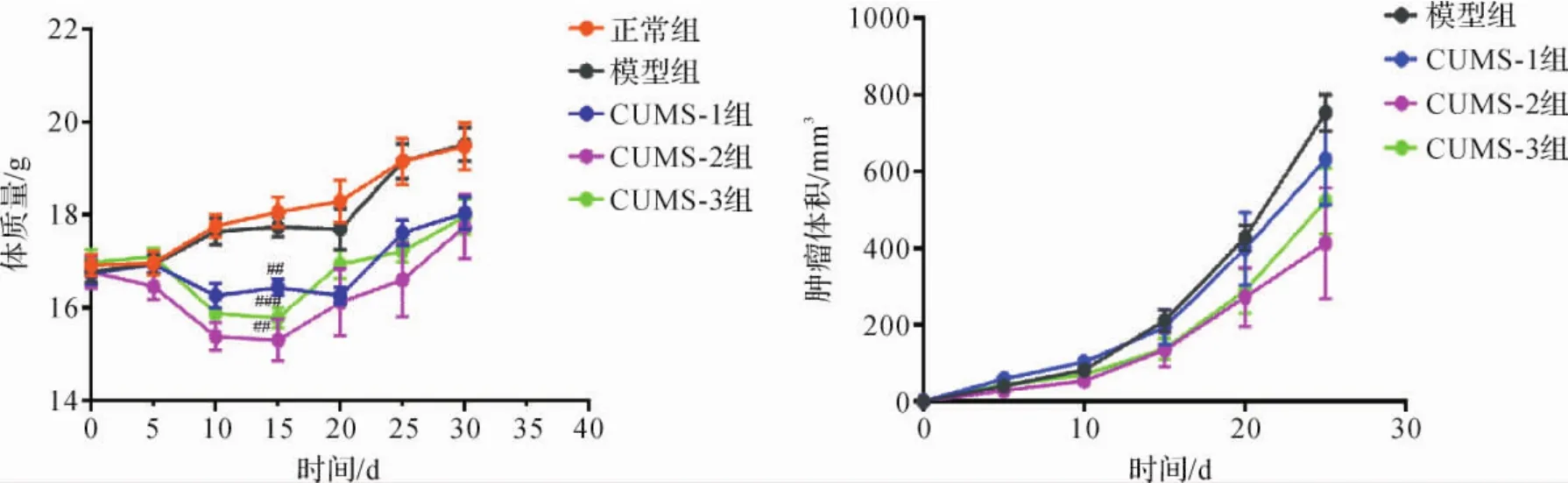
图2 各组小鼠体质量、肿瘤体积比较Fig.2 Comparison of body weight and tumor volume in each group
此外,模型组及CUMS各组小鼠肿瘤体积均随实验天数增加而增加。与模型组比较,CUMS各组肿瘤体积均降低,但差异无统计学意义(P>0.05)。CUMS-1组小鼠肿瘤体积最大,CUMS-3组次之,CUMS-2组最小,但组间差异无统计学意义(P>0.05)。见图2。
2.5 各组小鼠肿瘤质量及各脏器指数比较 与正常组比较,模型组及CUMS-1、CUMS-2和CUMS-3组小鼠脾脏指数升高(P<0.01,P<0.0001,P<0.01,P<0.0001)。各组胸腺质量及指数比较,差异无统计学意义(P>0.05)。与模型组比较,CUMS-1和CUMS-3组小鼠肿瘤质量无明显变化,肿瘤指数升高,但差异无统计学意义(P>0.05)。各荷瘤组肿瘤肺转移率均达到100%。与模型组比较,CUMS-3组小鼠乳腺癌肺转移灶总数由(12.13±3.06)个增加至(16.86±4.46)个。见表2、图3。
表2 各组小鼠脏器指数Tab.2 Mice organ index in each group (±s, n=6)
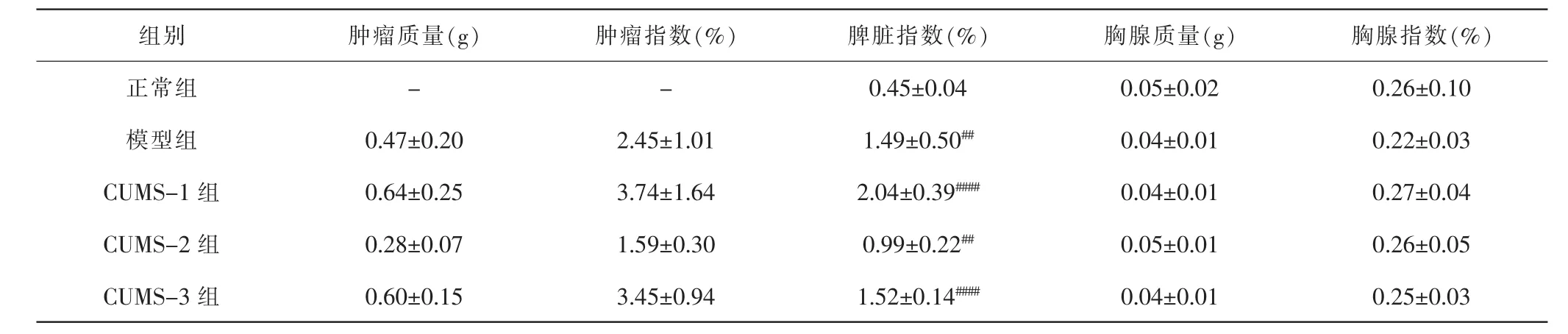
表2 各组小鼠脏器指数Tab.2 Mice organ index in each group (±s, n=6)
注:与正常组比较,##P<0.01,####P<0.0001。Note:Compared with normal group,###P<0.001,####P<0.0001.
组别 肿瘤质量(g) 肿瘤指数(%) 脾脏指数(%) 胸腺质量(g) 胸腺指数(%)正常组 - - 0.45±0.04 0.05±0.02 0.26±0.10模型组 0.47±0.20 2.45±1.01 1.49±0.50## 0.04±0.01 0.22±0.03 CUMS-1 组 0.64±0.25 3.74±1.64 2.04±0.39#### 0.04±0.01 0.27±0.04 CUMS-2 组 0.28±0.07 1.59±0.30 0.99±0.22## 0.05±0.01 0.26±0.05 CUMS-3 组 0.60±0.15 3.45±0.94 1.52±0.14#### 0.04±0.01 0.25±0.03
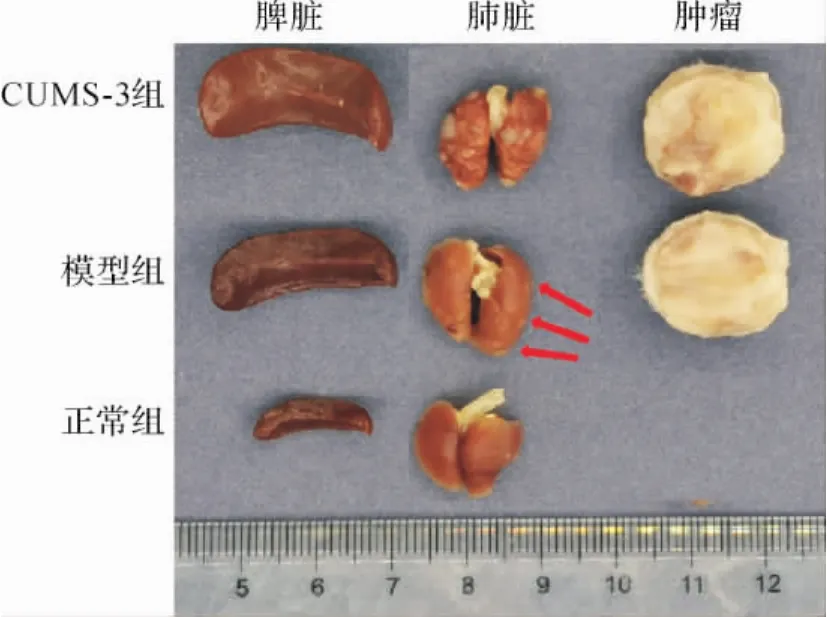
图3 各组小鼠代表性脏器Fig.3 The representative organs in each group
2.6 各组小鼠大脑组织5-HT水平比较 与正常组比较,模型组小鼠大脑组织5-HT水平无明显变化,差异无统计学意义(P>0.05);与模型组比较,CUMS-1组及CUMS-2组小鼠5-HT水平无明显变化,差异均无统计学意义(P>0.05),CUMS-3组小鼠5-HT水平显著降低(P<0.01),提示每日5次刺激使荷瘤小鼠5-HT水平紊乱。见图4。
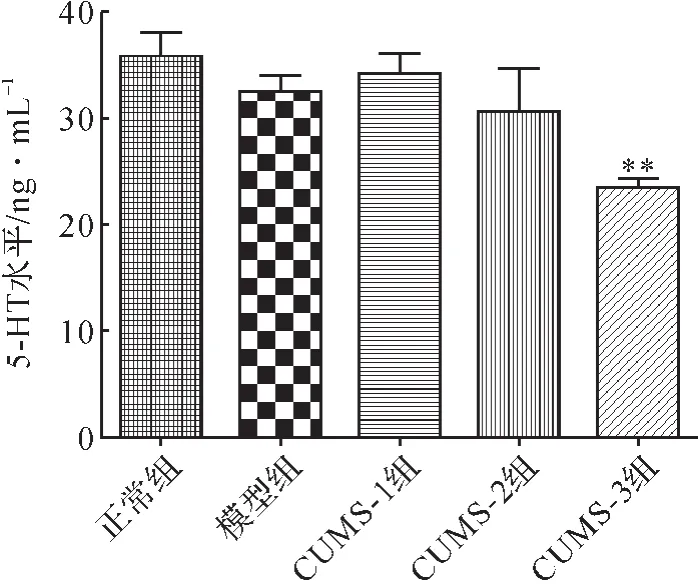
图4 各组小鼠大脑组织5-HT水平比较Fig.4 Comparison of 5-HT levels in brain tissue in each group
2.7 各组小鼠外周血单个核细胞基因组DNA中TRECs表达比较 与正常组比较,模型组外周血中TRECs表达显著升高(P<0.01); 与模型组比较,CUMS-3组小鼠外周血中TRECs表达明显降低(P<0.01),提示接受刺激的荷瘤小鼠近期胸腺输出功能显著降低。见图5。
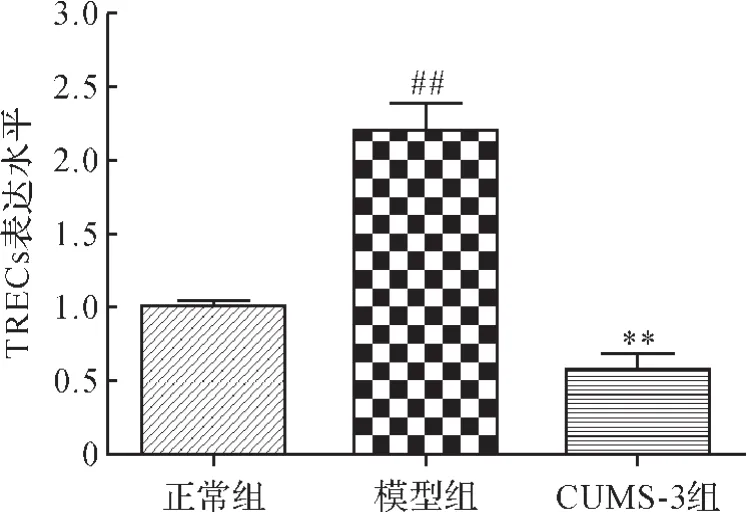
图5 各组小鼠外周血单个核细胞基因组DNA中TRECs表达比较Fig.5 Comparison of TRECs expression in genomic DNA of peripheral blood mononuclear cells in each group
2.8 各组小鼠胸腺TSLP、Foxp3、IL-7、IL-1α、IL-12、IL-17、STAT3、TGF-β1和TNF-α等mRNA水平比较与正常组比较,模型组小鼠胸腺中IL-7 mRNA水平显著降低(P<0.001), 而TSLP、Foxp3、IL-1α、IL-12、IL-5、IL-6、IL-10、STAT3、TGF-β1和TNF-α均显著升高(P<0.05,P<0.01,P<0.001,P<0.0001)。 与模型组比较,CUMS-3组小鼠胸腺中TSLP及IL-7 mRNA水平均显著升高 (P<0.001), 而Foxp3、IL-1α、IL-12、IL-6、IL-5、IL-10、IL-17、STAT3、TGF-β1和TNF-α水平均显著降低(P<0.01,P<0.001,P<0.0001)。 见图6。

图6 各组小鼠胸腺中 TSLP、Foxp3、IL-1α、IL-5、IL-6、IL-7、IL-10、IL-12、IL-17、STAT3、TGF-β1和 TNF-α mRNA表达比较Fig.6 Comparison of TSLP, Foxp3, IL-1α, IL-5, IL-6, IL-7, IL-10, IL-12, IL-17, STAT3, TGF-β1and TNF-α mRNA expression in thymus in each group
2.9 各组小鼠胸腺中TECs分布比较 免疫荧光结果显示,与正常组比较,模型组小鼠胸腺中髓质部分TECs(橙色阳性细胞)的数量减少,CK5及CK8表达量降低(P<0.001,P<0.01);与模型组比较,CUMS-3组小鼠胸腺中髓质部分TECs(橙色阳性细胞)的数量进一步减少,CK5及CK8表达量显著降低 (P<0.01,P<0.01),提示髓质中TECs的萎缩。 见图7。
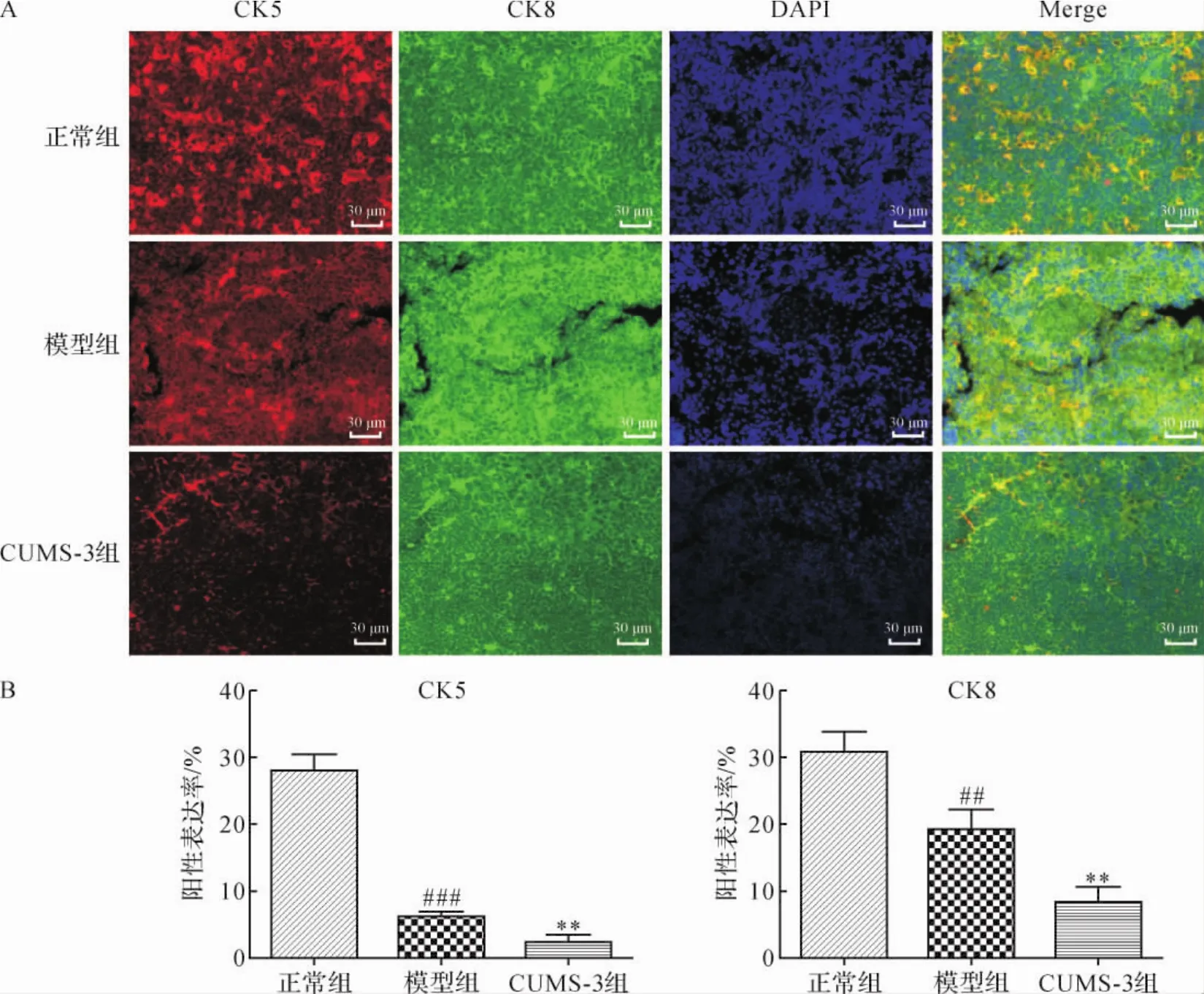
图7 小鼠胸腺组织免疫荧光结果Fig.7 Results of immunofluorescence in mice thymus
2.10 各组小鼠胸腺中T细胞亚群变化 与正常组比较,模型组及CUMS-3组小鼠胸腺中CD3+CD4+CD8-及CD3+CD4-CD8+T细胞百分比均显著升高(P<0.05),CD3+CD4-CD8-及CD3+CD4+CD8+T细胞比例均显著降低(P<0.05),CUMS组在模型组的基础上,变化趋势更加明显。提示肿瘤和慢性应激均使胸腺的阳性选择功能和成熟T细胞向外周血输出的过程受抑制。见图8。
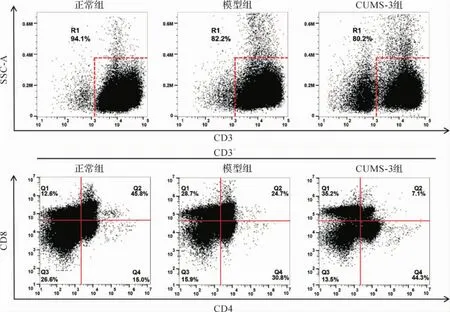
图8 小鼠胸腺中T细胞亚群比例Fig.8 T cell subset ratio in mice thymus
2.11 各组小鼠胸腺TSLP、JAK2、p-JAK2、STAT3、p-STAT3、PI3K、p-PI3K蛋白表达比较 与正常组比较,模型组小鼠胸腺中p-JAK2、p-STAT3、PI3K、p-PI3K p55、p-PI3K p85表达均升高(P<0.05);与模型组比较,CUMS-3组p-PI3K p85、TSLP表达均升高(P<0.05),p-JAK2、p-PI3K p55表达均降低(P<0.05),提示肿瘤可能激活胸腺的JAK2/STAT3通路,而CUMS抑制JAK2及p-PI3K p55的磷酸化。见图9。
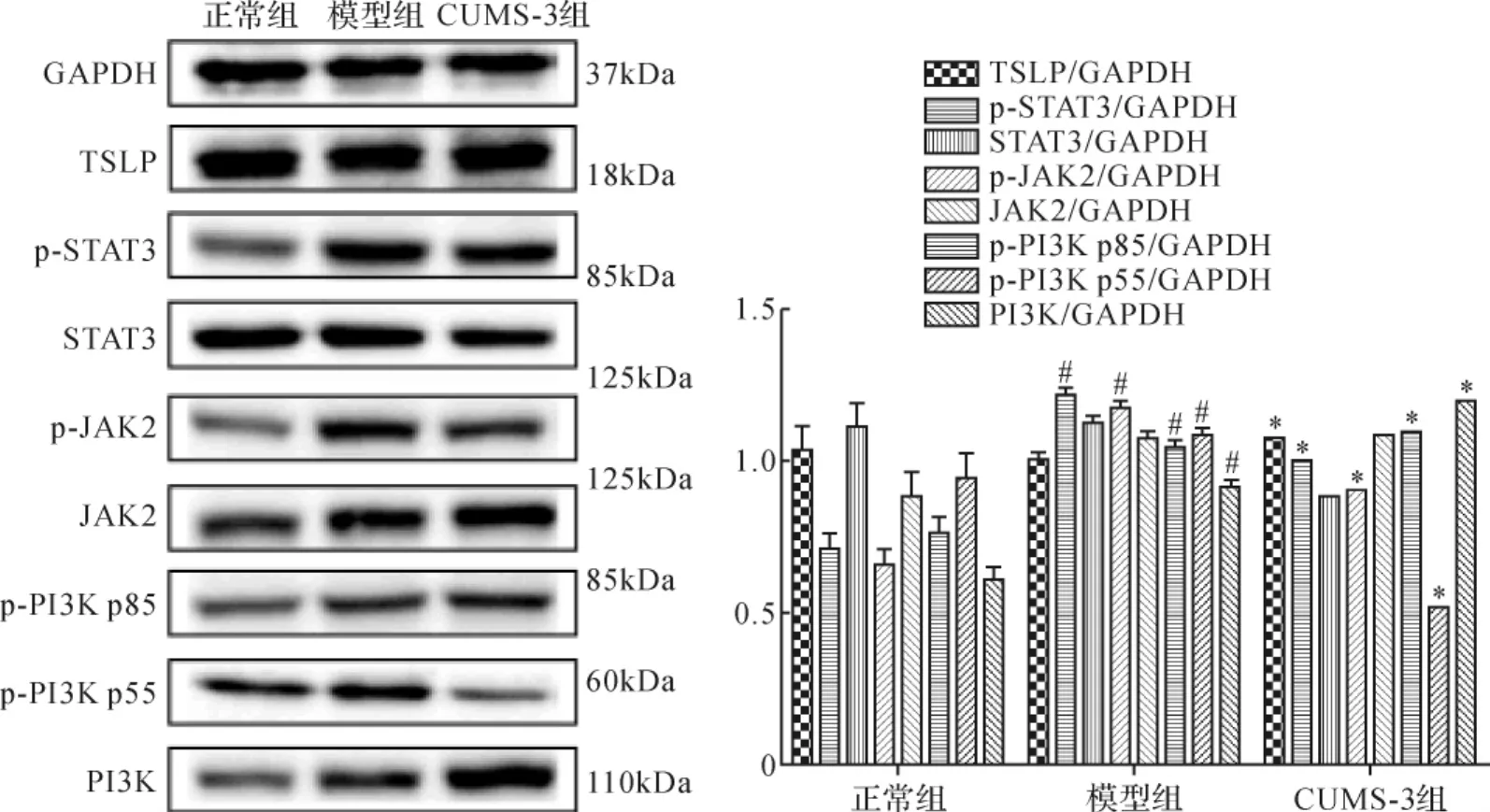
图9 各组小鼠胸腺中TSLP/STAT3通路及IL-7下游蛋白表达比较Fig.9 Comparison of expressions of TSLP/STAT3 pathway and IL-7 downstream protein in thymus in each group
3 讨论
乳腺肿瘤,中医属于“乳岩”“乳石痈”“奶岩”等范畴,是在各种致瘤因素作用下,乳腺局部组织失去正常生长形态而导致的异常增生。《丹溪心法·卷五·痈疽》云:“不得于夫,不得于舅姑,忧怒郁闷,昕夕累积,脾气消阻,肝气横逆,遂成隐核,如大棋子,不痛不痒,数十年后,方为疮陷,名曰奶岩,以其疮形嵌凹似岩穴也。不可治矣。”[17]表明乳腺癌与抑郁/焦虑等情绪失调有密切的联系,并在发生发展过程中相互影响。本研究探讨了乳腺癌和CUMS刺激下小鼠胸腺功能的变化,并试图阐明其可能的作用机制。
研究表明,5-HT作为中枢系统中重要的神经递质,参与睡眠、精神活动、情绪变化等生理反应,扰乱5-HT的释放和重吸收,将导致抑郁障碍产生[18]。本研究中,CUMS-3组小鼠大脑5-HT水平明显下降,且强迫游泳不动时间延长,说明小鼠发生情绪失调,因此后续实验主要围绕正常组、模型组及CUMS-3组开展。
TECs是胸腺中最主要的胸腺基质细胞,为胸腺细胞的发育提供最适宜的生存环境,是胸腺发挥功能的基础[19]。CK5和CK8是TECs的特异性标志物[20-22]。 本研究结果提示,小鼠胸腺中TECs的CK5及CK8表达量降低,表明CUMS干预可能使小鼠TECs表型发生改变,导致上皮组织发生萎缩。
本研究发现,CUMS刺激对荷瘤小鼠的胸腺输出功能有明显的抑制作用,小鼠外周血TRECs降低,胸腺中T细胞亚群的比例紊乱。TRECs是T细胞受体(T cell receptor,TCR)基因重排过程中的副产物,与胸腺的输出功能密切相关。通过定量分析样本中单位数量T细胞中TRECs的水平,可以检测胸腺近期输出初始T细胞的数量,从而反映胸腺的输出功能[23-24]。同时,机体免疫功能的正常状态依赖于T细胞亚群数量和比例的平衡。CD3是所有T细胞表面的标志物,而具有辅助功能的CD4+T细胞和具有杀伤功能的CD8+T细胞是T细胞中最重要的两类亚群,在胸腺细胞免疫调节中发挥着重要作用。本研究中,CUMS-3组小鼠T细胞亚群比例失调,胸腺输出功能受限,T细胞的阳性选择受阻,胸腺免疫功能出现下降,提示CUMS刺激下荷瘤小鼠胸腺输出功能降低。
本研究进一步检测了胸腺相关基因的表达,以探究CUMS影响胸腺功能的可能机制。IL-7可促进T细胞的分化、维持幼稚T细胞在胸腺中分化,并参与维持外周CD4+、CD8+T细胞等免疫细胞稳态。 TSLP作为一种IL-7样细胞因子,可调节未成熟树突状细胞(dendritic cells,DC)激活、CD4+T细胞稳态和调节性T细胞发育[25-27]。同时,IL-7与抑郁也存在一定联系,抑郁患者体内的IL-7水平降低,而且IL-7水平与抑郁程度呈负相关,可能是与抑郁相关的T细胞功能受损所致[16]。本研究中,CUMS刺激可特异性调控荷瘤小鼠胸腺内TSLP及IL-7水平。 Foxp3、IL-1α、IL-12、IL-6、IL-5、IL-10、IL-17、STAT3、TGF-β1及TNF-α同样参与机体的免疫调节。研究表明,乳腺癌机体中Foxp3、IL-1α、IL-6、IL-12、IL-17、STAT3、IL-10、TNF-α、TGF-β1等因子表达明显上调[28-32],这与本研究结果一致,而CUMS干预后前述因子变化趋势一致,未出现特异性改变,因此未进行更进一步的研究。以上结果提示,小鼠胸腺免疫功能的改变可能主要受TSLP及IL-7表达影响。免疫印迹结果显示,CUMS刺激抑制了荷瘤小鼠体内受TSLP过度激活的JAK2-PI3K通路蛋白p-JAK2及IL-7下游蛋白p-PI3K p55的表达。既往研究证明,在乳腺癌机体中TSLP表达增加,并通过诱导抗凋亡分子Bcl-2的表达来促进肿瘤细胞的存活,并介导其转移到肺部[14]。由此笔者推测,乳腺癌机体中TSLP表达增加,激活JAK2-STAT3通路,破坏了胸腺结构和输出功能,导致胸腺功能紊乱;而抑郁情绪可能通过抑制过度活化的JAK2-PI3K通路,进一步破坏荷瘤机体的胸腺结构与功能,并进一步促进肿瘤细胞的存活和肺转移,加速乳腺癌发病进程。
综上所述,CUMS刺激下的乳腺癌小鼠会出现情绪失调,小鼠胸腺结构发生以髓质上皮组织萎缩为代表的损坏,胸腺输出淋巴细胞的功能受到一定程度的抑制,其作用机制可能与抑制JAK2-PI3K通路有关。本研究结果将为乳腺癌的发生发展及其与情志的相互影响提供新的科学依据,为乳腺癌机体的胸腺免疫研究提供了新的方向。
