粗糙脉孢菌驱动蛋白-1在菌丝极性生长中的功能*
2022-04-22孙海涛陈志玲
孙海涛,陈志玲
(首都师范大学生命科学学院,北京 100048)
0 引 言
微管骨架是细胞骨架的主要成员,在细胞的多项生命活动中发挥着关键作用,如细胞生长、细胞分裂和细胞内物质运输等,这些功能的发挥依赖于微管的动态不稳定性及可调控性.研究表明有多种微管结合蛋白可以调控微管的动态,协助微管执行功能,如:MAP200促进微管聚合、katanin蛋白能够切割微管、MAP65促进微管成束和EB蛋白结合在微管正端调控微管骨架动态[1-2].而驱动蛋白(kine‐sin)家族成员较为特殊,是马达蛋白通过水解三磷酸腺苷(Adenosine triphosphate,ATP)产生的能量沿微管运动,进而在膜泡转运、有丝分裂、蛋白复合体转运和微管动态调节等方面发挥重要作用[3-4].
从20世纪80年代,Vale等[5]在乌贼(Loligo pea‐leii)神经元轴突内首次发现驱动蛋白以来,迄今在不同物种中报道的驱动蛋白多达几百种,基于驱动蛋白氨基酸序列相似性、马达结构域相似性和进化过程中的相关性,将驱动蛋白分为14个亚家族(驱动蛋白-1~14)和个体(Ungrouped orphans)驱动蛋白[3],但是许多驱动蛋白家族成员的功能并不是很清楚.驱动蛋白均含有1个高度保守的马达结构域,约由350个氨基酸残基组成,此区域具有ATP酶催化活性和微管结合位点,依据马达结构域在驱动蛋白多肽链中所处位置的不同,分为N端、C端和中间驱动蛋白.一般来说,N端驱动蛋白沿微管正向运输,C端驱动蛋白沿微管负向运输,中间驱动蛋白则从正端或负端解聚微管.驱动蛋白-1~12、驱动蛋白-13和驱动蛋白-14分别为N端驱动蛋白、中间驱动蛋白和C端驱动蛋白,现有研究表明,一些特殊的驱动蛋白并不严格遵循此规律,驱动蛋白-8和驱动蛋白-14除沿微管运输外,还具有解聚微管的特性[6-7].除马达区域以外,其他部位的氨基酸序列并不保守,具有多变性,主要是负责形成二聚体以及调节功能等.
体外生化研究表明,驱动蛋白-1家族成员多以四聚体形式存在,包含驱动蛋白重链(kinesin heavy chain,KHC)和轻链(kinesin light chain,KLC)2种亚基.KHC包含4个结构域,分别为马达结构域、二聚化结构域、颈链和尾部.其中:马达结构域位于驱动蛋白分子的N末端,由2个相同的头部组成,每个头部都含有微管结合位点,并具有ATP酶活性[8];二聚化结构域也称为茎部,由2个a-螺旋相互缠绕组成,帮助驱动蛋白形成二聚体;颈链是连接头部和二聚化结构域的一段约14个氨基酸残基组成的短肽;尾部位于驱动蛋白分子的C末端,由2个较小的球状结构组成,保守性低,C末端负责与其他亚基或“货物”结合,有些驱动蛋白通过相连的KLC来间接与“货物”结合.关于驱动蛋白头部的运动方式,目前,步进(hand-over-hand)模型被大家普遍接受,此模型认为,马达的2个头部运动与人的2条腿走路时类似,交替前进,其中一个头部与微管结合时,另一个头部才从微管上解离,每个头部前进一步的距离为16 nm.驱动蛋白在头部的带动下,从而拖动“货物”沿微管完成定向移动.多细胞动物中,驱动蛋白-1不仅可以运输膜结构的“货物”,如囊泡、线粒体和溶酶体等,还可以运输非膜结构的“货物”,如mRNA等.动物神经元的轴突、真菌的菌丝和植物的花粉管等细胞中,“货物”运输活跃.在果蝇(Dro‐sophila melanogaster)和秀丽线虫(Caenorhabditis elegans)中,驱动蛋白-1的基因(Kin-1)为必需基因,其KHC突变会造成胚胎发生异常、神经肌肉缺陷,其缺失会导致幼虫死亡[9-10].因此,为了研究Kin-1的体内功能,选择低等真核生物显得尤为必要.
随着分子生物学技术的发展,粗糙脉孢菌(Neu‐rospora crassa)作为典型丝状真菌模式生物,其基因组序列已于2003年公布,使得利用反向遗传学手段构建其中感兴趣的基因敲除突变株成为可能.更重要的是,粗糙脉孢菌菌丝具有典型的极性生长特点,囊泡类物质、细胞器和蛋白质等的运输非常活跃,因此,粗糙脉孢菌无疑是研究体内Kin-1功能的良好材料.本研究旨在通过构建Kin-1敲除突变株Kin-1KO,分析其表型的变化,研究Kin-1的体内功能,为进一步深入阐明真菌的生长发育机制提供一定的依据.
1 实验部分
1.1 试剂和材料
分析纯琼脂粉、葡萄糖、磷酸二氢钾和硫酸镁等购自北京江晨文轩生物有限公司,DNA聚合酶、限制性内切酶和T4 DNA连接酶等购自纽英伦生物技术(北京)有限公司,1 kb DNA分子量标准购自美国赛默飞世尔科技有限公司,潮霉素B、琼脂糖、聚合酶链式反应(polymerase chain reaction,PCR)产物和DNA片段回收试剂盒与植物细胞壁钙荧光白(calcofluor white,CFW)购自北京经科宏达生物科技有限公司.
野生型粗糙脉孢菌菌株87-3和Ku70RIP由中国农业大学何群教授提供,大肠杆菌JM109菌株购自北京索莱宝科技有限公司.所用引物依据粗糙脉孢菌菌株基因组序列以及潮霉素抗性基因hph的序列设计,由生工生物工程(上海)股份有限公司合成.引物的名称及序列见表1.

表1 构建基因敲除突变株所用引物
1.2 仪器
使用上海一恒科技有限公司生产的LRH-150、DHP-9082型培养箱进行菌株培养;使用美国赛默飞世尔科技有限公司生产的MAXQ 4000型摇床进行菌株的液体培养;使用德国艾本德公司生产的5424台式离心机进行样品常温离心,离心半径8.4 cm、离心速度为 4 000~12 000 r/min、每次 1~10 min;使用德国艾本德公司生产的5424R台式离心机进行样品4℃低温离心,离心半径8.4 cm、离心速度为1 500~12 000 r/min、每次3~5 min;使用德国拜耳公司TC-25/H PCR仪进行核酸片段的扩增;使用美国bio-rad伯乐公司生产的041BR电泳槽、JY-SPCT电泳仪和Gel Doc 1000紫外凝胶成像仪进行核酸片段检测;使用美国bio-rad伯乐公司生产的Gene Pulser Xcell电穿孔仪进行分生孢子转化;使用德国徕卡显微系统有限公司生产的LEICADMRE荧光显微镜观察菌丝形态和分枝;使用日本爱普生RX630扫描仪扫描培养皿、试管和竞争性生长管中菌落和菌丝的生长状态.
1.3 粗糙脉孢菌菌株Kin-1KO构建
参考Colot等[11]的方法进行菌株培养和方法改进,构建菌株Kin-1KO,对应构建策略如图1.操作步骤:(1)以粗糙脉孢菌菌株87-3基因组DNA为模板,分别扩增Kin-1的上游(5'flank)、下游(3'flank)DNA片段,长度各约1 000 bp,所用引物为Kin-11FNotI/Kin-12RSpeI和Kin-13FHindⅢ/Kin-14RXhoⅠ,限制性内切酶消化;(2)分别与酶切后的质粒pBluescript-SK-hph连接,构建完成重组质粒pBlue‐script-SK-Kin-15'flank-hph和pBluescript-SK-hph-Kin-13'flank;(3)分别以上述质粒为模板,利用引物对Kin-1FNotI/hph-1、Kin-14RXhoⅠ/hph-2分别进行PCR扩增,获得大量Kin-15'flank+hph和hph+Kin-13'flank片段;(4)各取 2 mg片段混合后,通过电穿孔法转化粗糙脉孢菌菌株Ku70RIP,对野生型菌株的Ku70基因进行突变后,抑制DNA非同源重组,大大增强了同源重组的效率,作为遗传重组敲除目的基因的背景菌株,利用同源重组以hph基因替换宿主菌靶基因Kin-1,通过潮霉素抗性筛选获得阳性克隆;(5)挑取阳性克隆,并提取基因组DNA,进行PCR检测,获得扩增出5'flank+hph和hph+3'flank片段的克隆;(6)将分生孢子通过5 mm孔径的滤膜过滤,获得小分生孢子,潮霉素抗性筛选并结合PCR鉴定的方法,获得Kin-1KO纯合突变体.
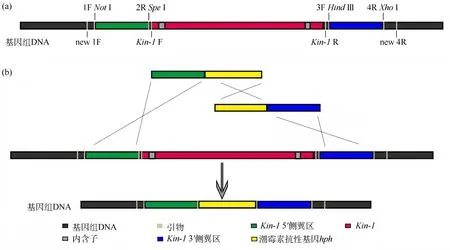
图1 同源重组构建粗糙脉孢菌菌株Kin-1KO示意(a)粗糙脉孢菌基因组DNA及各引物在基因组中的位置;(b)同源重组敲除Kin-1
1.4 Kin-1KO突变株表型分析
1.4.1 菌落生长
从菌株87-3、菌株Ku70RIP和菌株Kin-1KO中,分别挑取分生孢子,制成相同质量浓度的悬液,接种于培养基中央,30℃培养12~48 h后,扫描记录菌落生长状况.
1.4.2 菌丝生长和分生孢子形成
同上,挑取3种分生孢子后,分别接种于斜面底部1/3处,30℃黑暗培养1 d,转移至室温光照培养,每隔一定时间扫描记录.
1.4.3 菌丝生长速率
同上,挑取3种分生孢子后,分别接种于竞争性生长管(race tubes)一端,室温光照培养24 h后,标记菌丝生长前沿,转入黑暗条件培养,每隔24 h标记1次菌丝生长前沿,至菌丝生长至竞争性生长管另一端时,从培养箱中取出,扫描、记录并统计分析各菌株菌丝生长速率.每一菌株至少重复3次.
1.4.4 菌丝形态
参考Cotado-Sampayo等[12]的方法,在直径10 cm的培养皿中,加入15 mL培养基,冷却至室温后,45°角插入无菌盖玻片,沿盖玻片和培养基狭缝加入5 mL相同质量浓度的上述3种分生孢子悬液,30℃培养12 h,3.7%甲醛固定,0.5 mg/mL CFW染色后封片,显微镜观察拍照.
2 实验结果
2.1 生物信息学分析
从美国国家生物信息中心(National Center for Biotechnology Information,NCBI)查询Kin-1基因序列(NCU09730)及其上下游序列结果显示,Kin-1由2 997个核苷酸组成,包含2个内含子,开放阅读框(open reading frame,ORF)区域为 2 787 bp,编码928个氨基酸,粗糙脉孢菌驱动蛋白-1结构示意如图2所示,包含马达结构域、颈链、茎部和尾部,为典型的驱动蛋白家族成员.

图2 粗糙脉孢菌驱动蛋白1
2.2 粗糙脉孢菌中Kin-1KO突变体构建
在Kin-1KO突变体构建中,分别获得Kin-15'flank+hph(2 007 bp)和hph+Kin-13'flank(2 358 bp)片段后,转化至Ku70RIP菌株.阳性菌落转至斜面上培养转接3代后,提取基因组DNA、PCR初步鉴定Kin-1KO突变体.PCR鉴定结果如图3所示.表明:初步获得了2株突变体Kin-1KO2#和14#,即能够扩增出片段5′flank+hph和hph+3′flank,无目的基因Kin-1条带,而Ku70RIP对照中扩增出Kin-1条带,无片段5′flank+hph和hph+3′flank;滤膜过滤后,得到仅含1个细胞核的小分生孢子,以new1F/hph-1、new4R/hph-2为引物时,分别扩增出大小为2 131和2 566 bp的片段,以Kin-1F/R为引物时未扩增出目的基因Kin-1条带;而对照Ku70RIP菌株中,以 new1F/hph-1、new4R/hph-2为引物时未扩增出条带,以Kin-1F/R为引物时扩增出了目的基因Kin-1的条带,为3 063 bp.共获得了4株Ku70RIPKin-1KO纯合突变体,分别编号为2#-8、2#-9、2#-10和14#-1.

图3 粗糙脉孢菌Kin-1KO菌株的聚合酶链式反应鉴定(a)杂合菌株;(b)纯合菌株
2.3 粗糙脉孢菌Kin-1KO表型分析
2.3.1 菌落生长情况
野生型菌株87-3和菌株Ku70RIP的生长情况如图4所示.在36 h时,菌株87-3的菌落接近铺满培养基表面,48 h全面覆盖;对应时间菌株Kin-1KO的菌落直径仅约为野生型的1/3,其菌落生长速度均明显减慢,表明Kin-1敲除后,菌落生长速度明显受到了抑制.从菌落的形态来看,菌株Ku70RIP菌落疏松,菌株Kin-1KO的菌落形状呈花椰菜型,较紧密.
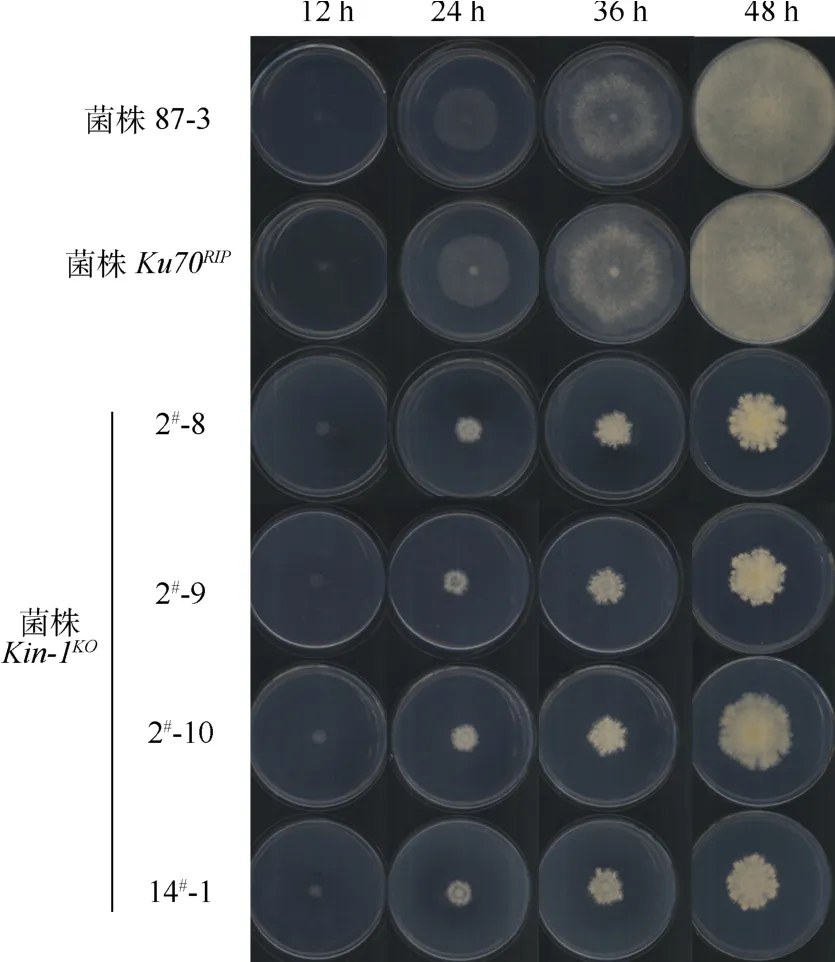
图4 不同菌株接种不同时间后菌落生长情况
2.3.2 菌丝生长和分生孢子的形成情况
不同菌株的菌丝生长和分生孢子的形成情况如图5所示.菌株87-3和菌株Ku70RIP的菌丝饱满,均匀地生长在斜面培养基上,且分生孢子集中出现在斜面顶端;菌株Kin-1KO的菌丝表面干瘪,紧紧贴附在斜面培养基表面,分生孢子数量明显减少,在斜面培养基表面不规则分布.

图5 不同菌株的菌丝生长和分生孢子形成情况(a)第1天;(b)第7天
2.3.3 菌丝生长速率情况
不同菌株的菌丝生长速率如图6所示.菌株87-3和菌株Ku70RIP的菌丝转入黑暗培养8 d后,生长至竞争性生长管的另一端,二者的平均生长速率分别为(3.87 ±0.27)和(3.87 ±0.45)cm/d;Kin-1KO菌丝生长速率受到了明显抑制,前5天,Kin-1KO2#-8、2#-9、2#-10和 14#-1的平均生长速率分别为(1.00±0.01)、(0.92±0.03)、(0.87±0.04)和(0.91±0.01)cm/d,随后生长速率逐渐减小.

图6 竞争性生长管分析菌丝生长情况(a)生长情况图示;(b)生长速率分析
2.3.4 菌丝形态
不同菌株的菌丝分枝情况如图7所示.与菌株87-3和菌株Ku70RIP相比,Kin-1缺失后,菌株Kin-1KO的菌丝分枝明显增多、菌丝直径增加和细胞长度明显变短.

图7 不同菌株的菌丝分枝情况(a)菌株 87-3;(b)菌株 Ku70RIP;(c)菌株 Kin-1KO
3 讨 论
随着分子生物学技术的发展,2003年,粗糙脉孢菌全基因组测序完成,构建基因敲除突变株是研究基因体内功能的一种非常有效的方法,因此,为了深入分析驱动蛋白-1在粗糙脉孢菌菌丝极性生长中的功能,本研究中以粗糙脉孢菌为材料,通过同源重组对其Kin-1基因进行了敲除,证实敲除菌株表型存在明显的缺陷,主要体现在菌落生长减慢、菌丝生长速率下降、菌丝分枝增多和分生孢子数量明显减少等.这些结果表明:Kin-1不是粗糙脉孢菌生命活动的必需基因,其缺失后粗糙脉孢菌虽然生长异常,但是能够存活;Kin-1在菌丝极性生长过程中起着重要的调控作用.
真菌菌丝以极性生长为典型特征,极性一旦确定后,便以惊人的速度延伸.在快速的极性生长过程中,需要充足的细胞壁和细胞膜前体物质,连续地合成,并运输囊泡类物质和细胞器等到生长部位.在菌丝顶端区域有一特殊的细胞器—顶体(Spit‐zenkÖrper),其被认为是顶端生长的囊泡贮存供给中心,虽然目前对顶体的成分及组装机制不是很清楚,但是一般认为,由微管骨架经长距离运输囊泡类等物质到顶体,然后再由微丝骨架将顶体内的囊泡类等物质经短距离运送至生长的质膜部位.驱动蛋白是一类非常重要的基于微管骨架运输的马达蛋白,通过水解ATP将化学能转变为机械能,从而产生沿微管骨架的定向运动.Fuchs等[13]表明当用专一性药物苯菌灵(benomyl)处理解聚微管骨架后,玉米黑粉菌(Ustilago maydis)菌丝生长缓慢;Steinberg 和 Schliwa[14]曾通过 5′-Race等方法获得了粗糙脉孢菌NKin的cDNA序列;Seiler等[15]对NKin进行点突变获得的驱动蛋白功能缺陷株中,证实其在菌丝生长、分枝等方面均表现异常;Lehmler等[16]对玉米黑粉菌Kin-1无效突变株的研究表明,菌丝顶端膜物质的积累消失,绿色荧光蛋白与Kin-1的融合蛋白定位于顶端特定的区域,与顶体囊泡紧密相连[17].在丛赤壳菌(Nectria haematococca)中,Kin-1基因缺失后,菌丝细胞内顶体明显变小,囊泡类物质运输受到抑制,菌丝顶端弯曲[18].由此可见,不论是作为轨道的微管骨架,还是作为能量来源的驱动蛋白-1,在顶体的形成及菌丝的极性生长中二者缺一不可.因此,本研究中Kin-1缺失后,囊泡运输的能量来源受到影响,阻止了菌丝生长所需原料的运输,进而抑制菌丝的极性生长.
4 结束语
本研究通过构建粗糙脉孢菌Kin-1缺失突变体,证明了其调控着菌丝生长发育.迄今为止,微管骨架在极性生长中的研究取得了一些进展,但是仍有许多问题亟待解决,如:驱动蛋白家族除驱动蛋白-1亚家族外,还有其他14个亚家族成员,而在粗糙脉孢菌基因组中,有12个基因分别编码不同的驱动蛋白亚家族成员,其分别运输哪些不同的“货物”,哪些区域负责结合“货物”,功能是否存在重叠或互相依赖等,这些问题都是后续的研究方向.
