接种戊糖乳杆菌和酿酒酵母菌对低盐发酵鳊鱼品质的影响
2022-04-22田旭艳夏文水许艳顺
田旭艳,高 沛,夏文水,许艳顺
江南大学 食品学院,江苏 无锡 214122
鳊鱼 (Parapraxis pekinensis) 富含优质蛋白质、不饱和脂肪酸和维生素D等物质[1],营养价值高。根据《2021年中国渔业统计年鉴》数据,2020年鳊鱼产量达78.1737万吨。目前,鳊鱼主要以鲜活或加工成干腌鱼等形式销售,加工方式比较单一。
发酵作为食品加工和保存的传统方法之一,已广泛应用于易腐肉类和鱼类产品的加工,包括发酵火腿[2]、香肠[3]和发酵鱼[4]等。发酵过程中,在微生物和内源酶的作用下蛋白质分解成多肽和氨基酸,同时导致生物胺的积累[5]。生物胺与发酵水产品的食用安全密切相关,生物胺的过量摄入对人体健康有害,容易导致高血压、心悸、头痛,严重者甚至危及生命[6-8]。现有腌制发酵鱼加工通常采用高盐或低温密闭发酵。高盐条件下可抑制有害微生物的生长,但长期的高钠摄入会增加肾脏负担,易引起高血压、中风等心血管疾病。低盐条件下通过微生物发酵降低pH可以抑制病原及腐败菌的生长,形成浓郁的酸香风味,但在酸性条件下蛋白发生变性,持水性下降,导致在熟制过程中水分流失严重,口感改变,且过酸的鱼或肉影响了部分消费者的接受度。如何在低盐和低酸条件下赋予鱼肉良好的发酵风味和保障产品安全是一个挑战。前期已研究了发酵温度对低盐发酵鳊鱼风味、微生物和理化特性的影响[9],发现采用两段式阶段控温发酵的方式有利于改善低盐发酵鳊鱼的风味及品质,但采用自然发酵方式,易受有害微生物污染,生物胺含量较高,难以保证产品品质的稳定性和安全性。采用有益的微生物发酵剂接种发酵是提升发酵食品品质的重要技术手段,已被广泛应用于鱼类发酵食品加工中。Bao等[10]研究发现接种乳酸菌可提高臭鳜鱼产品品质和增加风味,同时缩短了发酵时间;Zeng等[11]研究显示接种发酵可降低酸鱼pH,抑制产品中有害微生物的生长,同时促进蛋白降解并改善风味;Zaman等[12]在鱼露发酵过程中接种具有胺氧化酶活性的发酵剂有效减少了鱼露中生物胺的积累。因此,本文在前期建立的鳊鱼阶段控温发酵工艺基础上,将戊糖乳杆菌 (Lactiplantibacillus pentosus) 和酿酒酵母菌 (Saccharomyces cerevisiae)作为发酵剂接种于发酵鳊鱼中,探讨接种发酵对鳊鱼发酵过程中生物胺形成及其风味品质的影响,为微生物发酵技术在鱼类加工中的应用和提高发酵水产食品质量安全提供参考。
1 材料与方法
1.1 试剂与仪器
鲜活鳊鱼 [体质量为 (700±100) g]、食盐、白酒、糖、花椒、香叶,生姜均购于当地超市 (中国江苏无锡);发酵菌株:戊糖乳杆菌Lactiplantibacillus pentosus (Lp-1) 和酿酒酵母菌Saccharomyces cerevisiae (Sc-2018),由本研究室于中国传统固态发酵酸鱼中分离纯化制备;保藏于中国典型培养物保藏中心 (武汉大学),菌种编号分别为:戊糖乳杆菌(CCTCC AB 2022072),酿酒酵母菌 (CCTCC AY 2022001);色胺、腐胺、尸胺、酪胺、组胺、精胺、亚精胺和苯乙胺标准品购自Sigma公司;平板计数琼脂培养基 (PCA)、乳酸菌琼脂培养基 (MRS)、酵母浸出粉葡萄糖琼脂培养基 (YPD) 均购自青岛海博有限公司;2,4,6-三甲基吡啶 (TMP, 98%) 购自东京化成工业株式会社;其余试剂购自国药集团化学试剂有限公司,均为分析纯。
EL20型pH计 (上海Mettler);IKA-T10高速分散机 (德国IKA集团股份有限公司Toledo公司);4K15型冷冻离心机 (德国Sigma Laborzentrifugen公司);Alpha-1900S型紫外分光光度计 (上海谱元仪器有限公司);BM-400P型拍打机 (上海Truelab Lab-Sci);TSQ 8000气质联用仪 (美国Thermo Fisher Scientific公司);Ultimate 3000高效液相色谱 (德国Thermo Scientific公司)。
1.2 实验方法
1.2.1 工艺流程
原料鱼→预处理→腌制→发酵剂制备→接种发酵→成品。
1.2.2 操作要点
原料预处理:平均质量为 (700±100) g的新鲜鳊鱼去鳞、去内脏并清洗干净。腌制辅料准备:以鱼质量为基准,腌制料配比为:食盐2%、酒0.5%、糖1%、花椒0.1%、香叶0.1%,生姜3%,混合均匀,备用。低温腌制:将上述混合均匀的腌制料均匀涂抹在沥干水分的鱼体上,置于腌制桶并密封,0~4 ℃条件下腌制24 h。发酵剂制备:选用从传统发酵鱼中筛选分离的微生物菌株戊糖乳杆菌 (Lp-1)和酿酒酵母 (Sc-2018),活化后制备成菌悬液备用,2种菌株活化扩大培养后的悬浮液最终浓度均为 7~9 log CFU·g-1。阶段控温发酵:分别采用浸渍方式接种活化的发酵菌株Lp-1和Sc-2018,在特定温度下悬挂进行发酵,20 ℃条件下发酵2 d,然后10 ℃再发酵2 d。以未接种发酵作为对照组,每天取样并贮存于-50 ℃条件下用于后续实验分析。
1.3 指标测定方法
1.3.1 pH 测定
取样品 (2.0 g) 于18 mL蒸馏水中,均质后用pH计测定。
1.3.2 挥发性盐基氮 (TVB-N) 测定
参照Liao等[13]的方法,并稍作修改,称取4 g样品,加入20 mL去离子水,均质并离心 (10 000×g,10 min),取上清液,采用全自动凯氏定氮仪测定,结果表示为 mg·kg-1;
1.3.3 TCA-可溶性肽测定
参考Wang等[14]的方法,取3 g样品加入27 mL预冷的 50 mg·mL-1TCA 溶液,11 000 r·min-1均质2 min,4 ℃ 静置 1 h,然后在 12 000 ×g下离心 10 min,收集上清液,测定上清液中的TCA-可溶性肽质量摩尔浓度,结果表示为 μmol·g-1。
1.3.4 微生物检测
采用Sun等[15]的方法进行微生物分析,在无菌条件下,取5 g剁碎样品,放入无菌自封袋中,倒入45 mL无菌生理盐水,无菌均质机均质2 min。样品用无菌生理盐水连续稀释。菌落总数:PCA培养基30 °C培养72 h;乳酸菌:MRS培养基30 ℃培养72 h;酵母菌:PDA培养基30 ℃培养72 h。结果以log CFU·g-1表示。
1.3.5 生物胺含量测定
参照Xu等[16]的方法测定生物胺,取2.0 g样品,加入10 mL 0.6 mol·L-1高氯酸溶液,均质并离心 (4 ℃, 10 000×g, 10 min)。取上清液,重复上述操作,合并2次上清液,最后用0.6 mol·L-1高氯酸溶液定容至25 mL。用1%丹磺酰氯进行柱前衍生,过0.22 μm有机膜,滤液在0~4 ℃下储存用于测定生物胺含量。采用RP-HPLC-UV和安捷伦ZORBAX SB-C18柱 (4.6×150 mm, 5 μm) 进行分析。根据标准品的保留时间和峰面积识别和计算,结果以 mg·kg-1表示。
1.3.6 挥发性风味物质含量测定
称取2.0 g样品,转移至20 mL顶空进样瓶中,通过SPME提取挥发性化合物。挥发性化合物通过GC-MS进行分析,使用30 mm×0.25 mm×0.25 μm DB-WAX柱。气相色谱和质谱条件参照Gao等[17]的方法。挥发性风味化合物根据NIST2005和Willey 7标准库进行鉴定,并利用内标2,4,6-三甲基吡啶进行半定量。结果以μg·kg-1表示。
1.4 数据处理
2 结果与分析
2.1 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼中微生物的影响
发酵过程中,对照组和接种Lp-1、Sc-2018组鳊鱼的微生物变化见图1。从整体上看,对照组和接种发酵组的菌落总数在发酵前2 d均显著增加(P<0.05),发酵后期趋于稳定 (图1-a)。Lp-1接种组菌落总数在整个发酵期间显著高于对照组 (P<0.05)。Sc-2018接种组菌落总数在发酵前期显著高于自然发酵组,但在发酵结束时无显著差异。
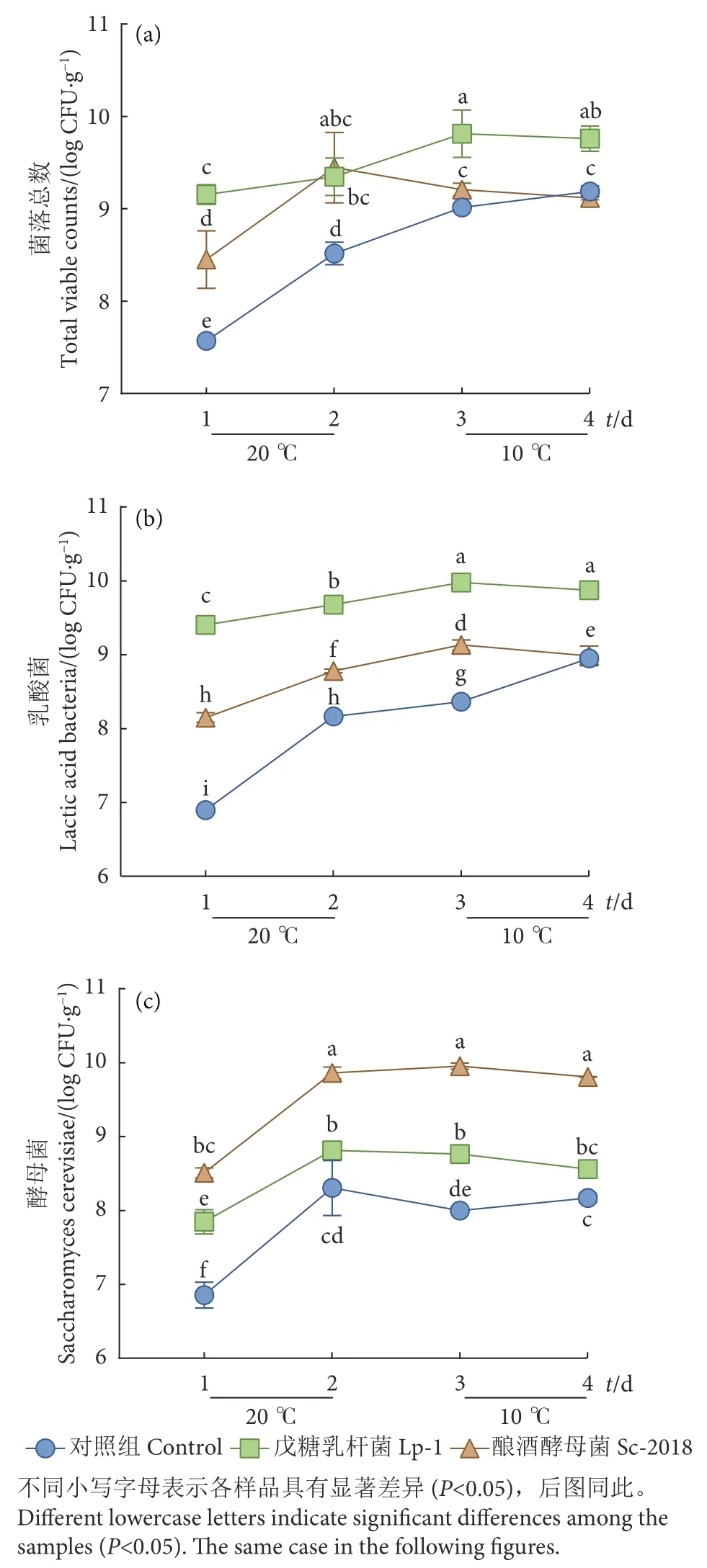
图1 鳊鱼发酵期间微生物变化Fig. 1 Change of microbiological during fermentation of bream
同样地,随着时间延长,对照组和接种发酵组的乳酸菌均呈增长趋势,并在发酵后期趋于稳定(图1-b)。乳酸菌快速生长有利于积累乳酸和产生细菌素等抑菌物质,抑制致病菌和腐败菌的生长,且由脱羧酶阴性乳酸菌引起的pH快速降低可以抑制生物胺的形成,对产品的安全性有积极影响[11,18]。整个发酵过程中Lp-1接种组样品中乳酸菌数量显著高于Sc-2018接种组和自然发酵组 (P<0.05)。发酵结束时Lp-1接种组、Sc-2018接种组和对照组样品中乳酸菌分别为9.87、8.99和8.95 log CFU·g-1,但Sc-2018接种组和对照组乳酸菌数量无显著差异。
酵母菌对发酵鱼的滋味和挥发性风味有积极的影响,有利于提升发酵制品的品质[11]。在发酵过程中,发酵前期酵母菌均呈增长趋势,且Sc-2018接种组酵母菌数量显著高于其余两组 (图1-c)。但在发酵后期,所有发酵组酵母菌生长均趋于平缓,可能是由于降低发酵温度对酵母菌生长产生了抑制作用。
2.2 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼pH的影响
鳊鱼发酵过程中pH变化见图2-a。与对照组相比,Lp-1接种组和Sc-2018接种组样品pH均有所降低,其中Lp-1接种组降低较显著,这与Lp-1接种组乳酸菌快速生长产酸有关。pH降低能够有效抑制发酵食品中腐败菌和致病菌,提高产品安全性,这可能也是Lp-1接种组生物胺含量显著低于其余两组的原因。发酵结束时,对照组、Lp-1接种组和Sc-2018接种组的pH分别为6.86、5.32和6.56。此外,尽管接种Lp-1组在发酵后期乳酸菌数量仍较高 (图1-b),但pH下降程度较小,这可能与在发酵后期降低发酵温度有关。Lp-1接种组pH呈先降低后略有增加的趋势,发酵香肠[19]和臭鳜鱼[20]中也报告了类似的结果,pH在发酵过程中呈波动趋势,在早期发酵阶段,pH下降,发酵结束pH略有增加。此外,在发酵过程中,鱼蛋白降解会逐渐释放出氨基酸和其他代谢物,氨基酸在微生物作用下形成的碱性氨与酸发生反应[21],部分导致对照组和Sc-2018接种组样品pH变化不明显。
2.3 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼TVB-N含量的影响
在发酵过程中,鱼蛋白被内源酶和微生物分解产生碱性含氮物质,TVB-N通常用于肉类或鱼类产品的新鲜度评估[22]。鳊鱼发酵过程中TVB-N含量变化见图2-b。在各发酵组中,TVB-N随发酵时间的延长逐渐增加,且对照组TVB-N增加较显著。发酵2 d后,Lp-1接种组和Sc-2018接种组样品中TVB-N均显著低于对照组 (P<0.05 )。发酵结束后,Sc-2018接种组 (251.81 mg·kg-1) 和对照组(261.63 mg·kg-1) TVB-N 无显著差异 (P>0.05)。鱼类中TVB-N的可接受范围不高于300.00 mg·kg-1[23]。发酵4 d后,自然发酵组、Lp-1接种组和Sc-2018接种组样品的TVB-N含量均在可接受范围内。值得注意的是,发酵结束后Lp-1接种组 (164.26 mg·kg-1)的TVB-N含量显著低于其余两组 (P<0.05),表明接种乳酸菌可以有效抑制TVB-N的增加。
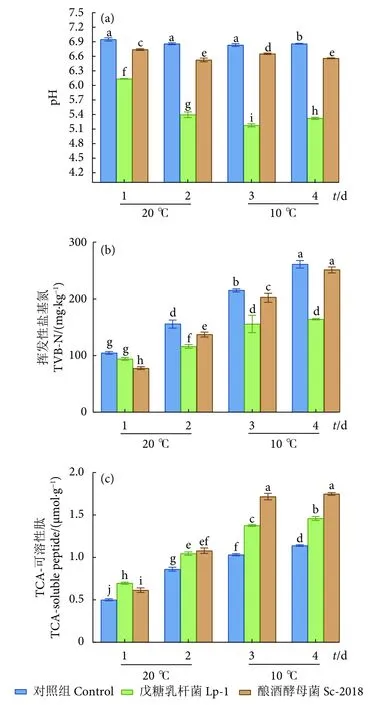
图2 鳊鱼发酵期间pH、挥发性盐基氮和TCA-可溶性肽含量变化Fig. 2 Changes of pH, TVB-N and TCA-soluble peptide content during fermentation of bream
2.4 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼TCA-可溶性肽的影响
TCA-可溶性肽是蛋白降解产生的低分子肽,可作为表征鱼肉蛋白降解的指标[24]。鳊鱼发酵过程中TCA-可溶性肽变化见图2-c。在整个发酵过程中,各发酵组样品TCA-可溶性肽持续增加,表明鳊鱼发酵过程中发生了蛋白降解。微生物接种对鳊鱼发酵过程中TCA-可溶性肽有较大影响。发酵过程中Lp-1接种组和Sc-2018接种组样品TCA-可溶性肽均显著高于对照组 (P<0.05)。发酵4 d后,Lp-1接种组和Sc-2018接种组样品TCA-可溶性肽含量分别是对照组的1.28和1.51倍。蛋白质的降解程度可能与接种发酵剂中微生物的种类相关,接种发酵促使酵母菌和乳酸菌快速生长并成为发酵过程中的优势菌,分泌更多的蛋白水解酶,促进蛋白质降解。华倩[18]研究发现接种不同发酵剂制备的鱼酱酸具有不同的蛋白水解程度。此外,可溶性肽可进一步代谢为氨基酸,可直接作为滋味化合物或风味前体[25]。TCA-可溶性肽含量较高的发酵鳊鱼中检测到更多香气物质的结果也支持了这一点 (图3-b)。
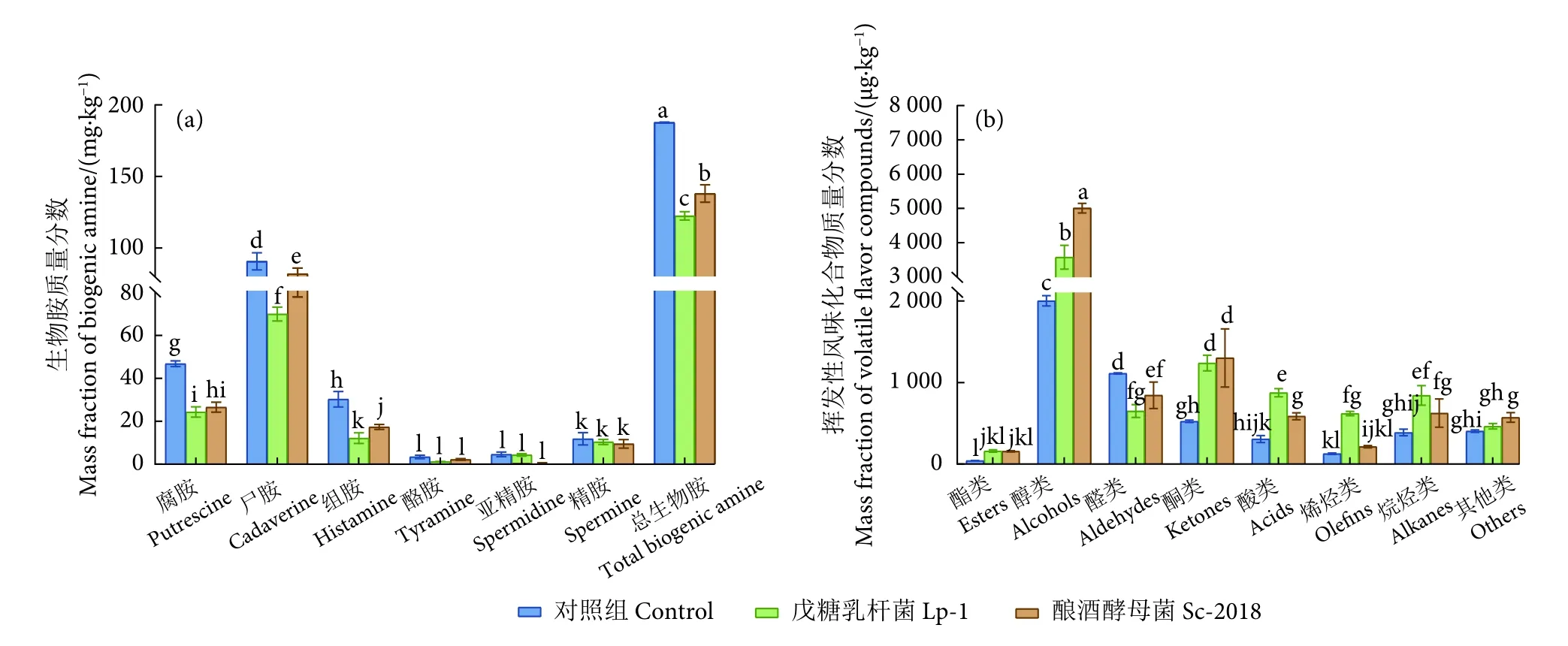
图3 鳊鱼发酵过程中生物胺和挥发性风味化合物质量分数变化Fig. 3 Change of mass fraction of biogenic amine and volatile flavor compounds during fermentation of bream
2.5 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼生物胺含量的影响
鳊鱼发酵4 d后生物胺的质量分数见图3-a。发酵4 d后的样品中检测到6种生物胺,包括腐胺、尸胺、组胺、酪胺、亚精胺和精胺。此外,所有样品中都未检测到色胺和苯乙胺。
腐胺、尸胺和组胺是影响发酵鱼安全性和质量的重要因素,可用作鱼肉微生物腐败的指标[8,26]。发酵4 d后,所有发酵组中腐胺、尸胺和组胺含量均较高,酪胺和亚精胺含量相对较低。发酵4 d后,对照组样品腐胺、组胺和尸胺含量显著高于Lp-1接种组和Sc-2018接种组 (P<0.05)。Sc-2018接种组和Lp-1接种组腐胺含量无显著差异,但显著低于对照组样品腐胺含量 (P<0.05)。另外,各发酵组中酪胺、精胺和亚精胺含量均无显著差异。与对照组相比,Lp-1接种组 (122.41 mg·kg-1) 和Sc-2018接种组 (138.10 mg·kg-1) 的总生物胺质量分数分别降低了34.78%和26.42%。上述结果表明,接种发酵有利于抑制生物胺的形成,其中Lp-1接种组对生物胺的抑制效果更佳。据报道,食品中产脱羧酶微生物生长繁殖,分泌脱羧酶进而对氨基酸进行脱羧作用会导致生物胺的积累,发酵过程中通过降低pH等方式可抑制产胺菌的生长,从而减少生物胺的生成[8]。朱容新等[27]研究发现腌制鲅鱼加工贮藏过程中,添加戊糖乳杆菌可快速降低pH,有效抑制生物胺的形成。Lp-1接种组生物胺含量显著减少可能与乳酸菌在鳊鱼发酵过程中产酸抑制产脱羧酶微生物生长有关,从而降低生物胺的累积。Lp-1接种组pH较低也支持了这一点 (图2)。
2.6 接种戊糖乳杆菌和酿酒酵母对低盐发酵鳊鱼挥发性风味成分含量的影响
挥发性化合物是发酵食品独特气味的主要来源,在发酵过程中,内源酶和微生物酶诱导鱼蛋白质、脂肪等成分发生一系列复杂的理化和生化反应,形成产品独特的风味[28]。鳊鱼发酵4 d后挥发性风味物质含量见图3-b和表1。在3组样品中共鉴定出95种挥发性化合物,包括8种酯、29种醇、12种醛、4种酸、8种酮、17种烷烃、8种烯烃和9种其他化合物。对照组、Lp-1接种组和Sc-2018接种组样品中分别检测到62、62和72种挥发性化合物。其中有40种成分在3种发酵鱼中共同检出。对照组样品中挥发性风味物质含量较高(>100 μg·kg-1) 的为乙醇、异戊醇、壬醛、3-羟基-2-丁酮、正己醛、对二甲苯、乙酸、正己醇、1-辛烯-3-醇、丙酮、芳樟醇;在Lp-1接种组样品中挥发性风味物质质量分数较高 (>100 μg·kg-1) 的是乙醇、3-羟基-2-丁酮、芳樟醇、乙酸、1-辛烯-3-醇、十二烷、壬醛、4-萜烯醇、苯乙烯、对二甲苯、丙酮、2-茨醇、2,6,11-三甲基-十二烷、ç-松油烯、桉叶油醇、2,5-辛二酮、乙酸乙酯、乙苯、异戊酸、正己烷;Sc-2018接种组样品中挥发性风味物质量分数较高 (>100 μg·kg-1) 的是乙醇、异戊醇、2-丁酮、壬醛、3-羟基-2-丁酮、苯乙醇、1-辛烯-3-醇、异戊酸、乙二醇苯醚、二甲苯、十二烷、芳樟醇、正己醛、桉叶油醇、2,6,10-三甲基-十二烷、2-甲基丁酸、丙酮、2-甲基丁醇。
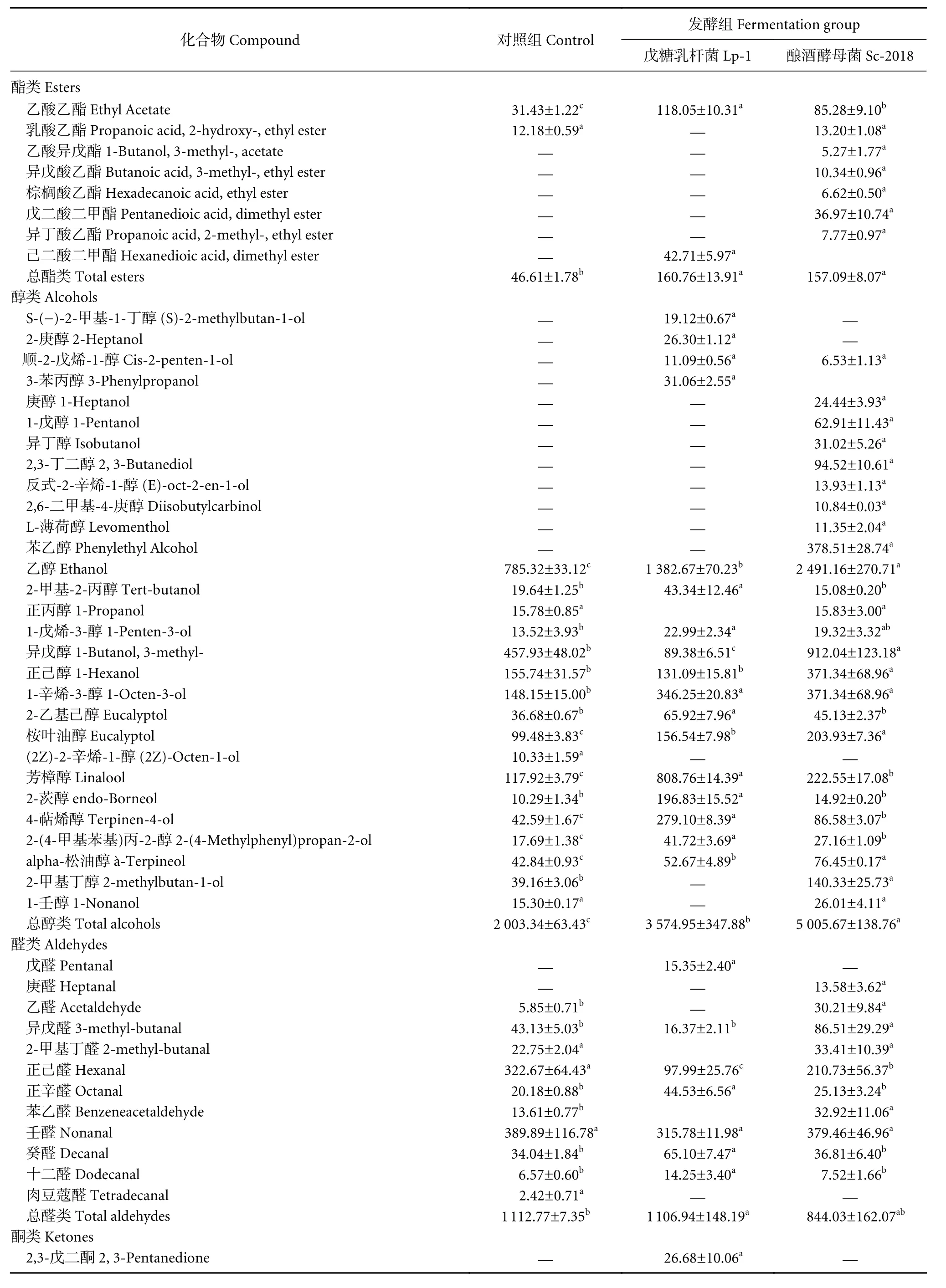
表1 鳊鱼发酵过程挥发性风味化合物变化Table 1 Change of volatile flavor compounds during fermentation of bream μg·kg-1
酯类是影响发酵鱼风味的重要化合物。一般来说,它们是由具有高糖酵解或脂解活性的微生物通过酸和醇酯化形成的,为产品贡献果味香气[28]。发酵4 d后,Lp-1接种组和Sc-2018接种组中总酯类化合物分别是对照组的3.68和3.60倍,尤其是乙酸乙酯的含量显著高于对照组。发酵4 d后,Lp-1接种组和Sc-2018接种组中总酯类化合物含量无显著差异,但Sc-2018接种组酯类化合物种类最多。其中乙酸乙酯具有柠檬油气味,结果表明,接种发酵可促进酯类风味物质的形成,对发酵鳊鱼的风味起着重要作用。
多数醇类化合物具有令人愉快的香气,是发酵鱼主要的挥发性化合物[29]。发酵4 d后,各发酵组中,醇类挥发性风味化合物含量最高,占总挥发性物质的40.23%~53.78%。发酵4 d后,Sc-2018接种组醇类物质质量分数分别是Lp-1接种组和对照组的1.40和2.50倍。其中,主要的醇类化合物为乙醇,Lp-1接种组 [(1 382.67±70.23) μg·kg-1] 和 Sc-2018接种组乙醇 [(2 491.16±270.71) μg·kg-1] 质量分数尤其高,接种组乙醇含量较高的原因可能是酿酒酵母能够通过酒精发酵途径利用碳水化合物产生大量乙醇,而戊糖乳杆菌为兼性异型乳酸发酵菌,可通过乳酸发酵途径产生乙醇[29]。Sc-2018接种组中检测到较高的苯乙醇 [(378.51±28.74) μg·kg-1],苯乙醇是一种重要的挥发性风味物质,具有甜香、玫瑰花香和蜂蜜香[29]。苯乙醇是芳香族氨基酸——苯丙氨酸的代谢产物,Sc-2018接种组苯乙醇含量较高可能与酿酒酵母降解苯丙氨酸生成苯乙醇有关。另外,一些来源于香料的挥发性化合物也有助于鳊鱼香气的形成,如芳樟醇等。
对照组总醛质量分数高于其余两组,主要是己醛质量分数较高 [(155.74±31.57) μg·kg-1]。己醛呈草腥味和脂肪味等不愉悦气味[30]。相较于对照组[(322.67±64.43) μg·kg-1],Lp-1接种组 [(97.99±25.76) μg·kg-1] 和 Sc-2018接种组 [(210.73±56.37)μg·kg-1] 中己醛显著降低,表明接种发酵后鳊鱼的腥味、草腥味和脂肪味等不良气味有所降低。
酮主要由不饱和脂肪酸氧化、微生物代谢或氨基酸降解产生[31]。发酵4 d后,Lp-1接种组和Sc-2018接种组酮类物质质量分数分别是对照组的2.36和2.48倍。各发酵组中均检测出3-羟基-2-丁酮,其中 Lp-1接种组 [(832.38±22.65) μg·kg-1] 尤其高 (P<0.05),占总酮类物质的67.17%。3-羟基-2-丁酮 (乙偶姻) 呈水果香和木香及令人愉悦的奶香,在丁二醇脱氢酶作用下可逆地转换成2,3-丁二醇,或在丁二酮还原酶作用下可逆转换成具有奶酪、黄油味的2,3-丁二酮 (双乙酰)[32-33]。王蔚新[29]研究发现接种不同微生物菌株的发酵酸鱼中含有的3-羟基-2-丁酮存在较大差异。Lp-1接种组中3-羟基-2-丁酮含量显著高于Sc-2018接种组和对照组,由此可见,戊糖乳杆菌在发酵过程中可代谢产生3-羟基-2-丁酮,对鳊鱼特殊风味形成具有促进作用。
在发酵4 d后,对照组、Lp-1接种组和Sc-2018接种组中酸类化合物存在显著差异(P<0.05),Lp-1接种组中酸类化合物显著高于其余两组,分别是对照组和Sc-2018接种组样品的2.85和1.49倍。所有样品中共5种酸类化合物,包括乙酸、异丁酸、壬酸、异戊酸和2-甲基丁酸。乙酸是发酵鱼中重要的酸类化合物,与乙酸乙酯的生成存在关联。Lp-1接种组发酵过程中检出最多乙酸 [(664.65±31.31) μg·kg-1],显著高于另外两组 (P<0.05),占总酸类化合物的75.84%。乙酸作为乳酸菌异型乳酸发酵的产物,与乳酸菌的快速生长有关 (图1)。发酵结束后,Lp-1接种组烷烃类化合物和烯烃类化合物均高于对照组和Sc-2018接种组。样品中检测出多种烯烃化合物和其他物质,包括姜黄烯、(+)-柠檬烯和花椒素等。这些化合物主要来源于香料,如生姜、香叶等,这可能是鳊鱼香气形成的另一个重要因素。

续表 1
综上,接种发酵后酯类、酮类和醇类含量均有不同程度的增加,接种戊糖乳杆菌Lp-1和酿酒酵母菌Sc-2018可通过降低呈草腥味和脂肪味等不愉悦气味化合物的含量和增加令人愉悦化合物的含量来提高发酵鳊鱼的风味品质。
3 结论
微生物接种发酵有利于提升发酵鳊鱼的风味和安全品质。从食品安全角度来看,接种戊糖乳杆菌Lp-1 和酿酒酵母 Sc-2018 发酵显著降低了发酵鳊鱼中尸胺、腐胺、组胺和总生物胺含量,抑制了TVB-N 的累积,其中戊糖乳杆菌 Lp-1 接种发酵抑制效果更佳。从风味角度来看,接种乳酸菌和酵母菌发酵促进了蛋白降解和风味的形成,接种发酵能有效抑制呈草腥味和脂肪味等不愉悦气味的己醛生成,促进乙酸乙酯、乙醇、3-羟基-2-丁酮等令人愉悦的风味物质产生,提升发酵鳊鱼的风味;且接种戊糖乳杆菌 Lp-1 对形成乙酸乙酯、3-羟基-2-丁酮等风味物质的促进效果优于酿酒酵母 Sc-2018。因此,在两段式阶段控温发酵方式的基础上,接种戊糖乳杆菌和酿酒酵母可进一步提高低盐发酵鳊鱼的产品质量和食用安全,为开发低盐和酸度适中的发酵鱼制品提供了可能的解决思路,具有良好的应用潜力。
