羧甲基琼胶对罗非鱼鱼糜凝胶性能的影响
2022-04-22杨少玲王悦齐杨贤庆李来好王露楠
戚 勃 ,杨少玲 ,王悦齐,胡 晓,杨贤庆,潘 创,李来好,王露楠
1. 中国水产科学研究院南海水产研究所/农业农村部水产品加工重点实验室,广东 广州 510300
2. 大连工业大学/海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034
近年来,鱼糜制品因其高蛋白、低脂肪的营养特点受到广泛关注,已逐渐成为水产食品加工的主要产品,并不断开发出深受欢迎的新产品[1]。2020年,全国鱼糜制品产量达126.77万吨[2]。传统鱼糜加工主要以海捕鱼类为原料,但是随着海捕鱼类资源的衰减、休渔政策实施和捕捞方式的限制,海捕鱼类越来越无法满足鱼糜加工的需求,而养殖的罗非鱼、草鱼 (Ctenopharyngodon idella) 等淡水鱼类,资源丰富、供应稳定,因此利用淡水鱼加工鱼糜制品是解决海水鱼原料短缺的有效途径。
鱼糜凝胶特性是反映鱼糜品质的最直观指标。但是淡水鱼鱼糜形成凝胶能力差,容易发生凝胶劣化,加工的鱼糜制品存在凝胶强度低、持水性差等缺点[3-4]。因此,通过加入外源添加物来改善淡水鱼鱼糜凝胶性能是当前的研究热点。亲水胶因其良好的凝胶性和保水性,已成为鱼糜加工最为广泛的外源添加物[5]。目前已有槐豆胶、琼胶、卡拉胶、魔芋胶、可得胶和结冷胶等多种亲水胶应用于鱼糜制品的研究,可不同程度地改善鱼糜的凝胶性、持水性和质构特性[6-8]。但由于不同亲水胶的理化性质不同,其对鱼糜凝胶的影响也有差异。普通琼胶在水中较难溶解,通常需要95 ℃以上保温10多分钟才能完全溶解,因此琼胶在鱼糜热凝胶化的温度下也难以溶解,不能充分发挥其胶凝作用,对改善鱼糜凝胶的效果也十分有限[9]。
羧甲基琼胶 (Carboxymethyl agar, CMA) 是通过氯乙酸改性的琼胶,具有良好的低温溶解性、持水性、分散性和复配性[10],具有更广泛的用途。目前,有关CMA在鱼糜中的应用尚未见报道。本研究通过向罗非鱼鱼糜中添加不同剂量的CMA,分别测定CMA-罗非鱼鱼糜凝胶的质构特性、持水性、蛋白化学作用力和蛋白组成,并利用扫描电镜(Scanning electron microscope, SEM) 研究其微观变化,探究了CMA对鱼糜凝胶性能的影响,为CMA在鱼糜中的应用及开发新型鱼糜凝胶改良剂提供理论基础。
1 材料与方法
1.1 材料与试剂
CMA按照王露楠等[10]的方法自制 (CMA取代度DS 0.46,溶解温度67 ℃,凝胶强度230 g·cm-2);鲜活罗非鱼购自广州华润万家超市客村店;蛋白定量试剂盒 (南京建成生物工程有限公司);NuPAGE Bis-Tris预制胶[赛默飞世尔科技 (中国) 有限公司];尿素、β-巯基乙醇 (广州化学试剂厂),试剂均为分析纯。
1.2 仪器与设备
SZ-5斩拌机 (广州德菲科学仪器有限公司)、CT3 4500质构仪 (美国BROOKFIELD公司);H1850R离心机 (湖南湘仪实验室仪器开发有限公司)、电泳仪 (美国 Bio-rad 公司);吸光酶标仪 (德国 TECAN公司);CR-400色彩色差仪 (日本KONICA MINOLTA 公司);T50 型均质机 (德国 IKA 公司);HWS 24型电热恒温水浴锅 (上海一恒科学仪器有限公司);其他均为实验室常用设备。
1.3 方法
1.3.1 鱼糜复合凝胶制备
将罗非鱼击晕、去皮、采肉、切碎,经2次漂洗,在斩拌机中斩拌5 min,添加质量分数2%的食盐 (以鱼肉质量计,下同),再分别添加0、0.5%、1.0%、1.5%、2.0%、2.5%的CMA,通过添加去离子水调节鱼糜水分质量分数至75%,再连续斩拌10 min,在斩拌过程中维持鱼糜温度<10 ℃[11]。将鱼糜紧密地灌入直径22 mm的塑料肠衣中,两端扎口,在40、90 ℃的水浴中分别加热30和20 min,然后立即将鱼糜凝胶浸入4~5 ℃的冷水中冷却1 h,最后在4 ℃冰箱中冷藏24 h。
1.3.2 鱼糜凝胶强度测定
参照GB/T 36187—2018《冷冻鱼糜》附录A的方法并稍作修改。将鱼糜从冰箱取出放至室温,去肠衣,将鱼糜凝胶平整地切成2.5 cm厚的圆柱,用质构仪测定其凝胶强度。测定条件:探头为5 mm的球形探头,采用压缩模式,测试和返回速率均为 1 mm·s-1,凝胶强度 (g·cm)=破断力 (g)×破断距离 (cm)。
1.3.3 鱼糜凝胶持水性测定
按文献[12-13]的方法,略作改动。将鱼糜凝胶切成10 mm×10 mm的小块,称其质量 (m1),再用2层滤纸包裹,置于50 mL离心管中,2 653×g离心10 min,取出鱼糜凝胶,用滤纸吸去表面水分,再次称其质量 (m2)。持水性 (Warter holding capacity, WHC) 按公式 (1) 计算。
1.3.4 鱼糜凝胶色泽测定[14]
采用CR-400色彩色差仪对鱼糜凝胶的色泽进行测定。将样品切成3 mm高的圆柱,平衡至室温后,测定鱼糜凝胶的L*(亮度)、a*(红绿色度)、b*(黄蓝色度),并通过亨特白度值指数 (WH) 进行比较,WH按公式 (2) 计算,WH越大,表示样品越白。
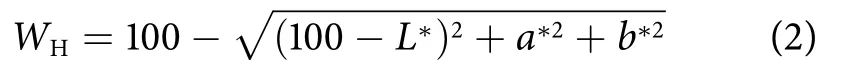
1.3.5 鱼糜凝胶质构特性测定[15]
采用CT3质构仪对鱼糜凝胶的质构特性进行测定,将样品切成2 cm高的圆柱体,置于样品平台上,选择TPA模式,使用T4圆柱探头(直径38.1 mm,高20 mm),测试速度1.0 mm·s-1,触发点载荷5 g,压缩比30%,记录鱼糜凝胶的硬度、内聚性、弹性和咀嚼性指标。
1.3.6 化学作用力测定
参考刘建华等[16]的方法,分别称取2 g鱼糜凝胶样品置于50 mL离心管中,分别加入10 mL不同的蛋白变性剂 (A:0.05 mol·L-1NaCl,B:0.6 mol·L-1NaCl,C:0.6 mol·L-1NaCl+1.5 mol·L-1尿素,D:0.6 mol·L-1NaCl+8 mol·L-1尿素,E:0.6 mol·L-1NaCl+8 mol·L-1尿素+0.05 mol·L-1β-巯基乙醇) 混合、均质,于4 ℃静置1 h,以10 000×g离心10 min,取上清液,用蛋白定量试剂盒测定各管中的蛋白质含量,各化学作用力以溶解在不同化学试剂中的蛋白质含量之差表示 (离子键:B与A之差;氢键:C与B之差;疏水键:D与C之差;二硫键:E与D之差)。
1.3.7 SDS-PAGE电泳分析
参考李学鹏等[17]的方法,略作修改。称取1 g鱼糜凝胶,加入10 mL质量分数5%的SDS溶液,用均质机以5 000 r·min-1均质2 min,在85 ℃下水浴1 h,冷却至室温,以2 000×g离心10 min,用SDS溶液将上清液蛋白浓度稀释到2 mg·mL-1,取上清液与2×SDS-PAGE样品缓冲液等体积混合,再在沸水浴中加热5 min。使用12%的Bis-Tris蛋白预制胶,上样量10 μL。电泳结束后用考马斯亮蓝R-250染色,再用脱色液 (含体积分数40%乙醇和10%乙酸) 脱色至条带清晰。
1.3.8 鱼糜凝胶微观结构观察
将鱼糜凝胶样品切成2 mm厚的薄片,用2.5%戊二醛固定24 h,然后依次用体积分数为30%、50%、70%、90%、100%的乙醇梯度脱水,最后冷冻干燥24 h。干燥的样品喷金后置于样品杯中,用扫描电镜观察其微观结构。
1.3.9 数据处理
采用Excel 2016、Origin 2018软件进行数据分析和绘图处理,每个处理做3个平行实验,结果以“平均值标准差 ()”表示。
2 结果与分析
2.1 CMA对鱼糜凝胶强度和持水性的影响
鱼糜制品的凝胶强度和持水性是评价鱼糜凝胶品质的主要指标,有研究发现亲水胶种类和添加量对鱼糜凝胶性能有明显不同的影响[18]。CMA对罗非鱼鱼糜凝胶强度和持水性产生了明显影响(图1)。随着CMA添加量的增加,鱼糜凝胶强度呈现先升高后降低的变化趋势:添加量介于0.5%~1.0%时,凝胶强度随添加量的增加而显著上升 (P<0.05);添加量介于1.0%~2.0%时,凝胶强度增加缓慢且无显著性差异 (P>0.05);添加量为2.0%时达最大值(594 g·cm),相较对照组 (348 g·cm) 提高了 70.7%;添加量增加到2.5%时,凝胶强度降至最低值 (356 g·cm)。鱼糜中少量添加CMA可提升凝胶强度,这可能与CMA吸水膨胀作用密切相关[19]。CMA具有较好的溶解性和吸水能力,在受热溶解后形成的凝胶会挤压填充到鱼糜凝胶网络中,从而提升鱼糜的凝胶强度。但是CMA添加过量则会产生团聚而结块,阻碍了鱼糜蛋白间的聚集和交联[20],从而降低鱼糜的凝胶强度。持水性可以表征鱼糜凝胶的保水能力,持水性越高,鱼糜凝胶质量越好。罗非鱼鱼糜WHC随CMA添加量的增加缓慢上升(图1):添加量<1%时,鱼糜WHC增加不显著 (P>0.05);添加量在1.5%~2.5%时,WHC由92.25%增至93.27%,显著大于对照组 (P<0.05)。鱼糜中添加CMA可以提高其持水性,是由于CMA与鱼糜蛋白发生交联作用或CMA自身形成三维网状结构而使水分子锁定其中[21-22]。
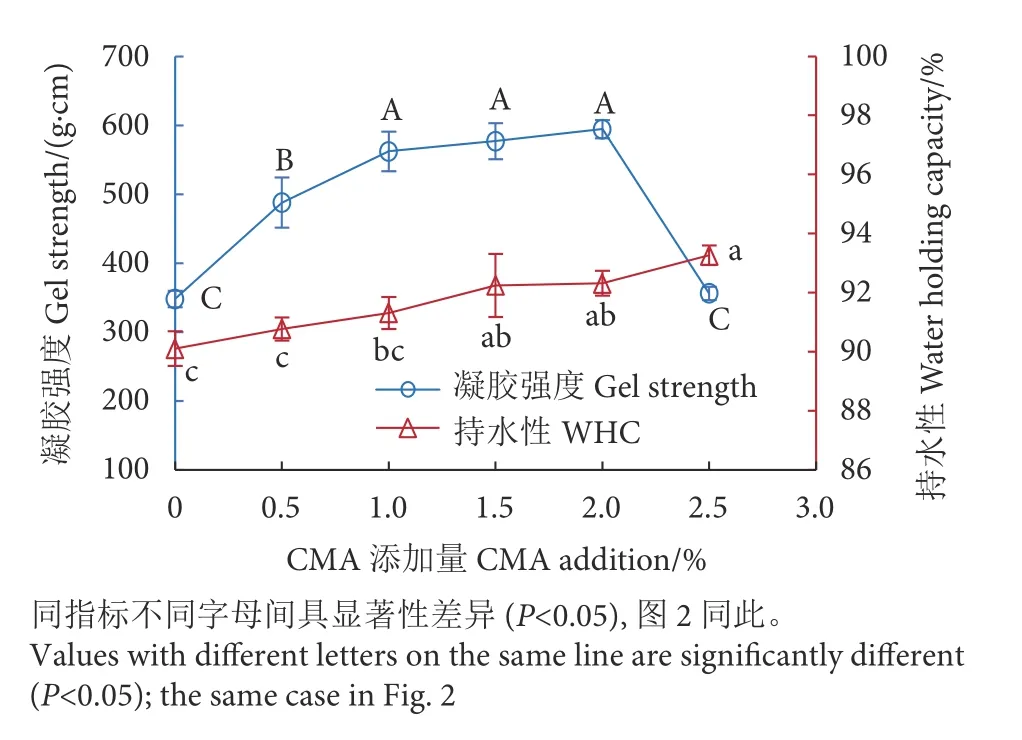
图1 羧甲基琼胶对鱼糜凝胶强度和持水性的影响Fig. 1 Effect of CMA on gel strength and water holding capacity of surimi
2.2 CMA对鱼糜凝胶质构特性的影响
CMA添加量对鱼糜凝胶的硬度、弹性、内聚性和咀嚼性4个质构指标的影响见表1。随着CMA添加量的增加,鱼糜凝胶硬度显著提高 (P<0.05),并在添加量为2.5%时达最大值 (4 505 g),相较对照组提高了78.7%,可能是因为CMA的填充效果对鱼糜凝胶结构起到一定的支撑作用。鱼糜弹性随CMA添加量的增加呈先上升后降低的趋势:添加量介于0%~1.5%时,弹性随添加量的增加显著升高 (P<0.05),在1.5%时达到最大值 (5.54 mm);添加量超过1.5%后,弹性显著降低 (P<0.05)。CMA添加量介于0~2.0%时,对鱼糜的内聚性无显著影响 (P>0.05),添加量为2.5%时内聚性显著降低 (P<0.05),表明鱼糜抵抗第二次压缩的能力减弱。鱼糜的咀嚼性呈现与弹性相似的变化趋势,随添加量的增加逐渐上升至最大值 (173.20 mJ),后又降至130.19 mJ。总的来说,鱼糜中添加CMA能改善其凝胶的质构特性,但过量添加则会影响其质构指标。因此,CMA在鱼糜中的应用应根据产品的特点和定位来选择合适的添加量,以满足消费者的感官体验。
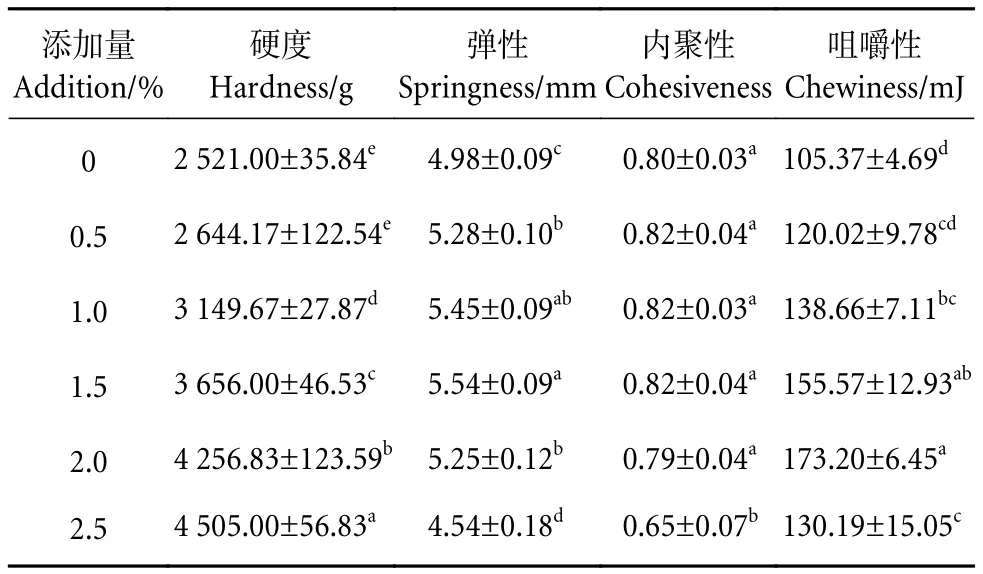
表1 羧甲基琼胶对鱼糜凝胶质构特性的影响Table 1 Effect of CMA on textural properties of surimi gels
2.3 CMA对鱼糜凝胶色泽的影响
鱼糜白度是消费者判断鱼糜制品品质最直观的依据,良好的色泽能增加消费者对产品的接受度[23]。CMA对鱼糜凝胶色泽的影响见表2。
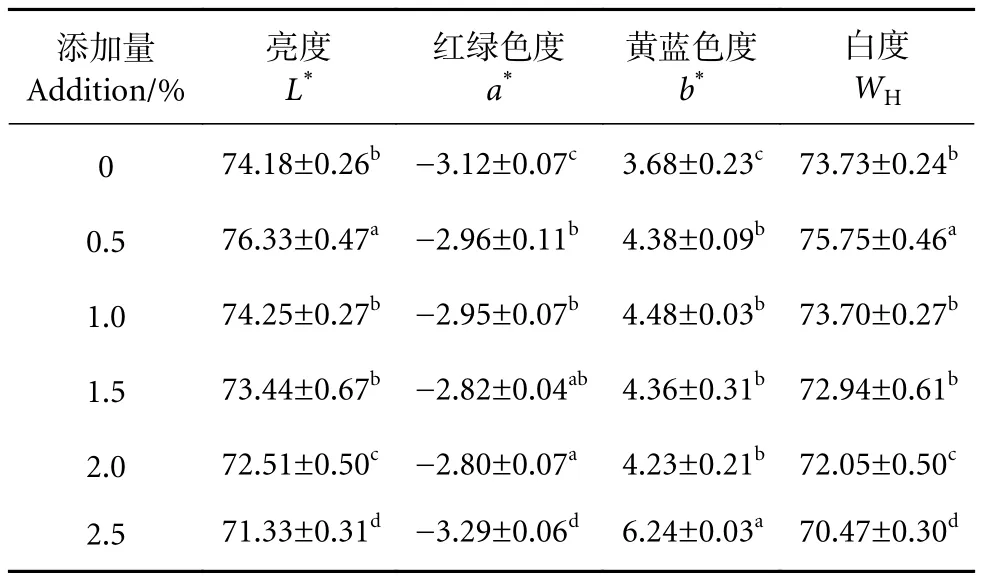
表2 羧甲基琼胶对鱼糜色泽的影响Table 2 Effect of CMA on color of surimi gels
对照组鱼糜凝胶WH为73.73,当CMA添加量为0.5%时,鱼糜凝胶的WH、L*、a*和b*均显著上升 (P<0.05),a*的变化幅度较小,说明低添加量的CMA对鱼糜凝胶的色泽有改善作用 (表2)。这可能是因为CMA形成的凝胶吸水溶胀,形成一种透明的胶粒,光线透射程度增加,使得鱼糜凝胶白度提高。但是,随着CMA添加量继续增大,鱼糜凝胶白度缓慢下降,当添加量达到2.5%时,鱼糜凝胶L*、a*和WH显著降低 (P<0.05),b*显著上升(P<0.05)。随着CMA添加量的增加凝胶白度降低,一方面是由于CMA自身颜色偏黄,另外也可能是因为部分CMA无法完全溶胀,凝胶透明度降低,照射到鱼糜凝胶表面的光折射程度增加,表现为凝胶白度降低。本研究中CMA对鱼糜凝胶色泽的影响与米洪波等[4]关于变性淀粉对鱼糜白度影响的结果相似,适量添加变性淀粉能够提高鲢 (Hypophthalmichthys molitrix) 鱼糜凝胶的白度,过量添加则会降低白度。
2.4 CMA对鱼糜凝胶蛋白化学作用的影响
蛋白质空间构象的稳定性主要由离子键、氢键、疏水作用、二硫键等化学作用力维持,鱼糜的凝胶特性很大程度上与这些作用力的大小有关[24]。研究表明鱼糜凝胶形成过程中离子键被破坏则蛋白质的交联程度提高[25]。疏水相互作用和二硫键对蛋白三维网络结构的影响最明显,直接关系到鱼糜凝胶强度的高低,而氢键则关系到鱼糜体系水分稳定性的强弱。
向鱼糜中添加不同量的CMA后,对鱼糜凝胶蛋白质化学作用力的影响显著 (P<0.05,图2)。鱼糜凝胶中的离子键显著下降 (P<0.05),说明CMA破坏了鱼糜中的离子键,促进蛋白质的交联,从而形成稳定的三维网络结构。CMA-鱼糜体系中离子键减少,可能是由于CMA的添加影响了蛋白质间离子键的形成,促进了凝胶的形成[26]。氢键是鱼糜保持良好持水性的关键作用力,并可在鱼糜凝胶形成过程中提高凝胶强度[16]。CMA的添加显著增加了鱼糜的氢键含量 (P<0.05),可改善鱼糜凝胶的持水性和胶凝作用。鱼糜在加热时,蛋白分子展开而使其疏水位点显露在水环境中,为了维持体系的稳定性,蛋白质之间的疏水作用增强,从而导致蛋白质聚集,有利于形成网络结构[26-27]。在CMA-鱼糜凝胶体系中,疏水相互作用显著增加 (P<0.05),并且其含量最高,表明它在鱼糜化学作用力中占主要作用,这可能是因为CMA-水的相互作用改变了蛋白质周围的水环境,从而增强了凝胶体系的疏水作用。二硫键是促进蛋白质凝胶形成三维网状结构的主要化学作用力[28],当CMA添加量为0.5%时,鱼糜凝胶中二硫键的含量显著增加 (P<0.05),添加量继续增加,二硫键变化不显著 (P>0.05)。CMA添加于罗非鱼鱼糜中,其化学键作用大小为疏水相互作用>二硫键>氢键>离子键。
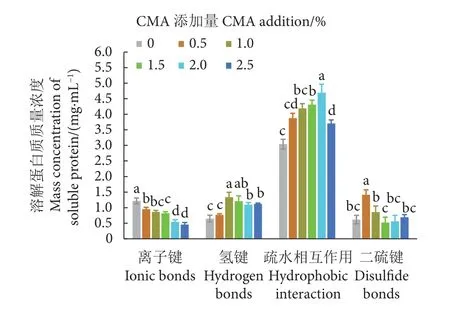
图2 羧甲基琼胶对鱼糜蛋白化学作用力的影响Fig. 2 Effect of CMA on chemical force of surimi
2.5 CMA对鱼糜蛋白组成的影响
SDS-PAGE电泳分子筛能根据样品中蛋白质分子量不同,使其在电泳胶中得到分离,可用电泳条带深浅表示蛋白含量高低[29-30]。罗非鱼鱼糜蛋白在SDS-PAGE图谱中主要呈现肌动蛋白 (Actin) 和肌球蛋白重链 (Myosin heavy chain, MHC) (图3)。一般来说,鱼糜凝胶形成过程中,MHC之间的相互交联起主要作用,MHC交联程度越高,鱼糜凝胶能力越强[31]。MHC交联作用形成的聚集体无法进入分离胶,因此在SDS-PAGE图谱表现出颜色很浅的MHC条带。随着CMA添加量的增加,MHC条带相对于对照组发生轻微上移,说明CMA的存在促进了MHC之间的相互交联,且其相对含量越高则MHC发生交联的程度越充分 (图3)。Actin条带随着CMA添加量的增加呈现先变深后变浅的趋势,说明CMA一定程度上参与了Actin的交联作用,影响了鱼糜蛋白的热聚集行为,但是CMA中哪个基团起作用有待进一步研究。Arsyad等[32]研究发现,添加不同质量的橄榄叶粉到热诱导鱼糜凝胶中会对蛋白的聚集行为产生不同影响,适量添加橄榄叶粉会使MHC条带变浅,这是MHC之间非二硫共价键形成的结果,但是过量的橄榄叶粉则会使Actin条带强度减弱,影响鱼糜凝胶结构的形成,这与本研究结果相似。
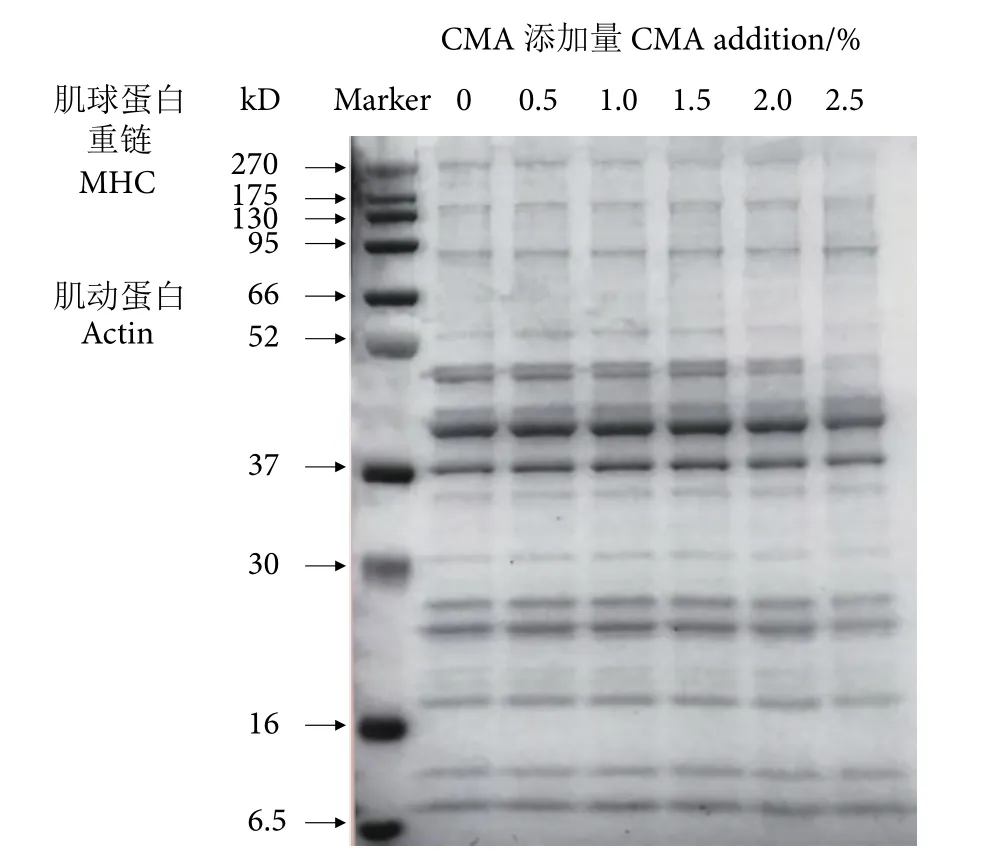
图3 羧甲基琼胶对鱼糜蛋白组成的影响Fig. 3 Effect of CMA on protein composition of surimi
2.6 羧甲基琼胶对鱼糜微观结构的影响
CMA-罗非鱼鱼糜凝胶的电镜扫描图 (图4) 反映出CMA对罗非鱼鱼糜凝胶微观结构的影响。对照组鱼糜凝胶出现大量分布不均匀的孔洞和裂缝,凝胶网络结构较疏松,蛋白聚集体的表面积较大。添加CMA后,鱼糜凝胶的微观结构出现明显差异。相较对照组,添加0.5%的CMA鱼糜凝胶中蛋白聚集体开始减少,网络结构更加紧密;添加量为1.5%时,形成的鱼糜凝胶结构最均匀致密,孔洞和蛋白聚集体表面积明显减小;添加量增加到2.0%时,凝胶开始出现和对照组类似的疏松且多孔的网络结构,但蛋白聚集体表面积仍小于对照组;添加量增至2.5%时出现相似的情况,表明过量添加CMA不利于鱼糜凝胶的形成,适量添加才可提高鱼糜的凝胶性能。这可能是因为CMA的亲水性和凝胶性对蛋白凝胶结构发挥了积极作用;另外负电荷基团的存在有利于CMA的延展,空间阻碍作用增大,当其填充于凝胶网络结构中,能促进蛋白分子间的交联,从而形成更加致密、稳定的网络结构[33];但是随着添加量的增加,鱼糜凝胶结构呈现由致密均匀向疏松粗糙的趋势变化,这是因为过量的CMA所带的游离羟基占据了氢键位点,阻碍了凝胶网络结构的形成[34]。Zheng等[35]研究发现,鱼糜中的岩藻糖添加量超过0.5%时,鱼糜形成的凝胶网络孔隙更疏松,更不均匀,表面更粗糙,而鱼糜凝胶强度的降低正与这种微观结构的形成有关。

图4 羧甲基琼胶对鱼糜微观结构的影响 (10 000×)Fig. 4 Effect of CMA on microstructure of surimi (10 000×)
3 结论
本研究在罗非鱼鱼糜中添加CMA,通过测定鱼糜凝胶的理化性质、质构特性、化学作用力和微观结构等指标,研究了CMA对罗非鱼鱼糜凝胶性能的影响。结果表明,CMA添加量介于0.5%~2.0%时对鱼糜凝胶强度有显著影响,最高提升幅度达70.7%;添加量为1.5%~2.0%时CMA对鱼糜凝胶弹性、内聚性和咀嚼性等质构指标表现出显著的改善效果;添加CMA后鱼糜的持水性有所增强,白度仅在添加量为0.5%时有显著提高;CMA对鱼糜蛋白化学作用力产生了较大影响,通过破坏鱼糜蛋白的离子键,增强了氢键和蛋白间的疏水相互作用,促进了鱼糜蛋白的聚集和交联;CMA促进了MHC之间的相互交联,且交联程度与添加量呈正相关;添加1.5% CMA可使鱼糜凝胶形成均匀、致密的网络结构,表现出良好的凝胶性能。总之,在鱼糜中添加适量的CMA (1.0%~1.5%)可显著改变鱼糜的凝胶强度、质构特性、化学作用力、蛋白交联作用和凝胶网络结构,增强鱼糜的凝胶性能,CMA有望在鱼糜加工中成为一种新型凝胶改良剂。
