轨道杂化的有关问题释疑
2022-04-21王笃年正高级教师
王笃年正高级教师
(北京十一学校)
杂化轨道理论虽然难以用来预测分子或离子结构,但它在解释分子和离子结构方面具有不可替代的独特价值.把价层电子对互斥理论(VSEPR)与杂化轨道理论有机结合,可以帮助我们更好地理解物质结构的有关知识.
问题1如何判断分子内的原子发生了怎样的杂化?
原子发生了何种杂化,需要根据其价层电子对的多少和空间排布形式进行判断.一般认为它们有如表1所示对应关系.
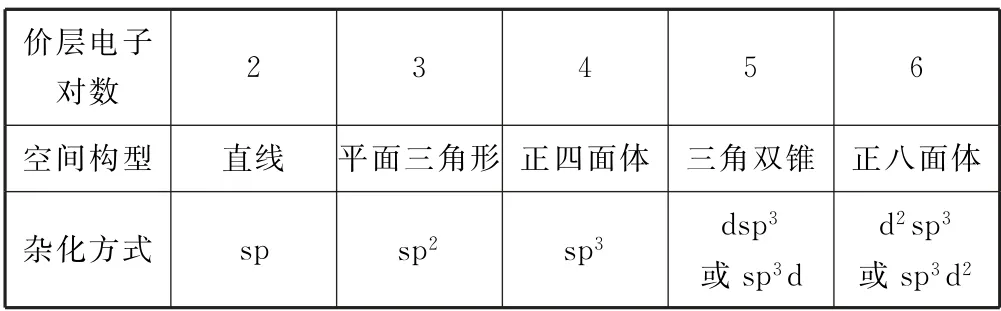
表1
问题2sp、sp2、sp3杂化轨道看“模样”差不多,它们到底有何不同?
轨道杂化,可以认为是同一原子内部能量接近、但形状不同(同一能级组或者同一能层)的原子轨道之间的重新整合.杂化后所得的新轨道,从形状到能量,都可看作是参与杂化的轨道的平均化.
不管sp、sp2、sp3中的哪一种杂化轨道,它们均应该既具有s轨道的形状,又具有p轨道的形状,于是形成了以核为中心的一头大、一头小的近似纺锤形(保有p轨道形状).杂化轨道用电子云密度较大的一端(保有s轨道形状)去和其他原子的轨道重叠成键,这样有利于轨道间重叠程度增大,所成的键更加牢固.
sp、sp2、sp3杂化轨道,分别单看的话,它们很相似,如果把同一原子(比如碳原子)的sp、sp2、sp3杂化轨道摆在一起看,则有如图1所示的不同.

图1
可以看到,从sp杂化轨道到sp3杂化轨道,其长度随着参与杂化p轨道成分的增多而增大,所以,sp3杂化轨道与H 原子形成的σ键,比sp2杂化轨道与H原子所成的σ 键要略弱(因为键长略大),乙烷(CH3—CH3)中C—H 单键的键长0.110nm、键能420kJ·mol-1,而乙烯(CH2==CH2)中C—H 单键的键长为0.108nm、键能为465kJ·mol-1.这种差异在性质方面的表现是:甲烷可以与Cl2、Br2等在一定条件下发生取代反应,而乙烯的H 原子则在相同条件下较难被Cl2、Br2取代.
问题3dsp3与d2sp3是什么意思,与sp3d 及sp3d2有何不同?
我们知道,(n-1)d、ns、np同属于1个能级组,3个能级的轨道能量接近;而ns、np、nd同属于1个能层,这3个能级的轨道能量也接近.故可能发生3个能级一起杂化的情况.如dsp3即指用1 个(n-1)d 轨道、1个ns轨道以及np的全部3个轨道一起杂化;而sp3d则是指用最外层的ns轨道、np的全部3个轨道与nd的1个轨道一起杂化.
dsp3和sp3d杂化轨道的形状相同,均为三角双锥形,只是大小不同.如果是同一个原子,用dsp3杂化轨道所成的键,键长要小于用sp3d所成的键,稳定性当然也就不同,前者更稳定.
sp3d或dsp3、sp3d2或d2sp3杂化轨道的空间指向示意图如图2所示.
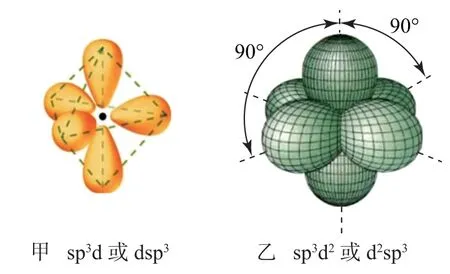
图2
同理,d2sp3与sp3d2杂化轨道均为正八面体,前者键长短后者略长,前者形成的键更稳定.
在配位化学中,用dsp3、d2sp3杂化轨道所形成的配合物称为“内轨型配合物”,性质较稳定;而用sp3d与sp3d2杂化轨道所形成的配合物称为“外轨型配合物”,性质不够稳定.
问题4有dsp2杂化,为什么没有sp2d杂化?
前边提到,能量接近的轨道才会发生杂化.(n-1)d、ns、np是同一能级组的轨道,它们可以相互杂化,ns、np、nd轨道同属于一个能层,当然也可以一起杂化成键.
在能量相对较低的np轨道没有用完的情况下,不可能采用能级更高的nd轨道成键,那样就违反了能量最低原理.所以,在内层的(n-1)d轨道不参与成键的情况下,如果需要4个轨道,只会是sp3杂化,不可能发生sp2d杂化.
(完)
