基于网络药理学研究金铃子散治疗乳腺癌作用机制
2022-04-21张丽宏王丽娟王业秋安丽凤黄敬文
张丽宏,王 茜,王丽娟,王业秋,安丽凤*,杨 柳,薛 慧,黄敬文
(1.黑龙江中医药大学 佳木斯学院,黑龙江 佳木斯 154002; 2.黑龙江省眼科医院,黑龙江 哈尔滨 150007)
乳腺癌是一种严重威胁女性健康,发生在乳腺上皮组织中的恶性肿瘤[1]。据流行病学显示,女性一生中患乳腺癌的概率为12.3%,近年来中国乳腺癌疾病患病率呈现上升趋势[2]。目前乳腺癌的治疗以西医治疗为主,只在术前防治和术后恢复阶段通过中医进行个体化治疗,以提高患者的生活质量。乳腺癌的中医名称为“乳岩”,中医认为该病多因情志因素致病,且与肝脏密切相关。肝郁气滞是乳腺疾病的共有病因,其中肝郁化火为乳腺癌术前常见证型之一[3-4],故其治疗重在疏肝行气。
金铃子散中两味主药皆入肝经,川楝子长于疏肝泻火;延胡索活血行气止痛,善行血中气滞、气中血滞,从而专治一身上下之疼痛。临床上常用该方治疗肝气久郁化火所致的乳腺癌术前疼痛,效果较好。已有研究证实金铃子散的活性成分川楝素、延胡乙素、小檗碱等有抗癌作用,不过其治疗乳腺癌的作用机理尚未明确[5]。
本研究通过网络药理学,应用各种数据库对药物-成分-靶点网络进行可视化和富集分析,探究金铃子散治疗乳腺癌的作用机制,为后期动物实验和临床研究提供参考依据,以发挥金铃子散改善乳腺癌患者生存质量及防治乳腺癌的作用。
1 材料与方法
1.1 金铃子散有效成分及作用靶点收集
从TCMSP(https://tcmspw.com/tcmsp.php)平台检索出川楝子、延胡索的化学成分,按照口服生物利用度(OB)≥30%和类药性(DL)≥0.18的要求,并结合相关文献选出有效成分,同时应用TCMSP收集各活性成分作用的靶标蛋白[6-7]。运用Uniprot(http://www.uniprot.org)数据库及Perl(https://www.perl.org/ger.html/)语言脚本将收集的靶点进行基因注释,得到活性成分ID、活性成分名称及靶基因名称等数据。
1.2 乳腺癌相关靶点收集
通过GeneCards(https://www.genecards.org/)在线数据库搜索乳腺癌的关键词“Breast Cancer”,得到乳腺癌的靶点。
1.3 构建中药-活性成分-疾病靶点可视化网络
将金铃子散活性成分作用靶点去重后,应用Venny2.1(http://bioinfogp.cnb.csic.es/tools/ v-enny/index.html)网络分析工具,将金铃子散与乳腺癌靶点上传取交集。其交集结果是金铃子散治疗乳腺癌的潜在靶点,可进一步明确并预测两者间的相互作用。使用Cytoscape3.7.0(http://cytoscapeweb.cytoscape.org/)软件,构建出“中药-化合物-疾病靶点”网络。最后运用Cytoscape插件CytoNCA分析潜在靶点的度中心性(DC),得到核心靶点。
1.4 构建蛋白互作(PPI)网络
在功能蛋白联系网络STRING(https://string-db.org/)数据库中,利用“1.3”项中筛选出的共同靶蛋白得到蛋白质相互作用网络模型。
1.5 金铃子散治疗乳腺癌的GO和KEGG注释
为了进一步探究金铃子散治疗乳腺癌过程中靶标蛋白的通路及生物过程,运用DAVID6.8(https://david.ncifcrf.gov/)在线工具进行GO功能注释。GO又称基因本体数据库,包括细胞组分(GO-CC)、分子功能(GO-MF)、生物学途径(GO-BP),从不同层面上描述了基因产物的位置、功能及参与的细胞生长、分化、信号转导等过程。运用Bioconductor(http://bioconductor.org/packages/releade.bioc/)和R×64 3.6.1(https://www.r·project.org/)计算机语言软件对潜在靶基因进行KEGG富集分析。KEGG是用来分析基因产物在细胞中代谢通路的数据库,从富集结果通路图中能预测金铃子散治疗乳腺癌的作用机制。
2 结果
2.1 金铃子散活性成分的筛选
从TCMSP平台中收集了110 个化学成分,其中川楝子33 个,延胡索77个。口服中药治疗疾病时药物进入体内后要经过ADME过程,其中OB和 DL两个指标对确定中药成分是否具有活性进而影响机体有重要参考价值。以OB≥30%、DL≥0.18 为筛选条件,共筛选活性成分川楝子9个,延胡索49个。其中川楝子的化合物川楝素OB值较低,但经过文献查询川楝素是重要的活性成分,故纳入研究[8]。去重后一共有58个成分符合条件,见表1。

表1 TCMCP中筛选的活性成分
2.2 乳腺癌靶点筛选
通过 GeenCards 数据库(截至2021年5月1日)得到乳腺癌相关靶标14 310个,通过筛选设置 relevance score≥20,最终获得 1 088个相关靶点。
2.3 药物治疗乳腺癌的潜在靶点
通过TCMSP收集到金铃子散活性成分作用的非重复靶点共208个,应用 Venn 2.1软件将上述靶点与乳腺癌对应的1 088个疾病靶点取交集,共得到107个共同靶点,见图1。借助Cytoscape 3.7.0软件构建出金铃子散-活性成分-靶点-乳腺癌网络图,见图2。图中共有102个节点(Nodes)表示作用靶点,有1 267条边(Edges)表示节点之间的关系。
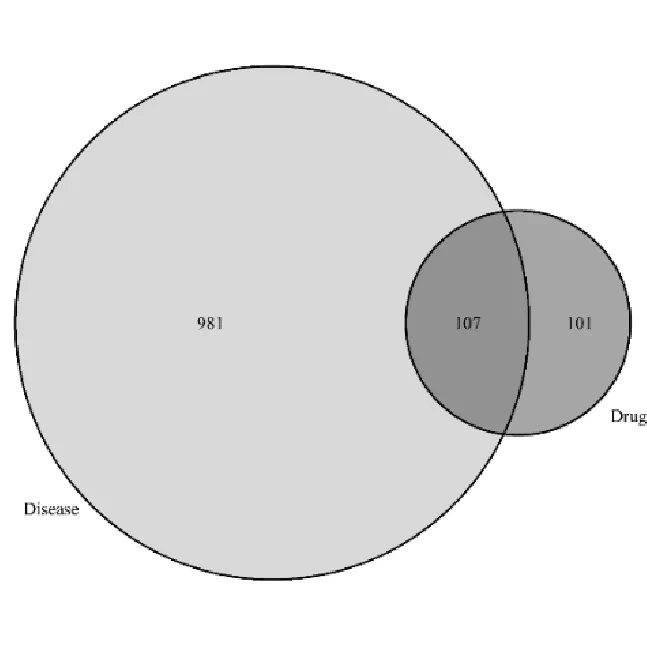
图1 金铃子散有效成分靶点和乳腺癌相关靶点的韦恩图

图2 “金铃子散-靶点-乳腺癌”可视化网络
2.4 PPI网络图
通过网页搜索STRING在线数据库,上传交集靶点,物种选择Homo sapiens,置信度设置为>0.4,选择所有渠道,最终获得1个107个节点、1 951条边的PPI网络图,见图3。度中心性(DC)表示的节点中心性可以衡量一个节点在网络中的重要程度。运用CytoNCA 插件分析,可得到拓扑学指标Degree 值,其中前10位分别是蛋白激酶 B(AKT1)、雌激素受体(ESR1)、血管内皮生长因子A(VEGFA)、CASP3、转录因子AP-1(JUN)、Myc原癌基因蛋白(MYC)、表皮生长因子受体(EGFR)、促分裂素原活化蛋白激酶(MAPK1)、白细胞介素 6(IL-6)、G1/S特异性细胞周期蛋白-D1(CCND1),见图4,这些基因作为网络调控核心基因在药物治疗疾病的过程中发挥重要作用。
注:圆形代表潜在靶基因,圆形中不规则结构代表蛋白结构,连线代表靶基因相互关系的不同证据。
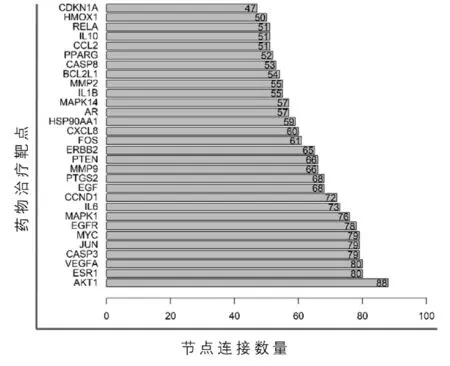
图4 金铃子散治疗乳腺癌的关键靶点
2.5 靶点GO分析
使用DAVID 6.8在线数据库上传交集靶点,进行GO功能注释,GO条目显示(FDR<0.05),包括521个BP条目、49个CC条目、101个MF条目。表2、表3、表4是FDR由小到大排名前10的BP、MF和CC条目(Trem)。其中BP富集结果表明,靶点主要参与药物应答、凋亡过程的负调控、RNA聚合酶II启动子的转录正调控、DNA模板转录的正调控、血管生成的正调控、血管生成、老化、雌二醇应答等生物过程;在MF富集结果显示靶点涉及酶结合、相同蛋白结合、蛋白结合、转录因子结合、蛋白质二聚体化活性、蛋白质异源二聚体化活性等分子功能;CC富集结果表明靶点的细胞功能主要作用于细胞外间隙、细胞溶质、核质、细胞核。
2.6 靶点KEGG分析
使用Bioconductor和R计算机语言对交集靶点进行KEGG注释。KEGG富集结果按P值(P<0.05)由小到大排序后取前25个条目作图,如图5所示。气泡颜色越黑,代表基因统计学显著性越高;气泡越大,通路富集条数越多。主要涉及:①与肿瘤疾病类相关通路,包括乳腺癌、胰腺癌、膀胱癌等;②与炎症有关通路,包括IL-17信号通路、丙型肝炎、乙型肝炎等;③与感染相关疾病类通路,包括卡波西肉瘤相关疱疹病毒感染、人巨细胞病毒感染、弓形虫病、恰加斯病等;④还有一些信号转导通路,包括AGE-RAGE信号通路、PI3K-AKT信号通路、EGFR酪氨酸激酶抑制剂抵抗、TNF信号通路等,其中PI3K-AKT信号通路与乳腺癌的治疗关系最密切。见图5。

表2 药物治疗疾病参与的生物过程(BP)

表3 药物治疗疾病参与的分子功能(MF)

表4 药物治疗疾病参与的细胞组分(CC)
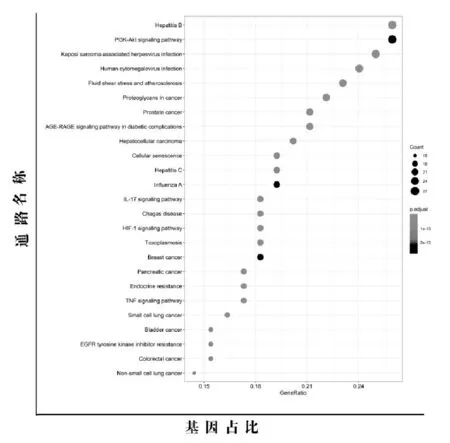
图5 KEGG富集分析气泡图
3 讨论
中医药作为乳腺癌术前防治以及术后恢复的一种辅助疗法,根据辨证论治的原则实现个体化治疗,通过调理人体阴阳平衡,扶助正气以达到治疗效果。金铃子散首载于金代刘河间著《素问·病机气宜保命集》,现代药理学研究表明金铃子散有抗炎和镇痛等作用,对于癌症的治疗也有一定疗效[9-11]。既往研究发现,川楝子中的主要代表成分川楝素(Toosendanin)可通过调节PKM2,发挥抑制乳腺癌糖酵解的作用,从而抑制细胞增殖,并且能够阻滞人乳腺癌细胞的S期,诱发其早期凋亡[12-13]。延胡索乙素具有镇痛作用,是延胡索的重要有效成分。研究发现延胡索乙素可以抑制肿瘤细胞内P-糖蛋白的过量表达,逆转肿瘤的多药耐药[14]。槲皮素(Quercetin)为川楝子与延胡索的共有活性成分,通过对药物-疾病的拓扑学分析发现,其自由度最大,为网络核心成分。有研究表明槲皮素可以通过增加ERα表达来发挥雌激素样作用,从而抑制乳腺癌细胞的增生[15];还可通过抑制 EGFR/AKT 信号通路,促进乳腺癌细胞的凋亡、抑制 HIF-1生成、减少VEGF分泌、抑制肿瘤血管生成[16-17]。另一项研究发现槲皮素可通过下调EGFR、AKT、mTOR蛋白相对表达,上调Capase9 mRNA和蛋白相对表达抑制人乳腺癌细胞生长,阻断其细胞迁移、运动及侵袭[18-19]。不难发现,本研究中筛选出金铃子散的有效活性成分对乳腺癌的治疗都有研究证据。
GO富集分析表明金铃子散对分子功能的抗氧化、信号转导及细胞因子活化、血管生成、细胞增殖凋亡、免疫等生物学过程有一定影响,这些生物学过程和分子功能在药物治疗疾病所涉及的核心靶点及其相关通路中都有体现。PPI网络互作蛋白分析显示AKT1、ESR1、VEGFA、CASP3、JUN为其核心靶点。在PI3K/AKT通路中,其上游成员ERα和HER-2在乳腺癌生成中具有重要作用,而雌激素可通过增加宿主血管生成和骨髓基质细胞的募集来刺激雌激素受体(ESR1),促进乳腺癌细胞的生长[20]。EGFR与配体结合后,可以通过VEGF等细胞因子水平的上调增加肿瘤细胞的血供,提高血管通透性为肿瘤提供营养[21]。EGFR受体与相关受体(HER-2)结合后可激活MAPK参与肿瘤细胞的分化、增殖[22]。凋亡的异常减少是肿瘤发生的重要原因,CASP3则是细胞凋亡的可靠标志[23]。通过上述分析发现,这些疾病-药物的核心靶点可以影响肿瘤细胞的生长、凋亡和血管的生成,说明金铃子散可通过这些靶点发挥抗乳腺癌的作用。
此研究所得到的KEGG通路富集涉及肿瘤疾病的相关通路、炎症相关通路和信号转导通路等,这些通路中PI3K/AKT通路富集结果尤为显著,并且该条信号通路在乳腺癌中有高频率失调,失调可高达70%[24]。PI3K/AKT 信号通路参与了细胞增殖、分化、凋亡和糖酵解等多种功能。通路图中显示(图6),细胞受上游生长因子(GF)、RTK等刺激后,激活1A型PI3K,使得PIP2磷酸化为PIP3,PIP3 再激活诸多下游蛋白。该通路负反馈作用由PTEN(磷酸酶-张力蛋白抑癌基因)调节,通过降解PIP3以阻断AKT及其下游效应分子的活化[25]。PIP3与下游效应分子 AKT的PH区结合募集激活AKT,活化后磷酸化其下游靶蛋白Bad、Caspase-9、IKK/NF-κB、eNOS、FOXOS、p21等,影响肿瘤细胞的增殖、凋亡及迁移作用。据报道游离的Bcl-2具有抗凋亡作用,通过AKT的活化使促凋亡蛋白Bad与抑凋亡蛋白Bcl-2 或Bcl-xl解聚,从而抑制细胞凋亡,使肿瘤细胞存活[26]。金铃子散干预乳腺癌后,激活的AKT通过抑制caspase-9、Bcl-2 和Bcl-xl的磷酸化,从而促进细胞凋亡。通过抑制FOXO-1 的磷酸化来抑制G1/S特异性细胞周期蛋白-D1(CCND1)的表达,使细胞在G1/S期时停止分化,从而阻止了肿瘤细胞的继续增殖,这些分析证实了MAEKAWA 等[27]的研究。PI3K 信号通路的异常激活还可进一步影响诸多下游通路,如IKK/NF-κB通路,此通路也是调控细胞生存、增殖和凋亡反应中的重要信号转导通路。AKT激活抑制因子 I-κB 激酶(IKK)发生磷酸化,使得转录因子NF-κB 得以释放发挥作用,阻碍抑凋亡蛋白Bcl-x的表达,最终促使细胞凋亡[28]。PI3K/AKT信号通路图说明了金铃子散通过一系列不同靶点途径激活或者抑制乳腺癌发生机制中的相关靶基因,从而促进细胞凋亡,抑制血管生成及细胞增殖以发挥防治乳腺癌的作用。
应用网络药理学预测金铃子散治疗乳腺癌的关键靶点,这些靶点通过一系列通路发挥分子功能参与了多种生物的抑癌过程,其中PI3K/AKT信号转导通路很可能是其干预的关键通路。但是纯理论探讨有其局限性,需结合动物实验与临床研究进一步验证有效成分及靶标的作用机制,以期通过中医辨证使用金铃子散,为临床提供一种治疗乳腺癌术前和术后恢复的有效方法。

注:黑色方块代表在整个调控网络中相关的基因和酶,说明金铃子散可能通过这些靶点在该条通路作用于乳腺癌。
