多孔碳包覆氧化硅的制备及电化学性能研究
2022-04-21梁道伟丁旭丽赵洪达MUHAMMADHassan
梁道伟,丁旭丽,赵洪达,MUHAMMAD Hassan
(江苏科技大学 理学院,镇江 212100)
锂离子电池作为长寿命、高比容量和环境友好的储能器件已经受到了人们的广泛关注[1-5].在过去的几十年间由于锂离子电池被广泛应用于工业、消费电子产品、新能源汽车和日常生活等[3-5],使锂离子电池的研究得到了蓬勃发展.目前传统的商业化锂离子电池主要是以石墨作为负极材料,其理论比容量为372 mA·h·g-1(Li6C)[6-9],已远不能满足逐渐增长的动力电池和便携电子器件对电池能量密度的需要[8],因此寻找可以代替商业化石墨具有更高能量密度,安全经济的锂离子电池负极材料成为一项重要意义的研究工作[7-10].
硅(Si)被认为是最有希望替代石墨作为锂离子电池负极材料的候选之一[11].Si在作为锂离子电池负极材料时Si 原子与Li+产生合金化反应,理论比容量可达4 200 mA·h·g-1(Li4.4Si)[11-14],是石墨负极材料理论比容量的10倍.同时,Si具有较低的电化学嵌锂电位(0.3~0.4 V)、环境友好以及无锂枝晶析出等优势使Si成为具有发展潜力的下一代高比能锂离子电池负极材料[14-16].尽管如此,Si也存在着亟待解决的难题.Si作为锂离子电池负极材料时会产生不稳定的固相电解质膜(SEI)以及在充放电过程中由于硅锂合金的生成往往会伴随着300%的体积膨胀等问题[15-20].而这些问题往往会导致锂离子电池电解液中有限的Li+被消耗,导致低库伦效率以及活性材料的破裂从而使得活性材料从集流体上脱落造成电池内阻不断增大等问题[21].对于这些问题科研工作者们主要是从材料的设计[22]、粘结剂[23]以及电解液[24]等方面进行改进,从而获得更高的电化学性能.
二氧化硅(SiO2)作为硅的氧化物来源十分广泛,其主要存在于岩石、沙砾和硅酸盐中,被广泛应用于玻璃行业和电子工业中[25-26].在已有的报道中表明SiO2用于锂离子电池负极材料时,理论比容量可达1 965 mA·h·g-1[27-28],超越大多数传统的锂离子电池负极材料,是十分理想下一代高比能锂离子电池负极材料候选之一.但是在实际应用中SiO2的表现往往不如预期结果,其主要原因在于SiO2电导率低,导致锂离子脱嵌过程中不可逆程度增大,从而降低其首次库伦效率[28-30].为了改善材料的导电性能,同时缩短锂离子在活性材料的迁移距离,文中采用冷冻干燥法进行材料制备.冷冻干燥法可以将复合材料制备成具有分级的多孔结构,可以缩短锂离子在活性材料中的迁移距离以及较好的保持原物质的物理性质,同时所制备的多孔结构可以为活性材料的体积膨胀提供缓冲空间,且该方法操作简单,是较为常用的材料合成手段.文中采用具有天然多孔结构的SiO2通过冷冻干燥法可以合成具有分级多孔结构的多孔碳(Pc)包覆SiO2复合材料,其作为锂离子电池负极材料时,在充/放电测试中显示出良好的电化学性能.
1 实验部分
1.1 材料的制备
多孔碳包覆SiO2复合材料的制备(SiO2@Pc):图1为SiO2@Pc的制备过程示意.取硅藻土(主要成分为多孔的SiO2,325目,购自国药集团化学试剂有限公司)放在球磨罐中球磨10 h(钢球与物料的质量比为10∶1)之后将硅藻土分散在含有葡萄糖和聚乙烯吡咯烷酮(PVP)的水溶液然后将其放置于超声清洗机中超声20 min,水溶液按10 ml去离子水中溶解1~2 g的葡萄糖与PVP配成不同浓度的碳源溶液,溶液在室温下磁力搅拌2 h后,将悬浮液放置于冷冻干燥机中进行冷冻干燥60 h,然后将样品转移至管式炉中在Ar/H2混合气氛中(Ar占95%,H2占5%)500 ℃下高温碳化3 h.该实验中SiO2与碳源的比例为质量比1∶1,1∶2和1∶3.

图1 SiO2@Pc的制备过程示意
1.2 材料结构及形貌表征
采用X-射线衍射仪(XRD)对样品的物相和微结构进行测定(日本岛津:XRD-6000,Cu-Kα辐射,0.154 06 nm),测定角度在10°~80°,扫描速率为10° min-1.采用扫描电子显微镜(SEM,日本JEOL JSM-7001F)对样品进行形貌表征.采用热分析技术(TG,美国Pyris Diamond TG-DTA)对样品成分进行了估算,利用X射线光电子能谱(XPS)对样品所含元素及价态进行了表征.
1.3 电极的制备及电化学性能表征
为了对复合材料的电化学性能进行表征,对合成的复合材料进行电池组装,将制备好的SiO2@Pc复合材料与Super-P及海藻酸钠粘结剂按质量比7∶1.5∶1.5称取进行充分混合研磨后将浆料涂布于铜箔上, 在50℃的烘箱中干燥12 h后进行切片组装,工作电极的直径为10 mm.电池组装是在含氧和含水量远低于1.0 PPM氩气保护的手套箱中进行的,对电极采用的是直径为16 mm的锂箔,隔膜为Celgard 2325, 电池外壳为2032型不锈钢,实验中采用的电解液是LiPF6作为溶质溶解于体积比为1∶1的碳酸乙烯酯(EC)和碳酸二乙酯(DEC)的混合溶液中,溶液浓度为1 mol·L-1.
将制备好的电池在室温下静置8 h后进行电化学性能测试,利用DH7001电化学工作站进行循环伏安测试(CV)和电化学阻抗谱测试(EIS),测试电压范围为0.01~3 V,扫描速率为0.1~0.5 mV·s-1,EIS频率范围为1MHz~0.1Hz.电池充/放电循环测试测试采用深圳新威测试仪(NEWARE),测试电压范围为0.005~1.50 V.
2 结果与讨论
2.1 SiO2@Pc的材料表征
采用扫描电子显微镜(SEM)表征了样品的形貌.如图2(a、b)所示,原始的SiO2呈现出向日葵型的多孔状结构,其尺寸大小在30~40 um,在SiO2的表面分布着较为均匀的孔洞,孔洞尺寸在100~600 nm.图2(c、e)是不同放大倍率下SiO2@Pc的SEM图,由测试结果可知,球磨后的SiO2保持了良好的多孔性,其尺寸在10 um左右.此种结构设计的主要目的在于Pc和SiO2的多孔状结构可以缩短锂离子在电极材料中的迁移距离,增强复合材料的电化学活性,在嵌锂/脱锂过程中,分级多孔结构和碳骨架协同作用可以为活性材料的体积膨胀提供良好的应变空间,改善了电池的循环寿命.
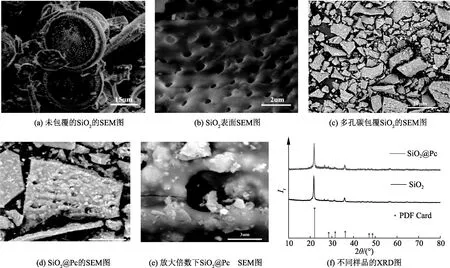
图2 未包覆SiO2及多孔碳包覆的SiO2@Pc 不同放大倍数SEM图及XRD谱图
图2(f)是SiO2@Pc与硅藻土的XRD图,由测试结果可知硅藻土的成分为SiO2.而SiO2@Pc在21.9°和36°出现明显的尖峰,在25.3°、28.4°、31.4°、57.6°位置出现峰值相对较弱,与SiO2标准的JCPSC卡片的对比这些峰都对应着SiO2的特征峰[31].可以看出,SiO2@Pc与原始的SiO2的XRD谱中的SiO2的特征峰均未发生明显变化.
为了测定SiO2@Pc复合材料中碳所占比例,采用热重分析(TG)进一步对样品进行分析.图3(a)是SiO2@Pc在不同比例下的TG分析图,在385~460℃曲线迅速下降,这是由于SiO2@Pc样品中的碳与空气中的氧发生反应形成CO2的过程[32],由测试结果可以看出不同样品中碳所占比重分别为14.6%、23.1%和26.7%.采用拉曼光谱(Raman)对复合材料中碳的形态进行表征,图3(b)是SiO2@Pc的Raman光谱图,由图可以看出在1 357cm-1和1 591cm-1处[33]出现的波峰对应着无序化的D峰和石墨化的G峰,D峰一般是碳原子结晶缺陷,G峰则表示碳原子sp2杂化的面内振动[32-33],G峰和D峰的存在说明SiO2@Pc复合材料中碳的是类石墨化的碳.
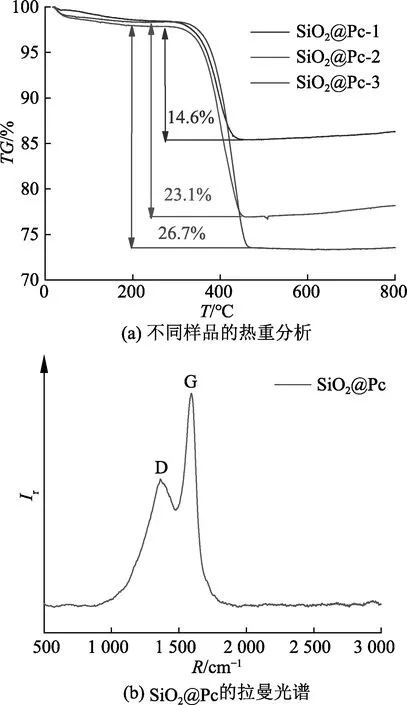
图3 图3 SiO2@Pc热重分析图谱及拉曼光谱
借助XPS谱可以分析样品中各元素种类和化学键结合情况.图4为SiO2@Pc的XPS分析图谱,图4(a)为SiO2@Pc完整的XPS图,可以看出C、Si和O元素都包含其中.图4(b)和(d)分别为Si2p和O1s高分辨图谱,Si2p的结合能为103.68 eV,O1s的结合能是532.88 eV,均对应着Si-O键的生成[34].而在图4(c)对应着C1s图谱,结合能为284.78 eV,该处对应的是石墨化的C-C[35],该结果进一步说明在SiO2@Pc复合材料中碳是以石墨化的形态存在.

图4 (a)SiO2@Pc 的XPS谱及Si,C,O三元素峰值拟合结果
2.2 SiO2@Pc的电化学性能
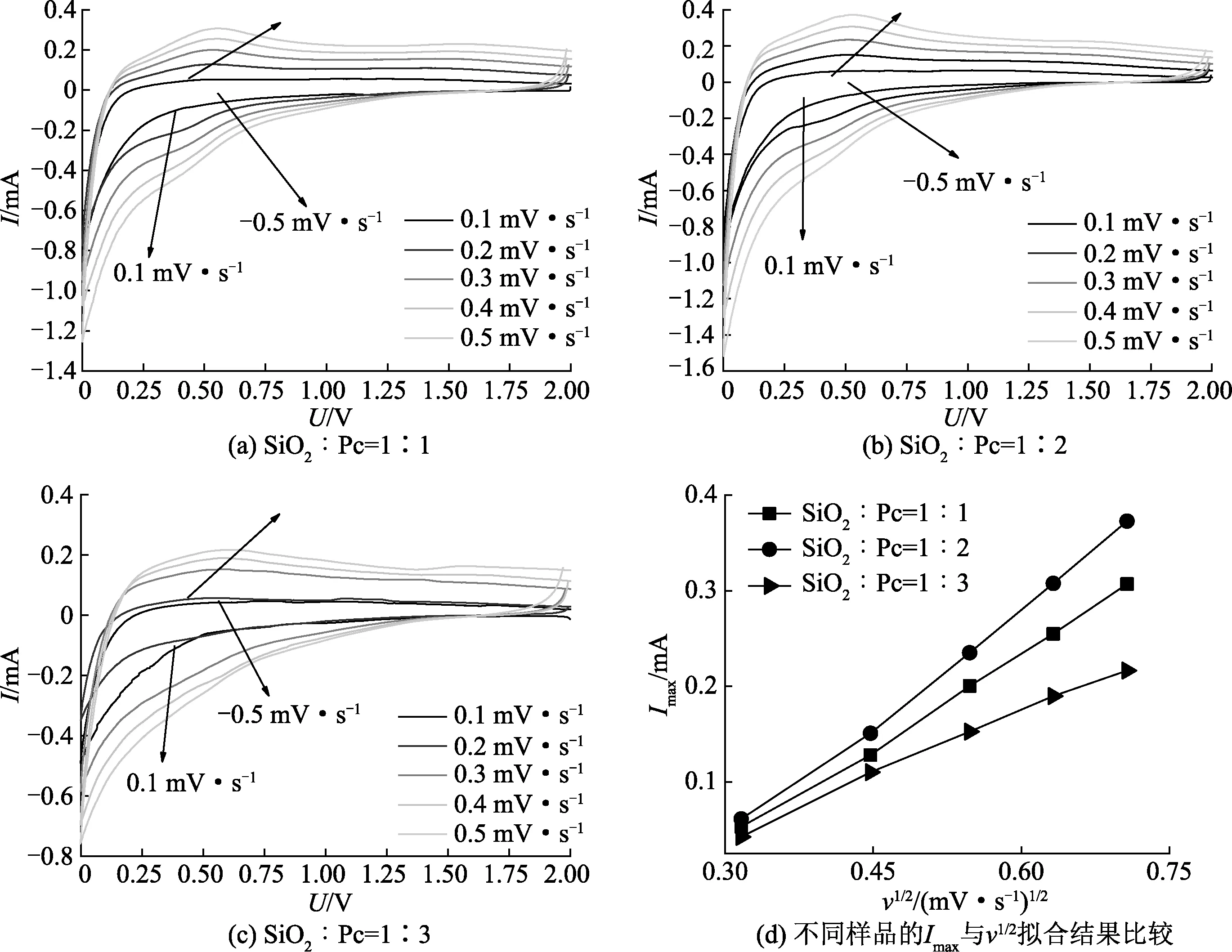
图5是原始的SiO2的在电流密度为100 mA·g-1条件下的充/放电曲线和循环曲线.从图5(a)充/放电曲线可知,原始SiO2在第一次放电时比容量C可达737 mA·h·g-1,但在第一次充电时容量下降到220 mA·h·g-1,其首次库伦效率仅为29.9%,这主要是由于低电导率的SiO2在第一次锂化/脱锂过程中形成的SEI膜消耗了电池系统中大量的Li+,形成了不可逆的Li4SiO4, Li2Si2O5等物质[36-37],从而导致低的首次库伦效率.图5(b)是SiO2循环曲线,可以看到整个循环数N处于不稳定的上升状态,在第100圈后的充/放电容量为444/452 mA·h·g-1.此结果主要是由于在连续充/放电过程中锂的嵌入导致SiO2中Si及SiOx(0 图5 未包覆的SiO2在工作电流密度100 mA·g-1下首圈充/放电曲线及前100圈循环性能 图6进行系统的比较不同比例的SiO2@Pc样品的充/放电曲线和循环数N.实验中采用SiO2与Pc按质量比为1∶1、1∶2、1∶3和纯Pc 4种不同比例的样品.由图6(a)可以看出SiO2@Pc 3种样品在100 mA·g-1电流密度下的首次放电比容量分别为1046 mA·h·g-1,925 mA·h·g-1和648 mA·h·g-1,首次库伦效率分别为37%、45%及39%,相比较于原始的SiO2初始库伦效率均得到了改善,而纯Pc的首次充放电比容量C为337/76 mA·h·g-1.通过图6(b)的循环数N曲线可以看到,3种不同比例下的SiO2@Pc在循环至100圈时其充/放电比容量分别为458/469 mA·h·g-1,446/444 mA·h·g-1以及210/216 mA·h·g-1,纯Pc在100圈时充/放电比容量为95/98 mA·h·g-1,结合图3(a)热重分析图可以计算出在SiO2@Pc复合材料中SiO2贡献的比容量约为1 012 mA·h·g-1,在复合材料中起到了主要的容量贡献.通过表1中不同样品性能的比较,可以看出在循环至第100圈时的充电比容量相比较于第1圈时的充电比容量,原始SiO2变化率为101.8%,而不同比例的SiO2@Pc的变化率均小于20%,其中SiO2@Pc比例为1∶2时变化率最小为7.0%, 该结果说明在此比例下复合材料的循环性能最稳定.这主要归因于SiO2内部的多孔结构与多孔碳骨架的协同效应:一方面多孔碳增加了复合材料的导电性,有利于电子到达SiO2的表面,进而有利于电化学反应,同时由于碳的存在会进一步阻止电解液与SiO2直接反应带来的副产物,从而提升了库伦效率;另一方面Pc及SiO2的分级多孔结构为锂化/脱锂过程中体积膨胀提供了容纳空间,改善锂离子电池负极的循环稳定性能[39]. 图6 不同比例的SiO2@Pc样品的充/放电曲线和循环性能比较(电流密度:100 mA·g-1) 表1 不同样品的电化学性能的比较 通过对比不同材料的阻抗,可以分析电池负极材料电化学性能差异的机理.图7(a)为SiO2@Pc与原始的 SiO2负极材料半电池的电化学阻抗谱图,阻抗谱由高频区的半圆和低频区的斜线组成[40].测试结果表明,SiO2@Pc与原始的SiO2相比,电荷传输阻抗变小,说明Pc的存在增加了复合材料的导电性,减小了Li+在活性材料中的迁移阻抗.除此之外,交流阻抗也经常被应用于锂离子电池材料中Li+扩散系数的定性测定.图7(b)为不同比例的SiO2@Pc所构成的不同电极在1~0.1Hz频率范围内阻抗实部Zr与w-1/2(w为频率)的相关线性曲线.根据关系式:Zr=G-kw-1/2DLi+,锂离子在材料中的扩散系数可以通过公式DLi+=0.5R2T2/n4A2F4C2k2表达[39-40], 式中R为气体常数;n为锂离子转移的电子数;A为电极的反应面积;T为热力学温度;F为法拉第常数;C为嵌锂浓度;k为Zr与w-1/2相关曲线的斜率,由曲线斜率可以定性推导出锂离子在不同电极材料中的扩散系数的大小[41]. 图7 不同SiO2@Pc样品的电化学阻抗谱及Zr与w-1/2的拟合曲线 为了保证实验的准确性,每种比例的材料都采用5~10个电池测试的结果进行统计综合分析,从测试结果可以看出SiO2@Pc为1∶2时样品的斜率最小,表明锂离子在该材料中扩散系数最大,这说明适当比例的多孔碳的存在对锂离子在电极材料中的扩散有一定的贡献作用. 循环伏安(CV)法可以探测材料的电化学活性和反应速率以及电极表面的吸附、扩散等电化学反应[42-43].文中实验通过测量SiO2@Pc电极在不同的CV扫描速率0.1, 0.2, 0.3, 0.4, 0.5 mV·s-1下的循环伏安曲线(图8),将得到的峰电流Imax和扫描速率的二次方根v1/2进行线性拟合,由Randles-Sevcik方程:Imax=Sv1/2DoLi可定性判断Li+在不同电极材料中扩散强弱,其中S为电荷及表面积等有关的常数;v为CV的扫描速率;DoLi为氧化物中锂离子的扩散系数.测试结果由所使用的电化学测试软件可以确定峰值电流与扫描速率的具体值,将所得数据进行统计和拟合分析可定性的判定在SiO2@Pc的比例为1∶2时斜率最大,表明锂离子的扩散性最好,表明一定比例的SiO2@Pc复合材料可以增强锂离子的扩散能力,该结果与电化学阻抗谱在1~0.1 Hz频率范围内Zr与w-1/2的相关线性曲线拟合结果能够很好地吻合,进一步说明了多孔碳包覆对提高氧化硅基的离子锂电池负极材料的电化学性能的重要性. 图8 不同比例的SiO2@Pc在0.1~0.5 mV·s-1的扫描速率下的CV曲线及电极峰电流对扫描速速率平方根的线性拟合结果比较 (1)SiO2@Pc作为锂电池负极时,首次库伦效率可达45%,循环至100圈时的比容量为446/444 mA·h·g-1,容量保持率可达93%以上,其循环稳定性和首次库伦效率相对于原始SiO2得到明显改善; (2)通过电化学阻抗谱和不同频率范围内相关线性曲线拟合以及不同的扫描速率下的循环伏安曲线的峰值与扫描速率的拟合的分析,阐明了SiO2@Pc复合材料中的锂离子迁移能力得到改善与提高.



3 结论
