褪黑素通过介导线粒体自噬改善糖尿病心肌梗死后心肌损伤
2022-04-21焦阳王继航李影沈建侯小玲沈明志付振虹
焦阳,王继航,李影,沈建,侯小玲,沈明志,付振虹*
(1解放军医学院,北京 100853;2中国人民解放军总医院第六医学中心心血管病医学部,北京 100853;3中国人民解放军总医院海南医院心血管内科,海南 三亚 572013)
《中国心血管病报告2020》显示我国心血管病人数3.3亿,死亡率居首位,其中冠心病(coronary heart disease, CHD)患者1 139万人。虽然药物和介入手术治疗降低了心肌梗死(myocardial infarction, MI)相关死亡的发生率,但由于心肌细胞不可再生,急性缺血造成的不可逆心肌细胞凋亡和梗死灶的形成,成为急性心肌梗死(acute myocardial infarction, AMI)预后不佳的重要因素[1]。糖尿病(diabetes mellitus, DM)是CHD的独立危险因素,心肌梗死后28 d的死亡率是非糖尿病患者的2倍[2]。线粒体损伤是MI后心肌受损的关键信号机制,受损的线粒体通过自噬途径被清除,进而维持线粒体质量和数量的稳定[3]。DM患者心肌梗死后线粒体自噬作用减弱,线粒体结构和功能受损严重,加重心肌细胞凋亡。褪黑素(melatonin, Mel)是一种有效的抗氧化剂,对包括糖尿病、感染性疾病、代谢综合征等多种疾病均有益处[4]。Mel能有效减轻线粒体功能障碍,抑制心肌梗死后心肌细胞的损伤。然而,Mel是否通过增强线粒体自噬而发挥MI后心肌保护作用,其具体机制还有待进一步明确,特别是在合并DM的AMI中的作用,还未见确切报道。本研究通过构建小鼠糖尿病急性心肌梗死和细胞高糖高脂缺氧模型,观察Mel通过增强线粒体自噬减少心肌细胞损伤,从而改善心脏功能的潜在机制,旨在为合并DM的AMI患者提供新的临床治疗靶点提供参考。
1 材料与方法
1.1 材料与试剂
褪黑素、链脲佐菌素(streptozocin, STZ)(默克公司, 美国);异氟烷(北京阳光英锐生物有限公司);棕榈酸(北京金鑫博达生物技术中心);一抗:B细胞淋巴瘤-2蛋白(B-cell lymphoma-2, Bcl-2)抗体、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase, Caspase-3)抗体、Bcl-2关联X蛋白(Bcl2-associated X, Bax)抗体和微管相关蛋白1轻链3-β(microtubules associated protein 1 light chain3-β, LC3)抗体、死骨片蛋白1(sequestosome 1, SQSTM1/P62)抗体、帕金蛋白(Parkin)抗体,β-肌动蛋白(β-actin)抗体和二抗(北京乾兆有限公司,中国);二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度检测试剂盒、三磷酸腺苷(adenosine triphosphate, ATP)检测试剂盒(上海碧云天生物技术有限公司);其他由解放军总医院心内科和心外科基础实验室提供。
1.2 实验动物与分组
本实验中所使用的实验动物为雄性C57BL/6J小鼠(6~8周龄),体质量20 g左右,均购自斯贝福(北京)生物有限公司。本实验根据国家卫生研究院实验动物使用指南(No.8523, revised 1996)实施,并由中国人民解放军总医院伦理委员会批准。根据随机数表法将小鼠随机分为4组:假手术组(sham组)、糖尿病组(DM组)、糖尿病心肌梗死组(DMI组)、糖尿病心肌梗死+褪黑素组(DMI+Mel组),每组8只。DMI+Mel组小鼠在心肌梗死术后经过腹腔注射方法补充Mel,剂量为50 mg/(kg·d),直到第4周实验结束。
1.3 建立小鼠模型
1.3.1 糖尿病模型 高脂饲料(脂肪含量60%, 北京斯贝福生物有限公司)连续喂养小鼠4周,禁食12 h后,经腹腔注射0.1 ml浓度为1%的链脲霉素(streptozotocin, STZ)溶液,连续5 d。STZ溶液使用0.1 mol/L的柠檬酸缓冲液配置。注药后2 h恢复饮食,第6天早上测尾静脉空腹血糖,空腹血糖>11.1 mmol/L则建模成功。0.1 mol/L的柠檬酸缓冲液配置方法如下。A液:一水合柠檬酸2.1 g溶于100 ml双蒸水(double distilled water, ddH2O);B液:柠檬酸钠2.94 g溶于100 ml ddH2O,用时现配,A液与B液按照体积123∶77混合使用,pH值4.2~4.5。
1.3.2 急性心肌梗死模型 术前将小鼠胸前区毛发褪去。小鼠置于小动物气体麻醉机中用1.5%异氟烷(氧气气化混合)麻醉2 min。麻醉好的小鼠置于手术台上,底部放加热垫保持体温,整个手术过程持续异氟烷气体麻醉。固定小鼠四肢于手术板,沿胸骨尖至左侧腋下剪开皮肤约1.5 cm,5-0手术缝线荷包缝合切口但不收紧,钝性分离胸前肌群,尖口钳于第4肋间打开肋间隙,左手手指将心脏推出体外,暴露左心耳,从左心耳下缘2~3 mm处进针,以7-0手术缝线结扎冠状动脉前降支,可见心脏前壁和心尖组织变白,将心脏还纳回胸腔,迅速关闭胸腔,挤压胸腔充分排气,防止气胸,收紧荷包打结。从挤出心脏到还纳心脏整个过程控制在30 s左右,不要超过1 min。术后小鼠注意保暖,直至苏醒活动自如。Sham组、DM组与上述过程相同,只是不结扎冠状动脉。
1.4 细胞的培养与处理
在杜尔贝科改良培养基(Dulbecco′s modified eagle′s medium, DMEM)内加入10%的胎牛血清、100 U/mL的链霉素和100 U/mL的青霉素,以下简称完全培养基。完全培养基在95%湿度的恒温培养箱(37℃,CO2含量为5%)培养H9c2细胞。细胞实验与动物实验对应,分为以下4组。(1)对照组(CON组):完全培养基培养;(2)高糖高脂组(HG/HF组):在HG/HF培养基(完全培养基中添加33 mmol/L葡萄糖和500 μmol/L棕榈酸)中培养;(3)高糖高脂缺氧组(HG/HF+hypoxia组):细胞在HG/HF培养基中培养12 h后在缺氧孵箱(孵箱内充满94%N2,5%CO2和1%O2的气体,湿度为95%)孵育6 h;(4)高糖高脂缺氧+Mel组(HG/HF+hypoxia+Mel组):细胞在HG/HF培养基中培养12 h,加入100 μmol/L褪黑素后缺氧处理6 h。每组重复5遍。
1.5 检测指标
1.5.1 多普勒超声评价小鼠心功能 在术后第4周行超声心动图检查。小鼠经异氟烷麻醉后置于平台上利用小动物超声(西门子公司,美国)检测心脏功能。采集所有小鼠的M型超声心动图、左心室射血分数(left ventricular ejection fraction, LVEF)、左室短轴缩短率(left ventricular fractional shortening, LVFS)、左室收缩末期内径(left ventricular end-systolic dimension, LVESD)和左室舒张末期内径(left ventricular end-diastolic dimension, LVEDD), 这些指标均通过连续测量3个心动周期后取平均值得出。
1.5.2 心脏组织病理学检测 将小鼠麻醉后处死,取出心脏,用磷酸缓冲盐(phosphate buffer saline,PBS)充分清洗血凝块后制成石蜡包块,切成3~5 μm的切片,然后分别进行HE染色观察组织形态学改变、Masson染色评价心肌纤维化程度、原位末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling, TUNEL)荧光染色观察心肌凋亡情况。(1)HE染色。组织切片脱蜡后使用苏木素染液染细胞核、伊红染液染胞浆。无水乙醇脱水后,使用二甲苯透明。封片后在显微镜下观察。(2)Masson染色。组织切片脱蜡后使用重铬酸钾染液染色。使用铁苏木素染液染细胞核,漂洗干净后使用丽春红酸性品红染液染色。冰醋酸漂洗后使用磷钼酸水溶液浸染,放入苯胺蓝染液中染色。分化、脱水、透明处理后封片,在显微镜下观察。图像中蓝色区域是胶原阳性染色,排除心内膜、心外膜和血管周围纤维化的蓝色区域,心肌间质纤维化的面积使用蓝染区域的面积占整个图像的百分比来计算。(3)TUNEL染色。将组织切片脱蜡后滴加蛋白酶K处理。按照TUNEL细胞凋亡检测试剂盒使用说明配制TUNEL检测液。处理好的样品上加TUNEL检测液,37 ℃避光孵育后加入活细胞染色液(Hoechst 33342)染细胞核。封片后在荧光显微镜下观察。视野中绿色荧光代表凋亡细胞,蓝色荧光是使用Hoechst染液染的正常心肌细胞核,通过计算凋亡细胞百分比(视野中凋亡细胞/总细胞,%)评估细胞凋亡程度。
1.5.3 心肌细胞凋亡检测 通过蛋白质印迹法(Western blotting)检测细胞凋亡相关蛋白的含量。将H9c2细胞消化、匀浆、裂解,提取蛋白,用BCA蛋白定量法检测蛋白浓度,然后电泳、转膜、封闭、洗膜。在摇床上室温封闭1 h,TBST缓冲液漂洗后,分别加入抗Bax(1∶5000)、Bcl-2(1∶1 000)、Caspase-3(1∶1 000)和β-actin(1∶5 000)一抗孵育,4 ℃过夜,加入兔抗鼠IgG(1∶5 000)二抗,增强化学发光成像。使用Image J软件对条带进行灰度值分析,计算目标蛋白表达量。
1.5.4 细胞内ATP浓度检测 吸去培养液,加入裂解液裂解细胞,4 ℃ 12 000 g离心5 min后取上清液用于检测,加100 μl ATP检测工作液到检测管,室温放置3~5 min后加入20 μl样品,至少间隔2 s后,用化学发光仪测定相对发光单位(relative light unit, RLU),根据标准曲线计算出样品中ATP的浓度。
1.5.5 线粒体自噬检测 Western blotting法检测线粒体自噬相关蛋白的含量,具体方法同上。电泳、转膜、封闭、洗膜,加入LC3抗体(1∶1 000)、P62抗体(1∶10 000)、Parkin抗体(1∶2 000)、β-actin抗体(1∶5 000)一抗孵育,4 ℃过夜,加入兔抗鼠IgG(1∶5 000)二抗,增强化学发光成像,对条带进行灰度值分析,计算目标蛋白表达量。
1.6 统计学处理

2 结 果
2.1 4组小鼠心功能和心脏结构变化
在心肌梗死术后4周,使用小动物超声测量各组小鼠的LVEF、LVFS、LVESD和LVEDD评估心功能和心脏结构变化。与sham组相比,DM组小鼠LVEF、LVFS有所下降,LVESD和LVEDD指标升高,但差异均无统计学意义(P>0.05)。DMI组和DMI+Mel组小鼠LVEF、LVFS均较sham组明显下降,LVESD、LVEDD较sham组明显升高,DMI+Mel组这4项指标均优于DMI组,差异均有统计学意义(P<0.05;图1,表1)。
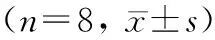
表1 心肌梗死术后4周4组小鼠超声心动图指标情况比较

图1 心肌梗死术后4周4组小鼠心脏功能情况
2.2 4组小鼠心肌细胞形态、间质纤维化程度和心肌细胞凋亡情况比较
在心肌梗死术后4周,对小鼠心脏进行组织切片染色(HE染色),观察心肌细胞形态,测量心肌细胞横截面积大小。Masson染色评价心肌间质纤维化程度。结果显示,DM组心肌细胞横截面积和心肌间质纤维化程度较sham组,差异无统计学意义(P>0.05);但DMI组和DMI+Mel组心肌细胞横截面积和心肌间质纤维化程度均显著增加,而Mel可以显著减轻心肌细胞横截面积的增大和心肌间质纤维化的程度,差异有统计学意义(P<0.05)。
通过TUNEL荧光染色评估心肌细胞凋亡情况。Sham组和DM组心肌细胞凋亡率比较,差异无统计学意义(P>0.05);DMI组和DMI+Mel组细胞凋亡率均显著高于sham组和DM组,但DMI+Mel组细胞凋亡率低于DMI组,差异均有统计学意义(P<0.05;图2,表2)。

图2 心脏组织切片染色评估心肌细胞横截面积、间质纤维化和心肌细胞凋亡情况
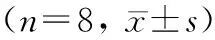
表2 4组小鼠心肌细胞横截面积、间质纤维化面积和细胞凋亡率比较
2.3 4组小鼠H9c2细胞凋亡相关蛋白的表达情况
与CON组相比,HG/GF组、HG/HF+hypoxia组和HG/HF+hypoxia+Mel组Bax和Caspase-3表达显著上调,Bcl-2表达显著下调,差异有统计学意义(P<0.05)。与HG/GF组和HG/HF+hypoxia+Mel组相比,HG/HF+hypoxia组Bax和Caspase-3表达显著上调,Bcl-2表达显著下调,差异有统计学意义(P<0.05;图3)。与TUNEL染色结果相一致,Mel在高糖高脂和缺氧加重心肌细胞凋亡的过程中起保护作用。

图3 4组小鼠H9c2细胞Bax、Caspase-3和Bcl-2蛋白的表达情况
2.4 4组小鼠H9c2细胞内ATP浓度比较
细胞内ATP含量是反映线粒体功能的一项敏感指标[5]。为了测定线粒体的功能,本研究检测了4组小鼠细胞中ATP的平均浓度。与CON组相比,HG/HF+hypoxia组的ATP浓度从(7.92±0.29)μmol/L下降至(0.35±0.12)μmol/L,而加入Mel后,细胞内ATP浓度升高至(3.78±0.27)μmol/L。因此,Mel可以减轻高糖高脂和缺氧造成的ATP含量降低,有效改善线粒体因高糖高脂和缺氧所造成的损伤(图4)。

图4 4组小鼠H9c2细胞内ATP浓度情况
2.5 4组小鼠H9c2细胞线粒体自噬相关蛋白的表达情况
LC3和P62是线粒体自噬相关蛋白,自噬小体形成时,胞浆型LC3(即LC3-Ⅰ)会被酶解掉一段多肽,形成膜型LC3(即LC3-Ⅱ),LC3-Ⅱ/Ⅰ比值升高、P62表达下调[6]。Parkin是线粒体自噬特异性蛋白,当线粒体自噬增强时,Parkin表达升高[7]。本研究结果显示,高糖高脂和缺氧损伤显著降低了LC3-Ⅱ/LC3-Ⅰ比值和Parkin蛋白的表达,增加了P62的表达,表明线粒体自噬减弱,而HG/HF+hypoxia+Mel组LC3-Ⅱ/LC3-Ⅰ比值和Parkin蛋白表达水平显著高于其余3组,P62表达显著低于其余3组(P<0.05;图5),因此Mel可以增强线粒体自噬水平。

图5 4组小鼠H9c2细胞线粒体自噬相关蛋白表达情况
3 讨 论
本研究结果显示,在DM状态下,给予Mel可以减轻MI导致的心肌细胞凋亡和间质纤维化,进而改善心脏功能。进一步完善细胞实验发现,Mel在糖尿病心肌梗死的益处在于Bax、Caspase-3、Bcl-2、LC3、P62、Parkin和细胞内ATP水平的改变。本研究结果显示,Mel可以通过增强线粒体自噬,减轻高糖高脂和缺氧导致的心肌细胞凋亡,从而改善糖尿病心肌梗死后的心脏功能,为合并糖尿病的急性心肌梗死患者的治疗提供新的靶点。
目前,我国DM患者人数超过1.4亿,持续位居世界首位。DM是CHD的等危症,研究显示,DM患者罹患心血管疾病的风险是非DM患者的2倍[8],其可能机制是由于DM加重心脏的微循环损伤和心肌细胞能量代谢障碍[9]。现有的糖尿病心肌梗死治疗策略中,缺乏发病早期心肌细胞保护药物的相关研究。减轻梗死后缺血所诱发的心肌损伤是提高糖尿病心肌梗死患者临床获益、改善长期预后的关键手段。
线粒体是真核生物产生能量的细胞器,是细胞的“动力工厂”,在调节代谢、氧化应激和细胞凋亡等方面的作用十分重要[10,11]。研究发现,线粒体损伤和凋亡是心肌梗死后心肌受损的关键信号机制,在心肌梗死的发病过程中,缺血的心肌细胞内活性氧(reactive oxygen species, ROS)增多、Ca2+紊乱、细胞能量代谢受损,导致线粒体结构和功能异常,而高血糖加重线粒体的损伤[12,13]。因此,寻找保护线粒体结构和功能的治疗靶点可能是减轻糖尿病心肌梗死后心肌损伤的核心。线粒体自噬是一个细胞识别并清除受损细胞器的过程,线粒体发生去极化损伤后通过溶酶体介导降解,对结构和功能异常的线粒体进行清除和溶解,进而维持线粒体质量和数量的稳定[14]。国内外多项研究显示,上调线粒体自噬可以减轻靶细胞凋亡[15-17]。本研究中,在高糖高脂和缺氧的状态下,线粒体自噬水平明显降低,这与相关报道显示的在糖尿病患者中线粒体自噬的细胞保护作用被显著抑制这一结果一致[18]。
研究表明,Mel分泌不良会增加罹患DM和AMI的风险,这也意味着Mel在预防代谢性疾病的发生方面存在潜在益处[19,20]。在多种疾病模型中,褪黑素受体激动剂参与调节线粒体自噬,发挥对疾病的保护作用。例如在神经细胞中,Mel上调线粒体自噬相关的蛋白质LC3-Ⅱ/LC3-Ⅰ、自噬相关5蛋白(autophagy related 5, Atg5)、线粒体自噬标记Parkin 和同源性磷酸酶诱导激酶1(phosphatase and tensin homolog induced putative kinase 1, PINK-1)的表达,抑制核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎症体激活,发挥神经系统保护作用[21]。然而,在合并糖尿病的心肌梗死模型中,Mel是否通过增强线粒体自噬发挥心肌细胞保护作用,还未见相关报道。
本研究通过构建小鼠糖尿病心肌梗死模型和细胞高糖高脂缺氧模型,探讨Mel对糖尿病心肌梗死后心肌损伤的保护机制。研究结果表明:(1)Mel可以减轻糖尿病心肌梗死小鼠的心肌细胞凋亡和间质纤维化,改善心脏功能;(2)在高糖高脂缺氧状态下,心肌细胞ATP水平降低,细胞凋亡增加,而Mel可以逆转这种不良结局;(3)在高糖高脂缺氧状态下,线粒体自噬水平显著降低,加入Mel后线粒体自噬的水平显著升高。综上所述,糖尿病心肌梗死后,心肌细胞内线粒体自噬水平降低,心肌细胞凋亡加剧,补充Mel可以增强线粒体自噬,减轻心肌细胞损伤,从而改善糖尿病心肌梗死后的心脏功能。本研究的结果将有助于更好地探索糖尿病心肌梗死治疗的新靶点及Mel在其中潜在的临床应用价值。
