miR-146a在子痫前期患者中的表达及临床意义
2022-04-19谢洁裴广丽叶元华
谢洁,裴广丽,叶元华
近年来,子痫前期(preeclampsia,PE)作为在妊娠过程中导致围产期高发病率和高死亡率的主要并发症之一[1],以出现进行性高血压、水肿、蛋白尿等并发症为主要特征,PE程度严重的还可能出现脏器(肝、肾脏)退化、胎盘功能障碍甚至发生母体脑退化[2],后果十分严重。因此,对于PE的发病原因一直以来都是研究的重点,然而具体的缘由及机制仍然不是十分清楚[3],综合目前的研究成果,相关家族病史、糖尿病、肥胖、患有不育症或有卵母细胞捐赠等被列为PE的诱因[4]。临床上对PE的诊断主要依靠患者的相关症状和体征,其中临床的相关症状主要包括出现腹痛、胎动减少、视力模糊、高血压等,因此孕期对胎儿健康的实时监测和评估尤为重要[5]。因为其发病机制尚不明确[6],目前很少有干预措施能够有效预防和治疗该疾病,分娩是唯一已知的有效治疗方法[7],因此迫切需要研究和探索新的治疗靶点以预防和治疗PE。
作为高度保守且在转录后参与调控基因表达的小分子非编码RNA,miRNAs可能参与大约60%的基因(哺乳动物)的调控[8],细胞增殖、凋亡、迁移和侵袭等各种生理过程都有miRNAs的参与[9]。人类胎盘中也存在大量的miRNAs表达,有证据表明它们可能参与妊娠相关疾病的病理进程,多项报道证实PE患者的胎盘组织中出现多种差异miRNAs[10]。这些证据表明,miRNA在PE的发病机制中发挥了重要作用,并可能成为潜在的治疗靶点。本研究通过观察患者miR-146a和氧化低密度脂蛋白(oxidized low density lipoprotein,OXLDL)水平的变化,探索miR-146a在PE中的作用机制及其临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取临沂市中医医院2019年10月至2020年9月收治的PE患者24例作为PE组,另选取同期于本院分娩的24例健康妊娠妇女作为对照组,对照组年龄20~36岁,孕周36~39周。PE组年龄22~36岁,孕周35~39周。两组一般资料比较,差异无统计学意义(P>0.05),详见表1。纳入标准:① PE患者符合《妇产科学》第八版中的诊断标准[11];② 具备基础文字阅读和书写能力,患者及家属均同意并签署相关协议。排除标准:① 多胎妊娠及人工受孕;② 患者伴有心脏、肝脏、肾脏、肺等并发症;③ 患者伴有心理和精神疾病;④ 年龄大于40岁。
1.2 实验方法
1.2.1 实验材料与仪器 RNA提取试剂盒;二甲苯;无水乙醇;碧云天BCA蛋白测定试剂盒;OXLDL抗体(orb110361 );GAPDH抗体(AP0063);山羊抗兔二抗(BE0101);经过消毒的研钵、冻存管;Mini-10K+C迷你离心机;Thermo fisher nanodrop分光光度计;JY02S紫外分析仪;Applied Biosystems荧光定量PCR仪;Millipore PVDF膜;医用X射线胶片;酸性定影粉、显影粉;电泳仪、固定夹、电泳槽和转移槽;摇床。
1.2.2 样品收集 胎盘从母体娩出后5 min内收集组织,注意避开出血点,用专门洗净消毒的剪子小心剪取小块组织,用镊子放入提前备好的冻存管,迅速放入液氮罐,经过一夜后第二天转入-80℃冰箱,储藏用于后续研究。
1.2.3 荧光定量PCR 从冰箱取出胎盘组织(n=10),按照试剂盒说明对所取样本中的总RNA进行提取,之后对其进行质量检测:① 测定RNA浓度,分光光度计(NanoDrop® ND-2000)测量前先用DEPC水进行调零。浓度计算:A260×40 ng/uL(260 nm处读值为1表示40 ng RNA/uL),详见下页表2。② 纯度评估:对溶液RNA纯度检测方法采用A260/A280的比值法,参照比值范围1.8~2.1。NCBI(https://www.ncbi.nlm.nih.gov/)检索miR-146a和U6基因序列,然后采用Primer Premier 5.0软件设计相关引物,相关引物由生物技术公司合成(详见下页表3)。接下来,进行反转录:取500 ng的总RNA,加入反转录引物,接下来进行Realtime-PCR反应分析。
表1 两组患者临床资料比较
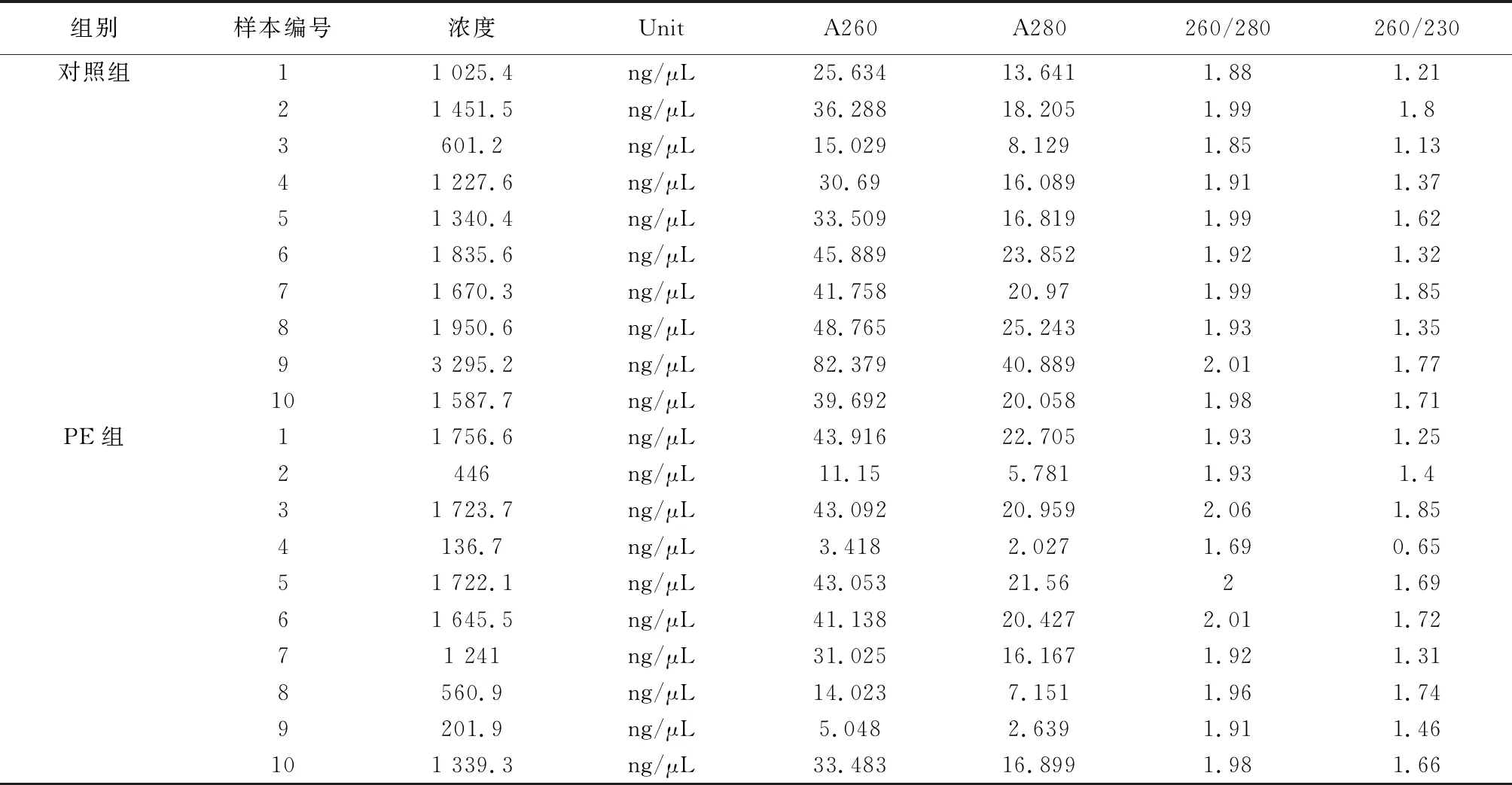
表2 RNA浓度测定

表3 miR-146a和U6引物序列
1.2.4 蛋白质免疫印迹 从冻存的胚胎组织(每组n=10)中提取总蛋白,然后采用BCA法测定各组织中蛋白浓度(Beyotime生物技术研究所,中国上海)(详见表4),并调整各组蛋白浓度达到相同。采用10%十二烷基硫酸钠聚丙烯酰胺凝胶对提取的蛋白质(30 ng)进行电泳分离,然后转移到硝酸纤维素膜上。膜用5%脱脂奶粉孵育2 h,用Tween 20 (TBST) Tris缓冲生理盐水清洗,加入以下一抗:OXLDL(稀释1∶1 000);GAPDH(稀释1∶5 000)。然后用TBST溶液清洗膜3次(5 min/time),用抗兔二抗(稀释1∶10 000)孵育1 h。经电化学发光溶液处理后,在暗室曝光,室温自然干燥,保存扫描结果。

表4 BCA法蛋白浓度测定
1.3 统计学方法
2 结果
2.1 PCR产物扩增与溶解曲线
miR-146a和U6的扩增曲线(循环数)平缓,miR-146a在大约18个循环达到平台期,U6则在大约16个循环达到(见图1、图2),此外,miR-146a与U6的溶解曲线展现出引物的特异性较好。
2.2 miR-146a水平测定结果
RT-PCR对胎盘组织RNA检测的结果表明,对照组和PE组胎盘组织中miR-146a均有表达,miR-146a在PE组胎盘组织中的表达比对照组高(0.442±0.148)倍,差异有统计学意义(P<0.05),见图3。
2.3 miR-146a的靶点预测以及OXLDL蛋白水平测定
首先运用在线预测数据库TargetScan预测到miR-146a与氧化低密度脂蛋白受体1(OLR1)有结合位点(见下页图4A)。用蛋白质免疫印迹(WB)对PE组及对照组OXLDL的表达进行验证,PE组OXLDL表达高于对照组(见下页图4B),且定量分析结果表明两组差异有统计学意义(P<0.05)(见下页图4C)。
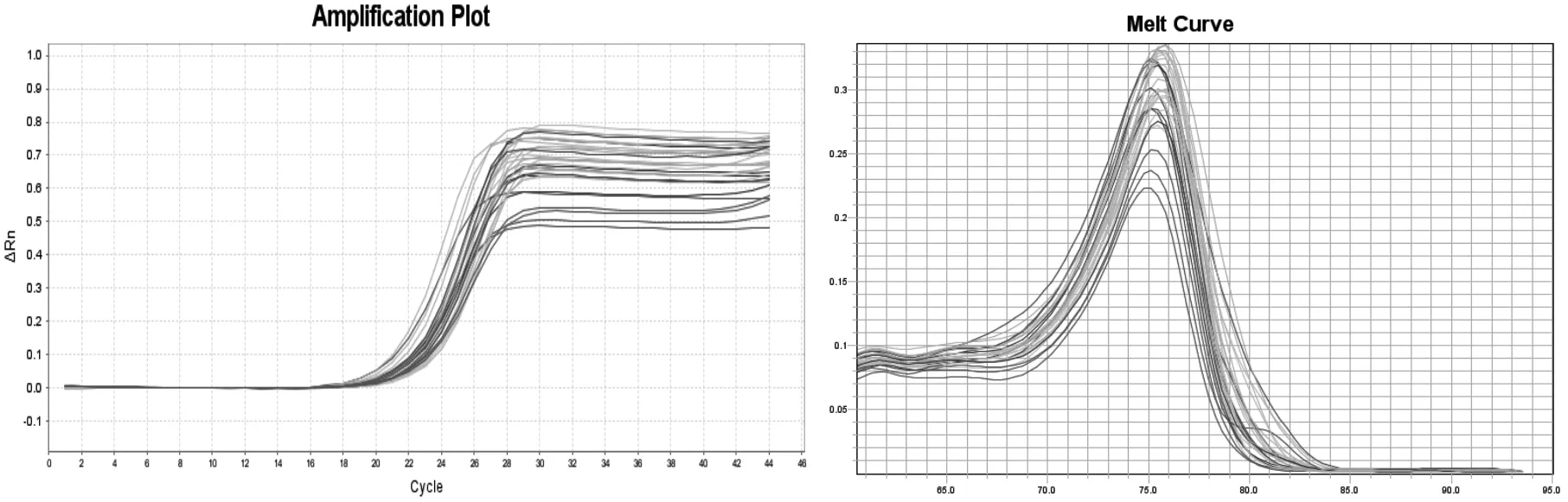
图1 miR-146a基因实时扩增曲线图及产物溶解曲线图

图2 U6基因实时扩增曲线图及产物溶解曲线图
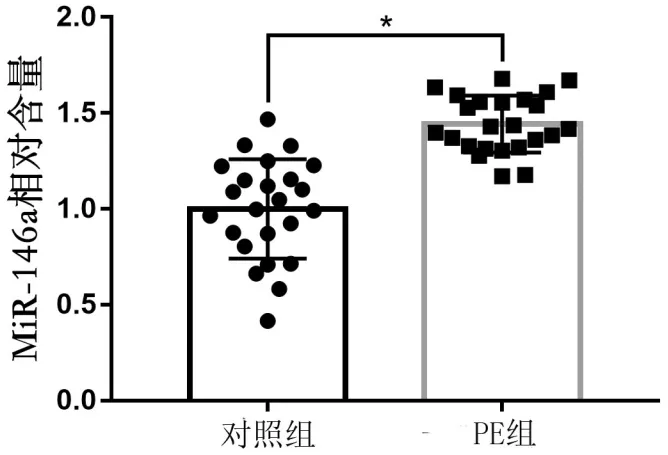
注:*P<0.05表示与对照组比较,差异有统计学意义。
3 讨论
PE由于其发病的复杂性被定义为一种多系统的疾病,其临床诊断主要为出现高血压、蛋白尿等并发症,容易造成围手术期疾病、相关孕产妇疾病甚至是产妇死亡,然而到目前为止,PE的发病机制及预防、治疗措施等尚未完全阐明[12]。在胎盘形成过程中,滋养细胞的入侵和增殖、血管生成和免疫系统调节都是关键环节,有研究表明,这些环节会因为miRNAs的上调或下调而受到不同程度的控制[13],因此PE的特征基因谱和miRNA差异表达谱的挖掘对于阐明PE的进展意义非凡,有助于筛选出相关生物标志物为PE提供新的预防和治疗靶点[14]。

注:*P<0.05表示与对照组比较,差异有统计学意义。
miRNA是一种小的大约22个核苷酸长度的非编码RNA分子,在许多物种中广泛存在并具有调节生理进程的作用。miRNA转录后调控基因表达主要通过基因表达抑制或者直接促进基因的mRNA降解,其具体的调控机制在很大程度上会受到miRNA与其mRNA靶点互补程度的控制。miRNA与mRNA靶点的部分互补也可以调控基因翻译的程度,这就出现了单个miRNA可能会具备调控很多基因的能力[15]。通过对miRNA的靶mRNA的负调控,会对细胞的增殖、分化、凋亡和坏死等生理进程产生影响[16]。多个研究小组进一步鉴定了一些胎盘miRNA的异常表达,这些miRNA的异常表达与子宫内环境或产妇状态的紊乱有关。这些发现引起了人们对miRNA参与胎盘基因调控的兴趣,以及发现胎盘miRNA作为PE和相关疾病的临床生物标志物的可能用途的兴趣。有研究发现,miR-146a与孕妇胎盘中(因胎儿畸形进行流产治疗)的有害物质积累显著相关[17],此外怀孕期间有吸烟习惯的孕妇胎盘中的miR-146a出现显著的变化[18]。在本研究中,我们通过RT-PCR分析发现PE患者胎盘组织中miR-146a表达显著升高,表明miR-146a可能在PE的治疗中发挥作用。
PE中会出现内皮功能障碍,其具体发病机制中有氧化应激(增强)的参与,有证据表明OXLDL (循环氧化LDL)和Ab-oxLDL(OXLDL抗体)参与了动脉粥样硬化疾病进程[19],且在PE病程中,减少胎盘中OXLDL受体表达可能上调OXLDL浓度[20]。通过TargetScan在线数据库进行预测发现miR-146a可能与OXLDL受体结合,进而调控OXLDL表达水平。在本研究中,为了对预测结果进行进一步验证,我们通过WB对OXLDL蛋白表达水平进行测定,结果发现PE患者的胎盘组织中OXLDL表达升高,进一步进行定量分析两组比较,差异有统计学意义。这一结果表明miR-146a可能通过靶向OXLDL受体对OXLDL水平进行调控,进而干预PE疾病进程。通过这一发现,可以在后期对PE疾病的进一步研究中,探讨过表达miR-146a通过靶向受体降低OXLDL蛋白的表达进而改善PE疾病。
在PE的病程中,滋养细胞的侵袭会出现一定程度的异常,例如未能正常侵入子宫、浅层滋养细胞出现浸润、侵袭性滋养细胞数量减少、螺旋动脉转换障碍等。在这项研究中,我们证明了miR-146a在PE患者胎盘组织中表达升高,且可能通过靶向相关受体调控OXLDL水平。但是,本研究仍然存在一些局限:其一,收集的样本是分娩后的妊娠晚期胎盘,不能代表妊娠早期胎盘。因此,我们实验中显示的变化可能并不完全代表胎盘的发育变化;其二,我们通过在线数据库预测了miR-146a与OXLDL受体的靶向关系,虽然测定了OXLDL蛋白的表达情况,但还应该通过免疫组织化学等实验确认miR-146a与OXLDL受体的靶向关系;其三,我们只对胎盘组织样本的miR-146a和OXLDL蛋白水平进行了测定,没有分离滋养层细胞进行miR-146a对其细胞增殖、凋亡、分化、浸润等进程产生影响研究,因此本研究应进一步论证以突破以上局限性。
综上所述,本研究结果表明miR-146a在PE患者胎盘组织中表达升高,可能是作用于OXLDL受体抑制OXLDL阻断节点信号。miR-146a在胎盘中的表达升高可能导致PE发病机制中节点受体—OXLDL信号通路的过度激活,这一发现可能是一种潜在的阻断节点信号通路的治疗策略。
