转位蛋白特异性显像剂18F-DPA-714的在线自动化合成及其质量控制
2022-04-18蒋炜滨
夏 铸,蒋炜滨,夏 彪
(重庆医科大学附属第一医院核医学科,重庆 400016)
近年来,越来越多的研究都表明许多中枢神经系统(CNS)疾病都与炎症相关。小胶质细胞(MG)作为一种CNS内固有的免疫细胞,可以通过其迁移、增殖及分泌的细胞因子来避免脑细胞在急性脑部炎症病变中受到进一步损伤。但在慢性CNS炎症性病变中,MG会诱导一些自身免疫反应,对机体产生不良后果。在许多炎性病程中都发现有MG的激活[1],例如脑梗死、多发性硬化(MS)、阿尔茨海默病(AD)、帕金森病(PD)等。
正电子发射断层扫描(PET)是一种无创成像技术,能够可视化和量化药物在体内的生化和药理学过程。一种转位蛋白(TSPO)的特异性PET显像剂可以在活体中评估大脑中神经炎症(激活的MG)的状态。11C-PK11195是第1个广泛用于评估的TSPO 的PET显像剂,但其低信噪比和高的非特异性结合阻碍了其进一步应用。一些新的TSPO特异性配体,如11C-DAA1106、18F-FEDAA1106和11C -PBR28等在啮齿类动物大脑中显示出良好的体内特性[2]。DPA-714是具有高亲和力的吡唑并嘧啶类的TSPO配体,目前已应用到动物和人类的PET显像研究中。18F-DPA-714(logP为2.44)与11C-PK11195(logP为3.35)相比,具有更好的生物利用度和更低的非特异性结合。在健康人体的研究中,18F-DPA-714在体内的代谢稳定性和生物分布较好,并且有效剂量(17.2 μSv/MBq)适中,表明其可能是一个对神经炎性病变敏感、具有临床应用前景的PET显像剂[3-4]。本研究旨在探索一种简单、高效、自动化合成18F-DPA-714的方法,并对其进行质量控制,以期为临床使用奠定基础。
1 材料与方法
1.1仪器与试剂 HM-10型回旋加速器和 CFN-F100多功能合成模块(日本住友重工业株式会社),高效液相色谱(HPLC)仪(美国Alltech公司),201型HPLC紫外检测器(美国 LabAlliance公司),HPLC放射性检测器(B-FC-3200,美国BIOSCAN公司),H218O丰度98%(上海化工研究院),无菌滤膜Millex(美国Millipore公司),冷化合物19F-DPA-714标准品及药物合成前体(北京派特生物,纯度>99%),色谱纯乙腈、乙醇(美国Sigma公司),醋酸铵(分析纯,成都科龙),Kryptofi2.2.2(K2.2.2)(德国ABX公司),QMA柱、C18小柱(美国Waters公司),CRC.25R活度计(美国Capintec公司),电子天平(上海舜宇恒平),半制备型色谱柱(YMS,AM12305-2510 WT,ODS-AM,250 mm×10 mm,S-5 μm),分析型色谱柱(Alltima C18,250 mm×4.6 mm 5 u,美国Grace公司),清洁级ICR小鼠由重庆医科大学动物实验中心提供。
1.218F-DPA-714的自动化合成 参考Michelle L.James的合成方法[5-6],合成路线见图1,采用住友CFN-F100多功能合成模块,经自主编辑自动化程序(图2)。使用医用回旋加速器60 μA束流,打靶30 min,通过核反应18O(p,n)18F生产18F-,18F-传入到多功能合成模块中,18F-经QMA柱捕获18F-,用相转移催化剂 K2.2.2/K2CO3溶液0.9 mL,将18F-从QMA柱上洗脱至反应瓶中,通氮气条件下,110 ℃干燥5 min,除去水分,再次加入1 mL无水乙腈,氮气条件下,90 ℃干燥3 min,使18F-与K2.2.2混合物完全除去水分。将1 mL乙腈前体溶液(2~4 mg/mL)加入至反应瓶,95 ℃密闭加热反应10 min,得粗产品冷却后,转移至半制备型HPLC C18反相柱(250 mm×10 mm,5 μm),再次加入1.5 mL乙腈至反应瓶中,将反应瓶壁残留物再次转移至半制备型HPLC C18反相柱,进行分离纯化,制备型色谱分离条件为:流动相为V(乙腈)∶V(0.1 mol/L NH4OAc)=60∶40,流速4 mL/min,收集6.5 min左右的放射性产品峰于中间瓶,加30 mL水稀释产品中的乙腈浓度,再转移至C18小柱富集产品,用10 mL水冲洗C18小柱,进一步除去乙腈,最后用1 mL乙醇洗脱产品,并过有机相无菌滤膜,加入生理盐水稀释乙醇浓度至10%以下制成可用于静脉注射的产品。从18F-传入合成模块至获得最终产品,整个过程为自动化合成,无须人工添加物料,极大地避免了药物的辐射。
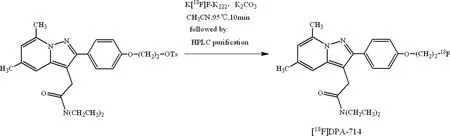
图1 18F-DPA-714的合成路线
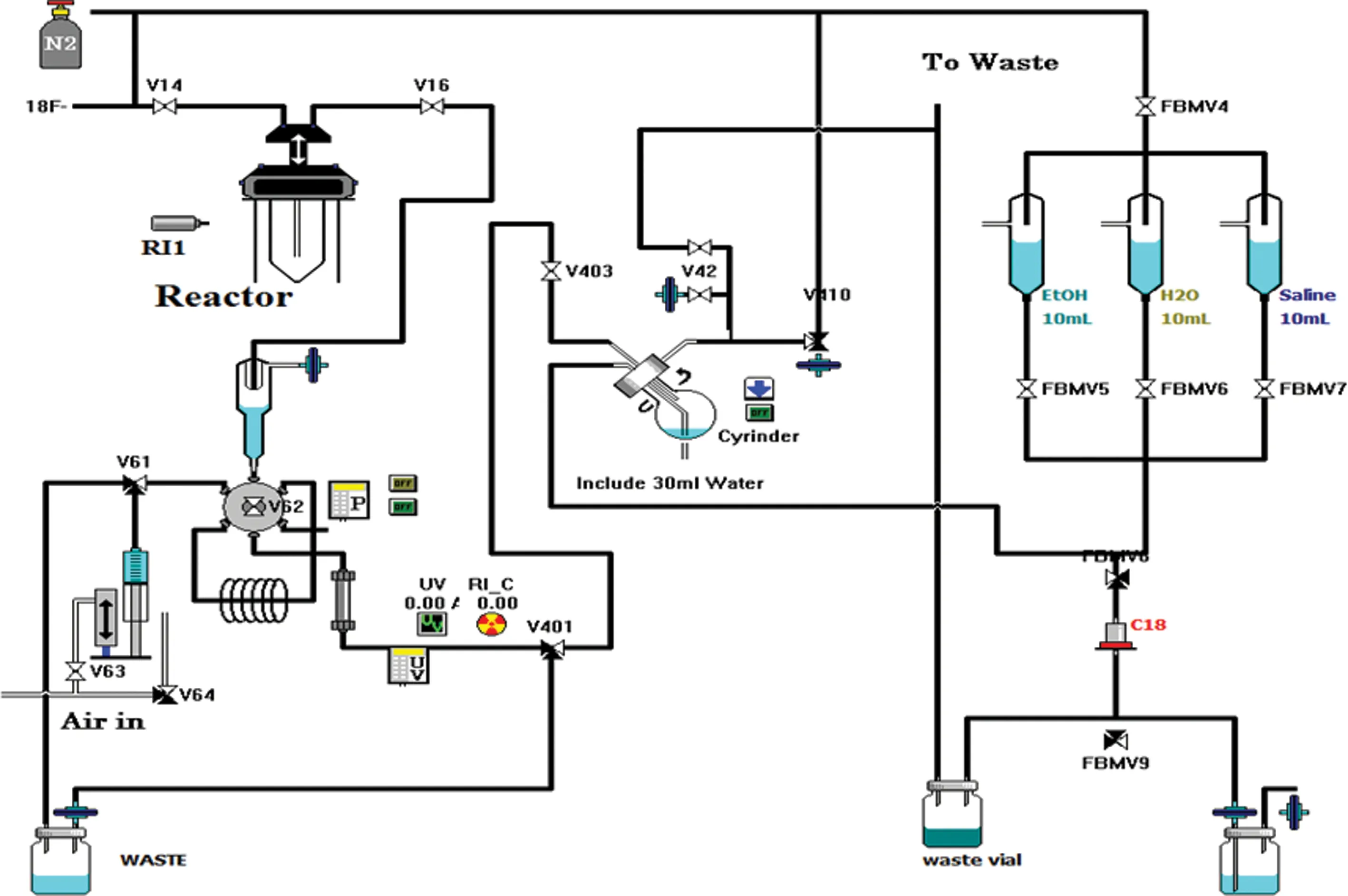
图2 18F-DPA-714自动化控制程序流程图
1.3质量控制 物理检查:观察产品透明度和颜色,测定放射活度。化学检查:测 pH值、产品稳定性和放射化学纯度。采用HPLC,色谱条件为色谱柱:Alltima C18,250 mm×4.6 mm 5 u,流动相为V(乙腈)∶V(0.1 mol/L NH4OAc)=60∶40,流速1 mL/min,波长254 nm,柱温25 ℃,放射性检测器为BIOSCAN,B-FC-3200。分别进样冷化合物19F-DPA-714标准品、药物合成前体及产品各10 μL,记录保留时间。产品在0、2、4 h时分别进样测定放射化学纯度,以观察放射化学纯度有无变化。
1.4比活度测定 取冷化合物19F-DPA-714标准品1.06 mg,配制成1.06 mg/mL乙腈溶液,用乙腈稀释成以下系列浓度,分别为0.331 25、0.662 5、1.325、2.65、5.3、10.6、21.2 μg/mL,色谱条件同上,进样10 μL,绘制19F-DPA-714浓度与峰面积标准曲线。18F-DPA-714产品进样10 μL,记录产品紫外峰面积和放射性浓度,根据标准曲线计算18F-DPA-714比活度。
1.5细菌内毒素检测 待18F-DPA-714完全衰变至无活度后,取样委托重庆医科大学附属第一医院检验科对该药物溶液进行内毒素检查及无菌检查。
1.6异常毒性试验 取小鼠5只,每只尾静脉注射18F-DPA-714约11 MBq,观察48 h,记录小鼠的活动状态及体重变化。
2 结 果
2.118F-DPA-714的自动化合成结果 利用CFN-F 100多功能合成模块经自主编辑自动化程序后,进行18F-DPA-714全自动合成,整个合成过程无须人为干预,避免了操作人员的辐射危险。本实验采用亲和取代标记法,前体投入为2~4 mg,整个制备耗时约为55 min,经半制备型HPLC纯化后,放射化学纯度>99%,未衰减校正的合成效率为18%~36%(n=20),为18F-DPA-714的研究和临床应用提供了保障。
2.2质量检测结果 本品为无色透明溶液,pH值为6左右,放射化学纯度>99%,18F-DPA-714在上述分析色谱条件下,保留时间为8.8 min左右,与标准品19F-DPA-714保留时间(8.2 min左右)基本一致(紫外检查器在放射性监测器前端,故放射峰会稍有延迟)(图3、4),且与前体保留时间(约11.0 min)有明显差异(图5)。稳定性测试结果显示,0、2、4 h放射化学纯度均保持在98%以上,无明显变化。
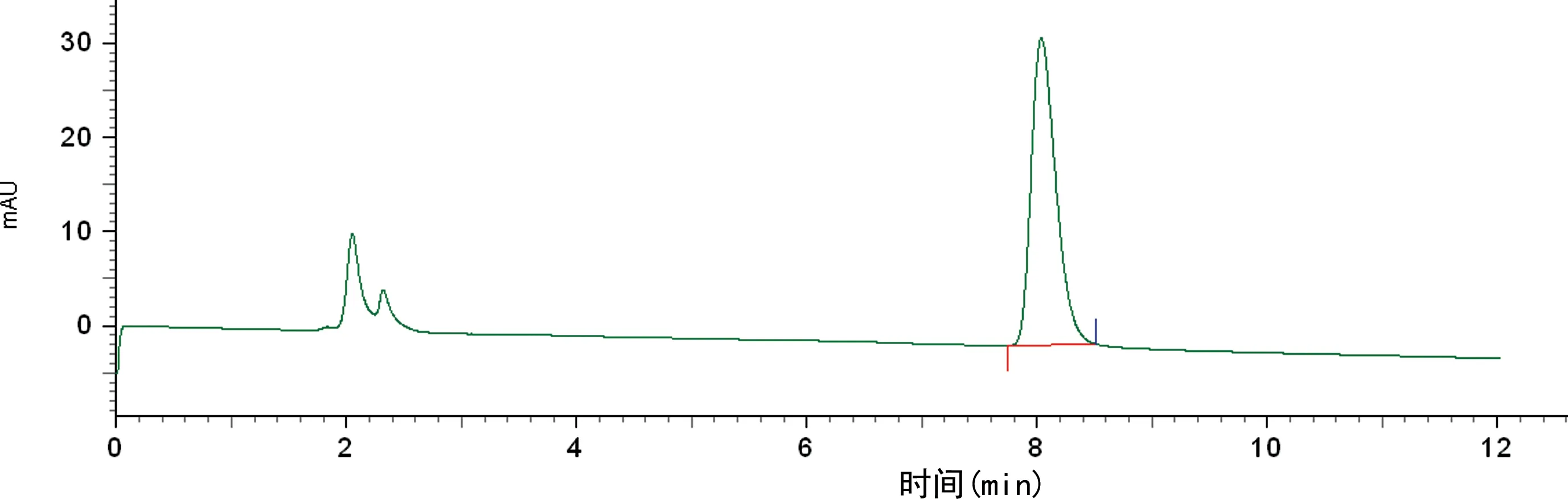
图3 19F-DPA-714的紫外图谱
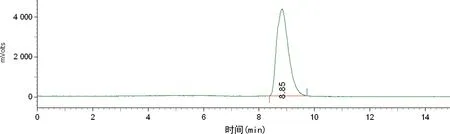
图4 18F-DPA-714的放射图谱
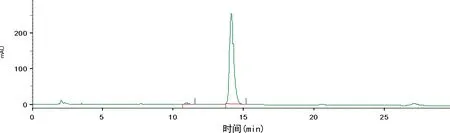
图5 DPA-714前体的紫外图谱
2.3比活度 采用不同浓度标准品19F-DPA-714绘制标准曲线,其公式为y=22 981x+2 048,R2=0.999 8,线性良好,经计算结果显示,18F-DPA-714比活度可达675 GBq/mg。比活度足够高,可以满足临床使用。
2.4细菌内毒素检测 经重庆医科大学附属第一医院检验科按照《中国药典2020年版》中方法检测,内毒素、无菌检查均为阴性,符合注射液使用标准。
2.5毒性试验 小鼠注射18F-DPA-714后,48 h内每只小鼠均正常生长,无异常反应及死亡现象发生。
3 讨 论
炎症显像是核医学领域热点话题,18F-FDG仍然是应用最为广泛的,但其为广谱的正电子显像剂,针对炎症的显像恰恰存在不足。MG在AD发病机制中的作用已经受到广泛关注,MG激活而高表达的TSPO靶点也成为神经炎性疾病显像的研究热点[7-8]。11C-PK11195作为广泛应用的神经炎性病变显像剂,虽已用于动物和临床研究,但其半衰期短(20.3 min)和药代动力学方面的不足限制了其进一步的临床应用。
TSPO是一种相对分子量为18×103,位于线粒体膜外的具有5个跨膜结构域的蛋白,主要表达于合成类固醇的内分泌器官,包括心脏、肾脏、肾上腺皮质、睾丸或卵子[9]。在巨嚼细胞、中性粒细胞、淋巴细胞,以及激活的MG等,都是呈现高表达水平[10-11]。TSPO最典型的功能之一是参与胆固醇从线粒体外膜向线粒体内膜的转运,这对类固醇的合成至关重要[12]。在CNS中,TSPO在神经炎症状态下显著上调,TSPO的异常过度表达是许多其他神经系统疾病进展中的关键病理信号。研究发现,MG在AD的发病机制中发挥重要作用,MG在致炎因子作用下被激活成反应性MG,产生大量前体炎性因子,从而导致神经变性的发生[13]。正常情况下TSPO在CNS中低表达,并且局限在神经胶质细胞(星形胶质细胞和MG)中,在发生脑损伤或炎性病变时,TSPO 表达上调。而神经炎症发生在AD发作前阶段,是主要的驱动力。TSPO也与AD和缺血引起的梗死密切相关[14-15]。动物研究方面,有研究证实了TSPO特异性示踪剂可以观察到大鼠脑缺血模型中脑梗区域的放射性摄取[16];在AD中,示踪剂在脑内的浓聚也发现与AD特异性Tau蛋白聚集部位密切相关。此外,转运蛋白显像还在动脉粥样硬化性疾病中得到了应用[11]。所以,用PET显像位于MG上的TSPO,已经成为研究CNS炎症的重要手段,TSPO也成为PET显像的重要靶点,可用于检测与脑部疾病相关的炎症,并监测抗炎疗法的治疗反应。
本研究采用日本住友CFN-F100多功能合成模块,可以很好地根据需要实现的合成反应进行自主编辑自动化合成程序,实现自动化合成,能很好地避免放射性药物的辐射,这对放射性药物的制备至关重要。本研究中18F-DPA-714的合成制备主要通过亲核取代反应进行氟化。该反应成败的关键在于18F-的干燥除水,本实验中采用2次加入乙腈,通氮气条件下,干燥除水,保证18F-在K2.2.2的作用下与前体进行氟化。结合文献中已经有的相应氟化反应温度和氟化反应时长[5]。考虑放射性药物前体价格昂贵的因素,本研究主要考察了前体的用量,分别考察了1、2、4 mg前体用量下的产品收率,结果显示,1 mg前体时,收率不足10%,2 mg和4 mg前体产品收率(22%vs.24%)相差不大,考虑药物制备成本,故本实验确定采用2 mg前体用量为宜。此外,本实验中,前体氟化反应结束冷却后,无须在进入半制备型HPLC前进行去除18F-的预处理,直接将反应液加入半制备型HPLC进样器中,增加1次1.5 mL乙腈清洗反应器(将残留在反应器壁上的混合物洗出),连同反应液一起加入到半制备型HPLC中进行纯化分离。经标准品19F-DPA-714进样预实验确定,该药物的出峰时间为6.5 min,在合成纯化处理中,18F-DPA-714的出峰时间与标准品相同,收集6.5 min左右的产品峰,加30 mL水稀释乙腈浓度至10%以下(减少产品在C18小柱中的漏传损失),采用C18小柱进行18F-DPA-714产品富集,进一步用13 mL水冲洗C18小柱,以便除去产品中的乙腈,最后采用1.5 mL乙醇洗脱产品,过无菌滤膜后,加生理盐水至乙醇浓度达10%以下即得最终产品。
经过考察,本研究确定的色谱分析条件为色谱柱:Alltima C18,250 mm×4.6 mm 5 u,流动相为V(乙腈):V(0.1 mol/L NH4OAc)=60∶40,流速1 mL/min,波长254 nm,柱温25 ℃,放射性检测器为BIOSCAN,B-FC-3200。该条件下,标准品19F-DPA-714(紫外图谱保留时间为8.2 min)和18F-DPA-714(放射图谱保留时间为8.8 min)与前体(紫外图谱保留时间为11.0 min)之间能很好地分开,说明该体系下系统适用性好。经分析型HPLC分析,该产品18F-DPA-714放射化学纯度>99%,比活度高达675 GBq/mg,稳定性好,适用于动物实验及临床研究。该药物logP为2.44,在亲和力、信噪比、生物分布和代谢稳定性方面都优于11C-PK11195[3-4],能很好地穿过血脑屏障,迅速分布到脑组织中,可应用于脑部的神经炎性疾病等方面的研究。
本实验中建立的在线自动化合成方法,成功制备出TSPO特异性显像剂18F-DPA-714,收率稳定,产量高,建立的质量控制方法能很好地测定其放射化学纯度和比活度,该方法制备的18F-DPA-714各项指标均符合标准。本研究为后续开展的动物研究和临床应用研究奠定了坚实的基础。
