非小细胞肺癌患者肿瘤组织中驱动基因的分子病理检测分析及其临床意义
2022-04-18左安欣张晓妹
左安欣,张晓妹,仇 玮
(南京市江宁医院病理科,江苏 南京 211100)
肺癌是全世界发病率和死亡率均为最高的肿瘤[1],其中非小细胞肺癌(NSCLC)占肺癌的80%~85%[2-4]。肺癌传统的治疗方法总体预后较差,5年生存率低于20%[5-8]。近年来,研究发现,某些基因的突变可驱动肺癌的发生发展,即肺癌的驱动基因。针对 NSCLC的常见驱动基因(如 EGFR、ALK、ROS1、RET、BRAF、HER-2和MET 等)研究出了相应的靶向治疗药物,明显延长了肺癌患者中位生存期,并使其疗效得到显著改善[8-9]。这些驱动基因的研究为个体化治疗及靶向治疗的推广奠定了基础。美国国立综合癌症网络(NCCN)指南明确指出,在进行靶向治疗前需要对基因的突变状态进行检测,并建议对更广泛的有效基因进行检测[10]。因此,多基因联合突变检测可以为临床靶向治疗提供更有效、更精准的治疗方法。鉴于此,本研究采用探针扩增阻碍突变系统PCR(ARMS-PCR)法检测83例 NSCLC患者驱动基因突变情况,并分析其基因突变与患者临床病理参数的关系,为判断疾病发展过程、预后及靶向治疗提供分子病理学依据。
1 资料与方法
1.1一般资料 收集南京市江宁医院病理科2020年1月至2021年7月经手术切除、穿刺、活检及胸腔积液等NSCLC 样本83例,其中腺癌76例,鳞癌4例,未分化癌1例,肉瘤样癌2例,其病理诊断明确为NSCLC,且患者无血液系统疾病、免疫缺陷疾病及其他恶性肿瘤等严重影响研究结果的病症,同时有足够的肿瘤细胞进行后续分子病理检测。
1.2主要试剂和仪器 核酸提取试剂盒、10种(ALK、ROS1、RET、EGFR、KRAS、HER-2、PIK3CA、NRAS、MET和BRAF)突变基因检测的试剂盒(荧光PCR法)均由厦门艾德生物公司提供。荧光定量PCR仪为宏石SLAN-48P/96S,杭州奥盛Nano-300紫外分光光度计。
1.3方法 根据苏木素-伊红(HE)染色,先在显微镜下圈出肿瘤区域,将肿瘤区域的蜡块切成蜡卷,每个肿瘤样本总共收集2管,分别用于DNA和RNA的提取。严格按照试剂盒说明书步骤进行操作。提取后,用紫外分光光度计测量DNA/RNA质量及浓度,将浓度稀释至2~5 ng/μL备用。福尔马林固定石蜡包埋的组织DNA、RNA提取试剂盒(EGFR、ALK、ROS1、RET、KRAS、NRAS、PIK3CA、BRAF、HER-2九基因联合检测试剂盒)和MET突变检测试剂盒。具体操作步骤严格参照说明书进行,体系将在实时荧光定量PCR仪中进行扩增。
1.4统计学处理 采用SPSS18.0软件进行统计学处理。应用Pearson卡方检验,连续校正的卡方检验及Fisher精确概率法分析基因突变与临床病理特征的相关性,所有P值均基于双向假设检验,以P<0.05为差异有统计学意义。
2 结 果
2.110种基因突变分布 检测的83例标本中,10种基因总突变率为74.70%(62/83)。41例出现了EGFR突变(49.40%),其中19例为19号外显子缺失(19-Del),15例为21号外显子基因突变(L858R),3例为20号外显子插入突变(20-Ins),3例为18号外显子G719X突变,1例为21号外显子L861Q突变。4例出现ALK基因融合突变(4.82%),4例出现ROS1基因融合突变(4.82%),11例出现KRAS基因突变(13.25%),3例出现HER-2基因突变(3.61%),2例出现MET 14号外显子跳跃突变(2.41%),另外,PIK3CA基因突变为1例(1.20%)。见图1。
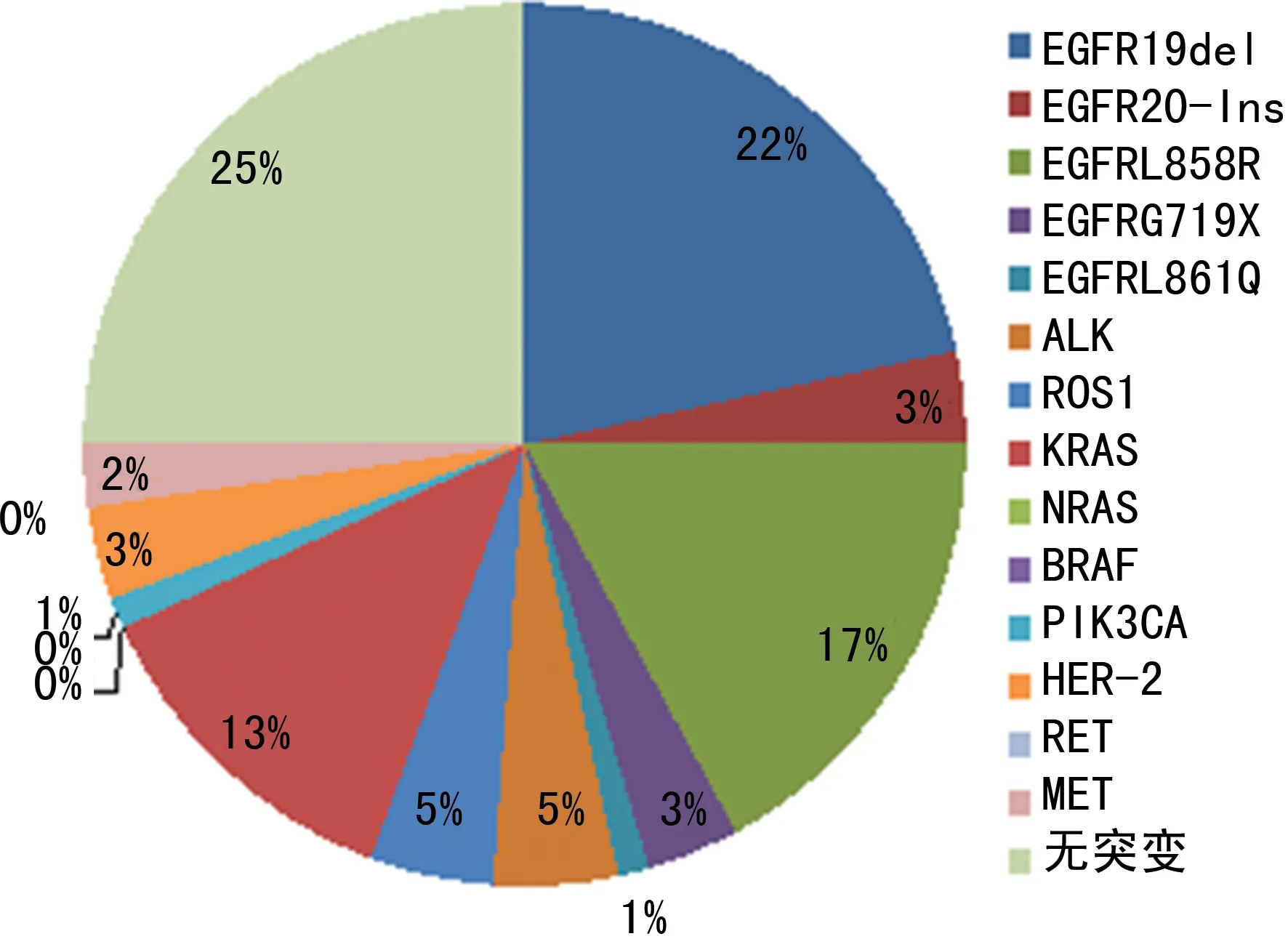
图1 83例NSCLC患者突变率示意图
2.210种驱动基因突变与临床病理特征的相关性 在本组83例NSCLC患者的样本中,经统计发现,EGFR突变率最高,占比49.40%,女性EGFR突变率高于男性,肺腺癌高于肺鳞癌,且年龄≥60岁者为高发人群,差异有统计学意义(P<0.05),见表1。KRAS突变在男性患者中的发生率高于女性(P<0.05),且高发于年龄≥60岁者。此外,HER-2、NRAS、BRAF、PIK3CA、RET、ROS1突变率较低,由于本组纳入研究的病例数过少,均尚未发现其与患者性别、年龄、组织学类型存在明显相关性。

表1 NSCLC的10种驱动基因突变者的临床特征
2.3双突变样本的组织病理特征 本组研究中,1例出现了EGFR、KRAS共突变(图2A),1例出现了EGFR、PIK3CA 共突变(图2B)。其中,后者可以采用相应的靶向药物进行治疗。由于 KRAS属于EGFR下游,EGFR、KRAS 共突变患者对EGFR抑制剂疗效欠佳。双突变的产生可能源于肿瘤异质性[11],亦或为同一肿瘤细胞携带2种驱动突变[12]。通过结合双突变样本的 HE 切片和免疫组化染色,结果发现双突变样本的组织病理学都是肺腺癌,并且组织学形态相似,未发现特有的病理特征。因此不能单从组织形态学推断是否有驱动基因的共突变。
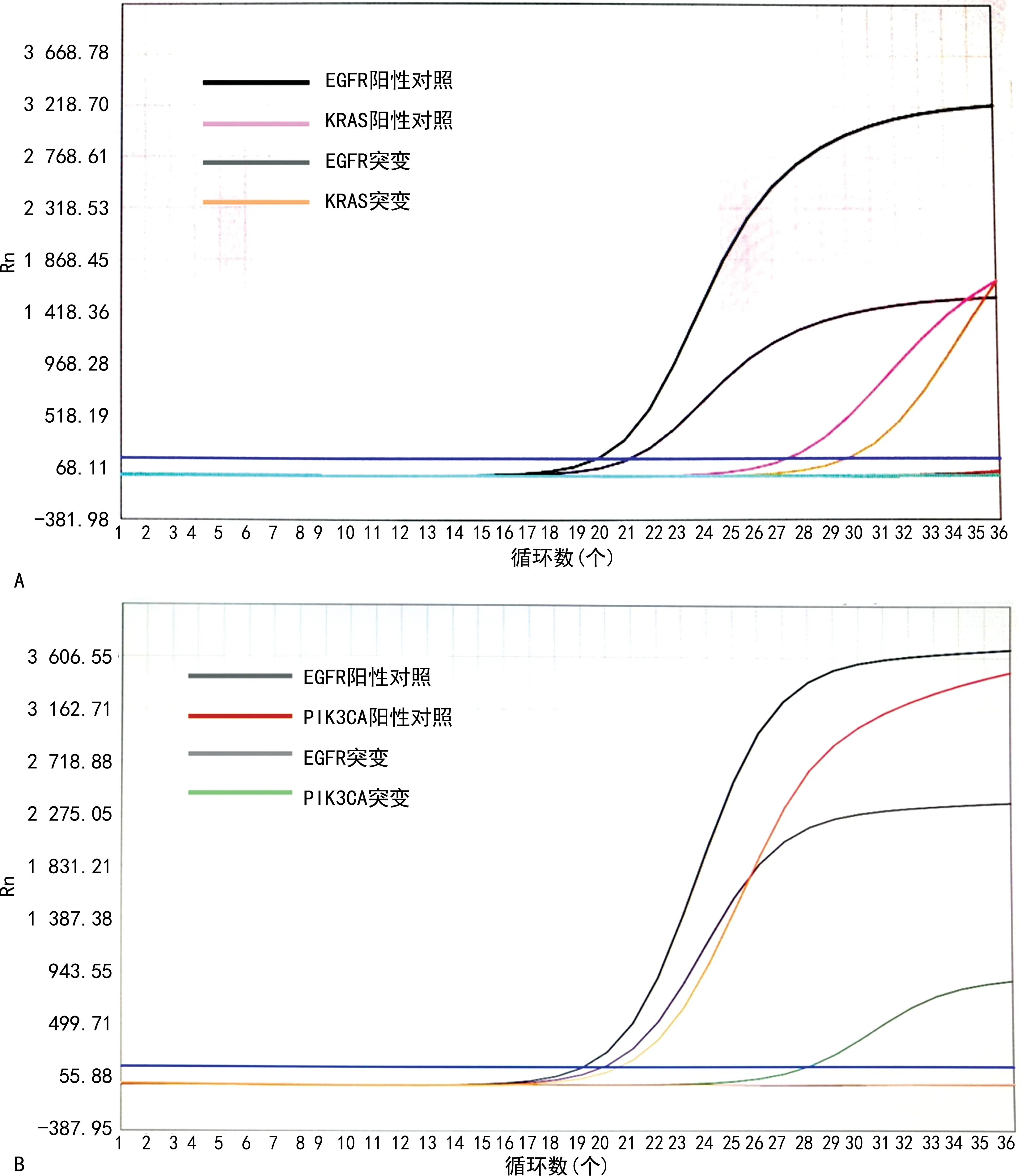
A.EGFR、KRAS 共突变;B.EGFR、PIK3CA 共突变。
3 讨 论
EGFR是酪氨酸激酶Ⅰ型受体家族的成员之一。EGFR与配体结合会导致重要的构象变化,转导下游信号,调节细胞的增殖、凋亡、迁移、存活和一系列复杂的过程[13]。EGFR的酪氨酸激酶活性位点主要位于18号外显子到24号外显子之间,因此,其激活突变和耐药突变也集中在这个区间。以往研究数据表明,EGFR基因的突变率在亚洲为30%~51%[14],SHI等[15]认为EGFR突变在肺腺癌、女性、亚洲人和从不吸烟的人群中更为常见。本研究显示,EGFR总突变率为49.40%(41/83),且女性高于男性,肺腺癌高于肺鳞癌,符合以往研究结果。此外,EGFR是10种基因中突变率最高的,种类多样,最常见的类型为19号外显子缺失和21号外显子L858R突变[16],本研究符合既往报道。其中,19号外显子突变占总突变的46.34%(19/41),且以缺失突变为主,点突变及插入突变少见;21号外显子突变占总突变的39.02%(16/41),且以L858R点突变为主,其他位点突变少见;18号外显子突变占总突变的7.32%(3/41),均为G719X突变;20号外显子突变占总突变的7.32%(3/41)。有研究报道,18号、19号和21号外显子易受环境致癌物的攻击,突变后可能进一步激活EGFR信号转导通路,在NSCLC的发生、发展中可能起重要的作用[17]。
KRAS是RAS 基因家族的一员。当细胞外的生长分化因子将信号传导 KRAS 蛋白时,启动了细胞开关,导致信号系统开放,激活不同的信号传导途径,诱导肿瘤的发生及发展[18]。有研究表明,KRAS突变在男性、老年患者、吸烟者、肺腺癌中较为常见[19],在亚洲人群中其发生率为10%~15%[20]。本研究中,KRAS突变发生率居第2位(13.25%,11/83),在男性患者中,发生率高于女性,且高发于年龄≥60岁者,与既往研究KRAS 基因突变结果相符。
NSCLC中ALK融合基因最常见的类型为EML4-ALK融合基因[21],它们产生的融合蛋白能够使ALK受体持续自磷酸化,激活下游信号通路,导致细胞恶性转化[21]。研究报道,ALK重排常见于男性、年轻的晚期肺腺癌患者[22],ALK 融合发生率为2%~7%[23],本文ALK基因融合突变率(4.82%,4/83)与报道相符。此外,研究表明约有2%的 NSCLC 病例发生ROS1基因重排[24],本研究结果稍高(4.82%,4/83),由于本组研究样本例数过少,对这类突变患者的有效性还需加大样本量继续进行研究。
本研究采用ARMS-PCR检测方法,具有操作简便,易掌握等诸多优点。此外,ARMS-PCR法具有高灵敏性,只对指定基因进行检测,对标本的DNA浓度及质量要求较低,能检测出样本中低至1%的突变[25]。随着更多驱动突变基因被发现,以及相关药物的研发,单基因检测在时效性、样本消耗量等方面将出现更多的局限性。因此,多基因联合检测能够同时检测多种热点突变,提高检测效率,节省样本,从而为患者的靶向治疗提供更有效、更精准的治疗方法。但本研究尚存在一定的局限性,纳入的病例数相对较少,样本数量的不足一定程度影响了分析结果的稳定性,有待检测更大样本的人群数据,以进一步探究多基因突变检测的临床应用价值。
总之,NSCLC患者中EGFR基因存在较高的突变率,尤其为19号和21号外显子突变,其基因突变分型能指导表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)的肿瘤靶向治疗,KRAS基因突变率虽低,但也不容忽视,其基因突变预示着EGFR-TKI原发耐药。本研究所得结果对临床指导肺癌靶向用药有一定的积极作用。
