食管胃交界部腺癌肿瘤源性坏死的临床病理特征
2022-04-18徐瑞华赵学科郭贵周魏梦霞范宗民李爱丽王献增鲍启德高社干周福有王立东
徐瑞华,宋 昕,赵学科,郭贵周,魏梦霞,李 贝,范宗民,孙 琳,李爱丽,王献增,鲍启德,高社干,5,周福有,王立东
食管胃交界部腺癌(adenocarcinoma of esophagogastric junction, AEG)是食管和胃交界处发生的腺癌。AEG是中国人常见的消化道恶性肿瘤,与食管癌堪称“姊妹癌”,具有明显的高低发区之分,在食管癌高发的地方AEG也高发,河南、河北、山西三省交界的太行山脉地区是中国AEG发病率最高的地区。AEG因早期无特异性症状,诊断时多为晚期,预后差,目前尚未发现AEG的治疗靶点及靶向药物。肿瘤坏死是许多实体肿瘤的共同特征,包括结直肠癌和肾癌、乳腺癌、肺癌和胰腺癌等。研究证实,肿瘤源性坏死与肿瘤患者的生存相关[1]。肿瘤源性坏死在AEG患者的术后病理较为常见,目前关于AEG的肿瘤性坏死及其潜在的价值尚未见报道。本研究旨在通过EAJ肿瘤源性坏死临床病理特征的描述,为后续肿瘤性坏死在AEG的机制及靶向治疗研究提供理论基础。现报道如下。
1 材料与方法
1.1 研究对象
本研究是回顾性队列研究,所有患者均来自省部共建食管癌防治国家重点实验室建立的50万食管和食管胃交界腺癌数据库(1973年至2020年)。本研究最终纳入食管胃交界部腺癌1 406例。筛选流程见图1。数据包含了患者的一般信息、临床诊疗、术后病理信息及随访信息。

图1 数据筛选流程
纳入标准:①经病理学专家及医院原始病理诊断确诊发生肿瘤源性坏死的AEG患者,见图2;②籍贯和现住址记录完整;③行AEG根治术治疗,术后病理证实为AEG;④病理信息齐全。排除标准:①未发生肿瘤源性坏死的AEG患者②地址不详;③术前接受放疗、化疗或其他治疗;④合并其他恶性肿瘤;⑤病理信息未记录。
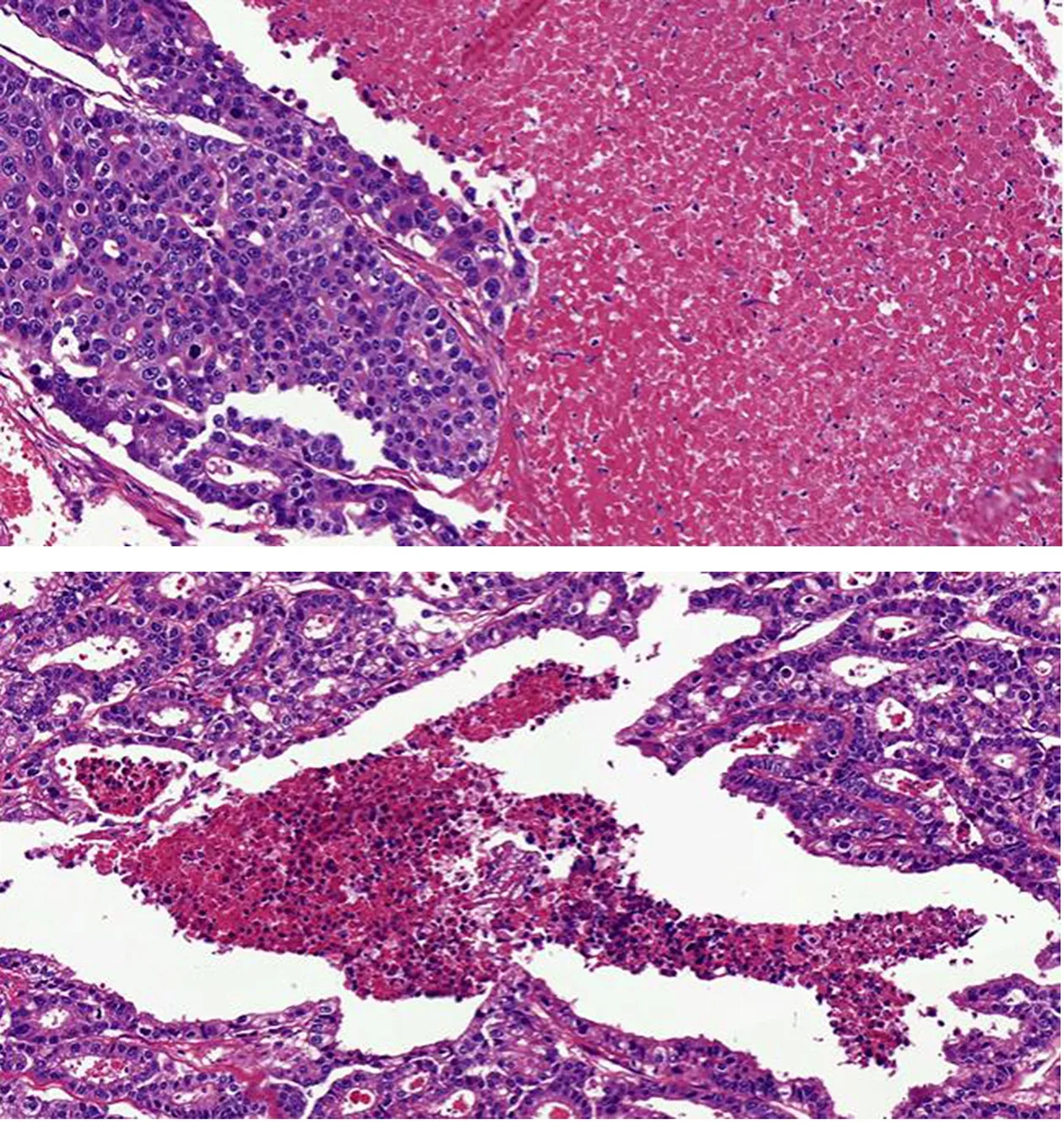
图2 AEG肿瘤源性坏死(HE,×200)
1.2 临床病理信息的规范
AEG患者的TNM分期依据2002年美国癌症联合会与国际抗癌联盟(AJCC-UICC)制定的第6版食管癌TNM分期标准,规范整理术后病理。高、低发区划分标准依据《食管癌》一书,根据中国食管癌流行病学调查结果,调整年龄与死亡率,死亡率50/10万以上地区为高发区,其余为低发区[1]。AEG组织病理类型根据WHO胃癌组织病理学分类标准(2019),组织病理学亚型最终由病理学专家和医院病理诊断确定。本研究中,AEG的组织病理学亚型被分为7种,包括管状腺癌、黏液腺癌、低分化腺癌、印戒细胞癌、神经内分泌癌、乳头状腺癌和肝样腺癌。
1.3 随访
本研究通过信件、电话(患者本人、家属或患者所在乡村的医生)和入户调查的方式进行随访。患者出院后第一年内每3月随访1次,第二年起每年随访1次。随访起始时间为患者的病理确诊时间,生存期为确诊至终点事件(死亡)或末次随访(2021年6月)所经历的时间。
1.4 统计学方法
2 结果
2.1 AEG肿瘤源性坏死的临床病理特征分布
1 406例发生肿瘤源性坏死的AEG患者,平均年龄(61.9±8.9)岁,男女比4.2∶1(1 134/272),男性患者年龄(61.9±8.7)岁,女性患者年龄(61.8±9.7)岁;高发区是低发区的2.5倍(1 002/404);家族史阴性的患者占比高于家族史阳性的患者(55.05% VS 32.01%);肿瘤源性坏死的AEG患者中吸烟占比大于不吸烟的患者(44.95% VS 34.85%),不饮酒的患者占比大于饮酒患者(48.93% VS 30.37%)。
AEG组织病理亚型中,低分化腺癌发生肿瘤源性坏死占比最大(54.27%),其次是管状腺癌、黏液腺癌、乳头状腺癌、印戒细胞癌、神经内分泌癌和肝样腺癌(分别是12.09%、6.97%、2.49%、2.56%、0.85%和0.28%);浸润深度中T3占比为69.00%,其次是T4、T2、T1(分别是21.84%、6.54%、1.64%);AEG发生肿瘤源性坏死中发生淋巴结转移是未发生淋巴结转移的2.4倍(980/404);病理分期中以Ⅲ期为主(68.42%),其次是Ⅱ期、Ⅳ期、Ⅰ期(占比分别是27.17%、2.21%、1.14%)。

表1 AEG肿瘤源性坏死患者临床特征分布
2.2 AEG肿瘤源性坏死患者的生存分析
发生肿瘤源性坏死的AEG患者的中位生存时间是2.5 a(95%CI:2.3~2.6);5 a生存率是25.0%。见图3。
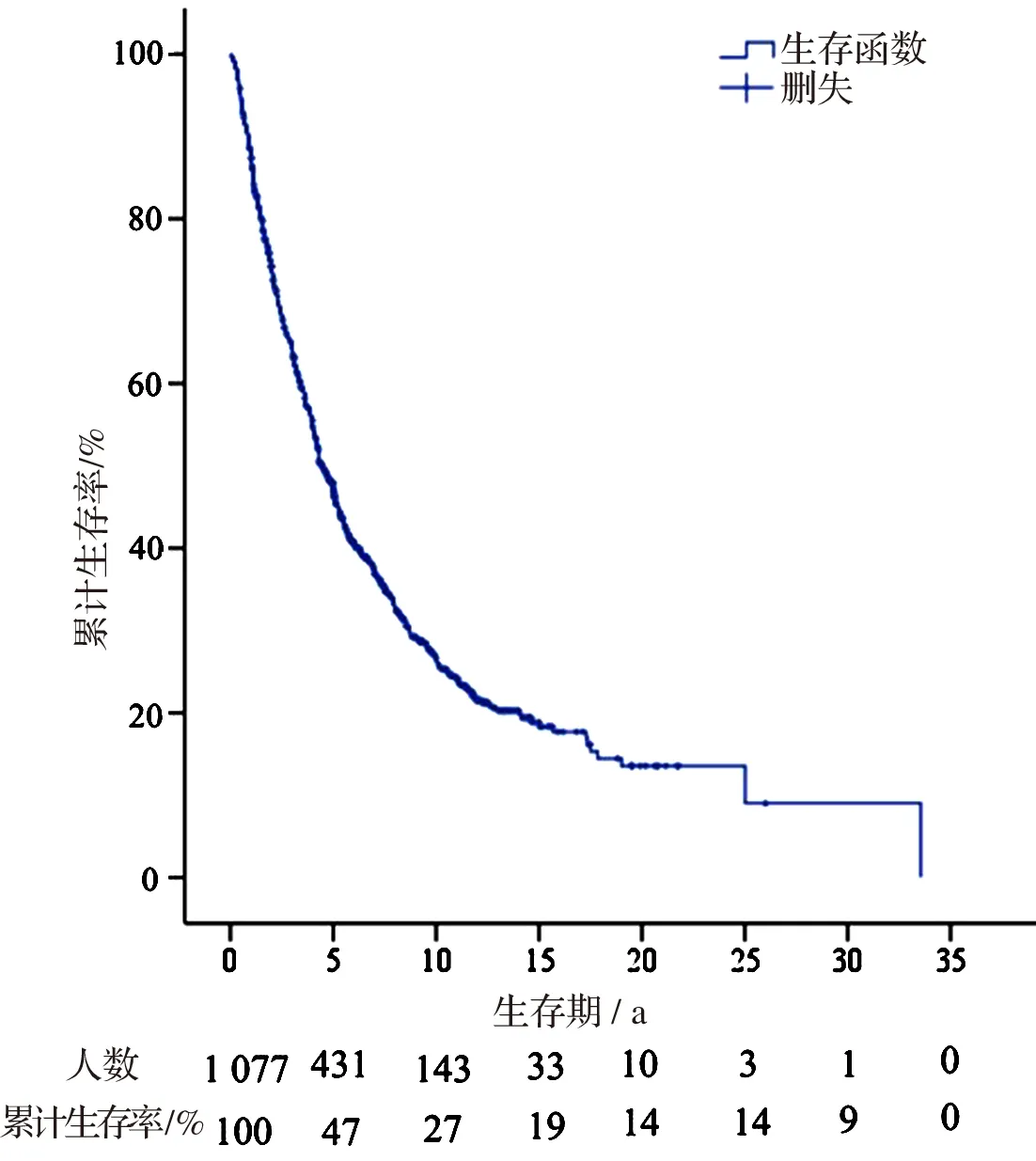
图3 发生肿瘤源性坏死的AEG患者生存曲线
2.3 AEG肿瘤源性坏死患者不同分期及病理亚型的生存分析
AEG肿瘤源性坏死患者不同分期之间的生存时间差异有统计学意义(P<0.001),结果见图4;不同病理亚型之间的生存时间没有差异(P=0.133),结果见图5。
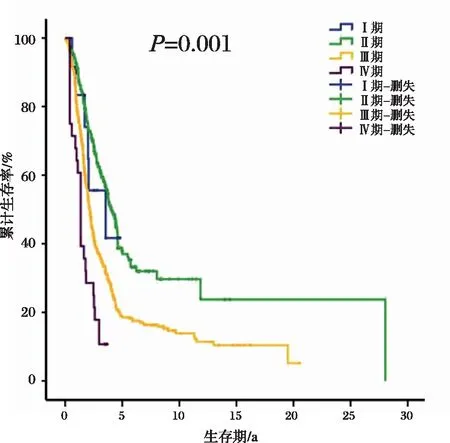
图4 AEG肿瘤源性患者病理分期分层下的生存曲线
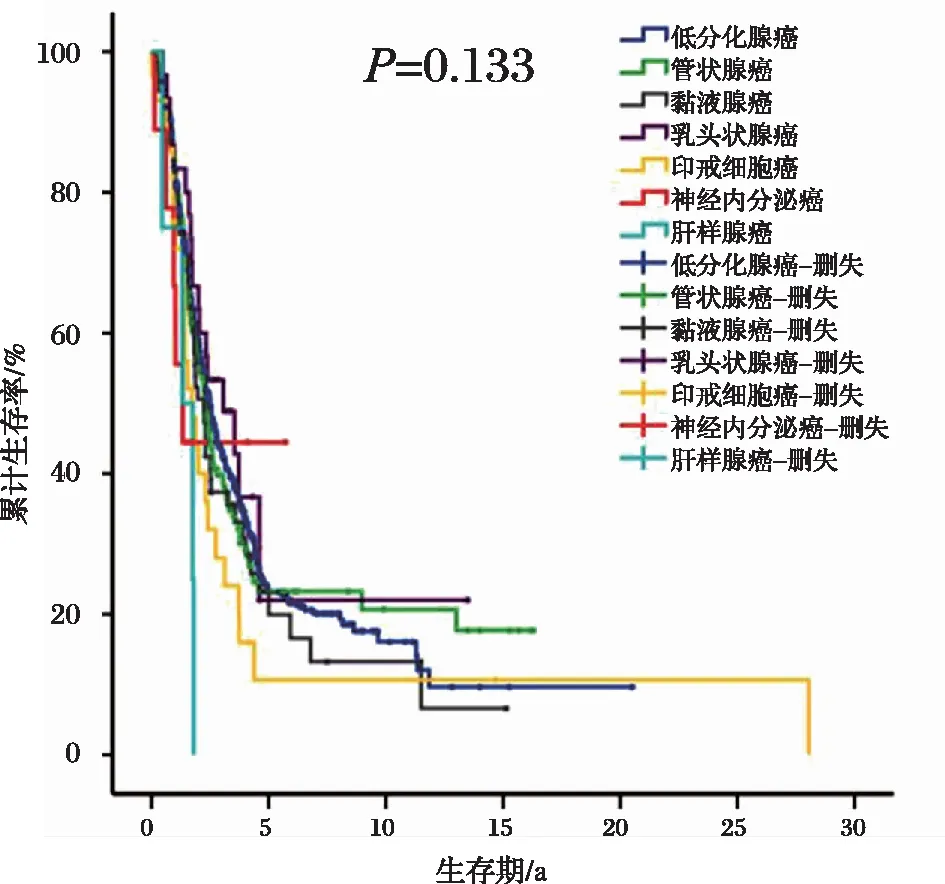
图5 AEG肿瘤源性患者病理亚型分层下的生存曲线
3 讨论
AEG是消化系统常见的恶性肿瘤[2]。非贲门腺癌的发病率和死亡率在过去几十年中显著下降,与之不同的是,AEG在发展中国家和发达国家的发病率都有所上升[3-4],AEG的防治研究也备受关注。肿瘤源性坏死与一些肿瘤的预后相关,可能成为未来肿瘤靶向治疗的潜在热点。肿瘤源性坏死是AEG常见的病理特征,本研究系统地阐述了发生肿瘤源性坏死的AEG患者的临床病理特征及其预后情况。
值得注意的是,在发生肿瘤源性坏死的AEG中,不同病理亚型所占比例有很大的差别。其中低分化腺癌最容易发生肿瘤源性坏死,其次是管状腺癌、黏液腺癌、乳头状腺癌、印戒细胞癌、神经内分泌癌和肝样腺癌。本研究对不同的病理亚型做了生存分析,这7种亚型的生存没有差异,然而以往的研究表明,分化程度是AEG预后的独立影响因素[5],这也从侧面说明肿瘤源性坏死可能是影响AEG预后的因素。按照病理分级进行生存的分层分析显示,不同病理分级的生存差异有统计学意义(P<0.05),说明肿瘤性坏死对生存的影响小于病理分级。
肿瘤源性坏死诱导的炎症对肿瘤的生长具有刺激作用,肿瘤发展过程中过度的自发坏死可能导致其更具侵袭性。肿瘤源性坏死的AEG患者总体生存曲线显示,5 a生存率仅25.0%,中位生存时间2.5 a(95%CI:2.3~2.6);一项前瞻性研究显示[6],AEG的总体5 a生存率为45.0%;说明存在肿瘤源性坏死的AEG患者的预后较差。
综上说明,肿瘤源性坏死可能是影响AEG预后的重要因素。肿瘤源性坏死是一个复杂过程,其与预后的价值在其他肿瘤中也有报道[7-12]。研究认为肿瘤源性坏死与许多病理过程有关,包括严重缺氧、炎症反应和血管生成,所有这些都有助于促进肿瘤生长和不良预后[13]。肿瘤源性坏死很可能成为AEG分级的重要参考指标,如肾脏嫌色细胞癌,研究表明肿瘤性坏死是肾脏嫌色细胞癌生存的独立影响因素[14]。有学者将肿瘤性坏死与3级分类法相整合,提出肾脏嫌色细胞癌病理的4级分类方法,可以精准预测肾脏嫌色细胞癌患者的生存[15]。肿瘤源性坏死可以用放化疗等方法诱导,因此肿瘤坏死疗法已经成为补充传统癌症疗法的有前途的抗癌策略。未来针对肿瘤源性坏死的靶向疗法将是AEG创新性治疗的研究热点。
本研究阐述了AEG肿瘤源性坏死的临床病理特征,关于肿瘤源性坏死对AEG预后的影响及其发生机制,是否能成为AEG治疗的潜在靶点,还需更多研究。今后有必要开展多中心、大样本以及多维组学的综合性研究,探索AEG肿瘤源性坏死的分子机制,为AEG的病理分级模型构建及靶向治疗提供理论依据。
