前入路肝右半切除术在肝癌中的应用价值
2022-04-18周兵张生苗志钊
周兵,张生,苗志钊
新乡医学院第一附属医院肝胆胰外科,河南 新乡 453100
原发性肝癌是一种隐匿性高、病死率高的常见恶性肿瘤,好发于40~49岁男性,与肝炎病毒感染及饮酒等密切相关,隐匿性较高,因此,治疗难度较大[1-3]。相关研究显示,中国肝癌病死率占全球的45%,每年高达11万例的患者因肝癌病死,病死率居消化系统恶性肿瘤第三位,严重危及患者的生命健康[4-5]。目前,针对无手术禁忌证的患者,临床多以手术治疗,目前,肝切除术是肝癌患者的首选治疗方式,效果显著,但对于错失了手术时机的患者,可采用介入治疗、免疫治疗、靶向治疗及化疗等方法治疗[6]。目前,对于肝癌右半肝切除术患者,常规入路肝切除术应用较为广泛,离断肝周韧带,游离右半肝后切除,但术中易造成挤压肿瘤播散、肝脏旋转缺血、视野不清、游离过程出血等并发症。研究显示,与传统入路肝切除术相比,前入路肝切除术可有效减少对肿瘤的挤压,减少游离过程中的出血量,结扎入肝血管后离断肝实质,离断右肝回流静脉,最后游离肝脏,应用价值较高[7-9]。本研究探讨前入路肝切除术在肝癌患者中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年1月新乡医学院第一附属医院收治的肝癌患者。纳入标准:①符合肝癌的诊断标准;②美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分为0~1分,Child-Pugh肝功能分级为A级,无手术禁忌证;③符合《原发性肝癌外科治疗方法的选择》[10]中肝癌切除的指征。排除标准:①病历资料不完整;②肝肿瘤不仅局限于右半肝。依据纳入和排除标准,本研究共纳入65例肝癌患者,根据治疗方式的不同将其分为对照组(n=32)和观察组(n=33),对照组患者给予常规入路肝切除术治疗,观察组患者给予前入路肝切除术治疗。对照组中男23例,女9例;平均年龄(52.69±2.41)岁;肿瘤直径(10.28±1.01)cm。观察组中男25例,女8例;平均年龄(51.25±2.17)岁;肿瘤直径(10.14±1.02)cm。两组患者性别、年龄和肿瘤直径比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 手术方法
对照组患者给予常规入路肝切除术治疗,患者取仰卧位,气管插管全身麻醉,常规消毒,做反L形切口入腹,游离肝周韧带,使右肝游离,结扎切断右侧部分肝短静脉,阻断第一肝门,切除右半肝。
观察组患者给予前入路肝切除术治疗,实施气管插管全身麻醉,给予前入路半肝切除术。做反L形切口,充分显露肝中静脉及肝右静脉根部,暴露困难时向剑突延长切口,必要时切除剑突,充分暴露肝上静脉陷窝,于下腔静脉前予以直角血管分离1~2 cm。切除胆囊后,充分显露第一肝门,游离右肝动脉及右门静脉,切断并予以缝扎,切开后腹膜后,充分显露肝下腔静脉,结扎切断数支肝短静脉,将止血钳伸入尾状叶后方下腔静脉前方,于第二肝门已分离的间隙深入食指,作为导向,由此隧道穿过止血钳带出弹力带,弹力带由肝中及肝右静脉间隙穿出,悬吊肝脏。沿缺血线离断肝实质,离断右侧肝短静脉及右肝静脉,最后游离肝周韧带,移除标本,术毕。
1.3 观察指标和评价标准
①比较两组患者手术相关指标,包括平均出血量、术中大出血情况、输血情况、肿瘤破裂情况、手术时间、住院时间、术后下床时间、术后进食时间。②术前和术后7天,抽取两组患者空腹肘静脉血5 ml,离心取上层血清,-20℃保存待检,双抗体夹心酶联免疫法检测两组患者炎症因子水平,包括白细胞介素(interleukin,IL)-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),计算中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)。③术前和术后7天,采用赖氏比色法检测两组患者的肝功能指标,包括谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)。④比较两组患者术后并发症发生情况,包括腹腔感染、腹腔出血、胆瘘、肺部感染。
1.4 统计学方法
采用SPSS 20.0软件对所有数据进行分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 手术相关指标的比较
两组患者术中大出血情况、手术时间、术后下床时间、术后进食时间比较,差异均无统计学意义(P>0.05)。观察组患者平均出血量少于对照组,输血率和肿瘤破裂率均低于对照组,住院时间短于对照组,差异均有统计学意义(P<0.05)。(表1)
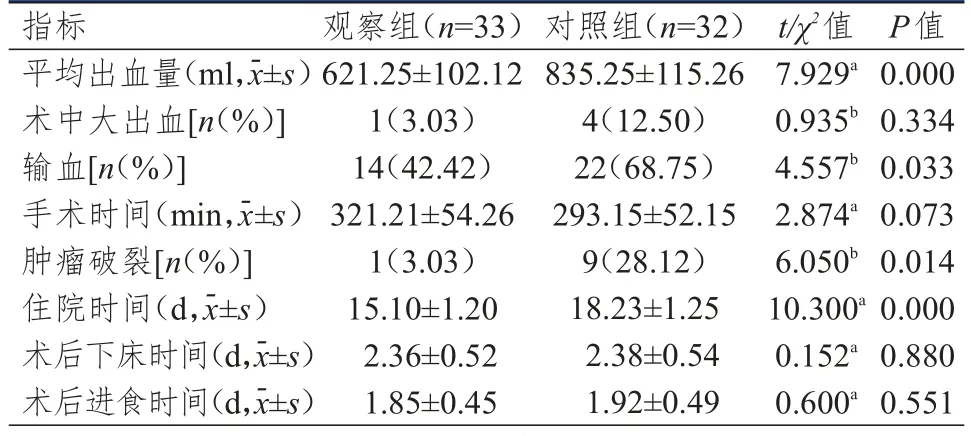
表1 两组患者手术相关指标的比较
2.2 炎症因子水平的比较
术前,两组患者IL-6、TNF-α、IL-8水平和NLR比较,差异均无统计学意义(P>0.05)。术后7天,两组患者IL-6、TNF-α、IL-8水平和NLR均高于本组术前,但观察组患者IL-6、TNF-α、IL-8水平和NLR均低于对照组,差异均有统计学意义(P<0.05)。(表2)
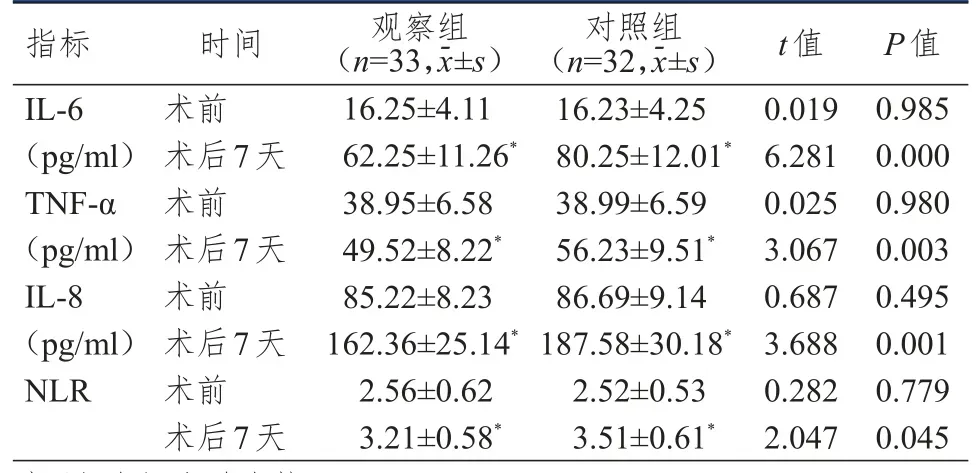
表2 手术前后两组患者炎症因子水平的比较
2.3 肝功能指标的比较
术前,两组患者AST、ALT水平比较,差异均无统计学意义(P>0.05)。术后7天,两组患者AST、ALT水平均高于本组术前,但观察组患者AST、ALT水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)

表3 手术前后两组患者肝功能指标的比较
2.4 并发症发生情况的比较
两组患者腹腔感染、腹腔出血、胆瘘、肺部感染并发症发生率比较,差异均无统计学意义(P>0.05)。(表 4)
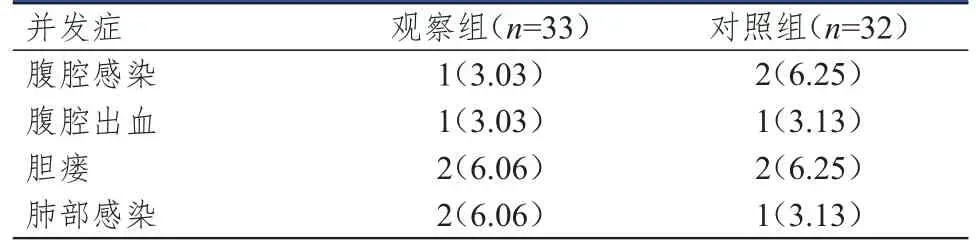
表4 两组患者术后并发症的发生情况[n(%)]
3 讨论
原发性肝癌具有恶性程度高、预后差、复发率高、病死率高等特点,且具有较强的隐匿性,可严重威胁患者的生命健康,手术治疗是目前延长患者生存期、改善临床症状的主要方法[11-12]。传统入路右半肝切除术治疗过程中,需先游离右半肝,游离过程中易造成肝短静脉及肿瘤破裂性出血,翻转肝脏易挤压肿瘤,易造成血源性肿瘤播散,同时增加肝脏血供不足的风险[13-14]。前入路肝切除术则是在阻断重要血管后,沿缺血线依次离断肝实质、肝静脉、肝周韧带,减轻了肿瘤播散及出血风险;此外,肝静脉出血是导致术中大出血的危险因素,术中悬吊肝脏可将下腔静脉与肝脏分离,引导离断肝实质,在良好暴露下处理肝静脉,减少了出血量[15-16]。
相关研究表明,多种慢性炎症因子参与了原发性肝癌的发生发展过程,由肝炎发展至肝硬化,最终进展至肝癌[17]。因此,本研究结果显示,术后7天,两组患者IL-6、TNF-α、IL-8水平和NLR均高于本组术前,且观察组均低于对照组,与张明华等[18]的研究结果类似。表明传统入路治疗及前入路治疗均会对机体产生机械性刺激,但前入路对机体的应激反应较小,炎症因子水平升高的程度较低。IL-6可对抗体的合成有一定的刺激,多由巨噬细胞产生。IL-8可作为上皮-间充质转化因子参与炎症反应通路,从而影响肝癌的发生。TNF可针对肿瘤细胞产生“灭火”作用,同时调节免疫功能,促进肿瘤细胞的灭火与消除。中性粒细胞是一种促进肿瘤新生血管生成的重要组成因子,通过调节T细胞水平发挥抗肿瘤作用,NLR升高表明患者的预后较差[19-20]。手术过程中,机械创伤会对机体产生刺激,诱发应激反应,同时促进炎症因子水平升高,传统的手术方式对肿瘤的挤压及搬动频繁,而前入路手术首先对重要血管予以阻断,先离断肝实质再游离肝脏,显著降低了应激反应[21-22]。
本研究结果显示,两组患者腹腔感染、腹腔出血、胆瘘、肺部感染发生率均无明显差异。表明前入路治疗可有效降低肝癌患者的术中出血量及输血率,且不增加并发症的发生风险。本研究结果显示,术后7天,两组患者AST、ALT水平均明显升高,但观察组低于对照组,观察组患者平均出血量少于对照组,输血率和肿瘤破裂率均低于对照组,住院时间明显短于对照组,与徐少强[23]的相关研究结果类似。表明前入路肝切除术对的肝脏的损伤程度较小,术中出血量少,有利于术后恢复。这可能是因为传统入路治疗过程中,部分肝脏解剖结构较深,手术难度较大,翻转、游离肝脏时易导致第一肝门血管受压,诱发供血不足,损伤肝功能;此外,翻转肝脏过程中,肿块的受压会增加肿瘤破裂及转移风险,患者的预后较差。前入路肝切除术首先阻断了重要血管,离断肝实质,结扎切断肝静脉,减小了翻转对肝脏的挤压,降低了手术对肝功的损伤及血供不足风险,此外,肝弹力带可引导断肝、减少术中出血量、缩短住院时间、减轻肝功能损伤,使ALT、AST水平升高幅度更小[24-25]。但本研究为回顾性研究,尚需进一步的前瞻性对照研究来进一步验证。
综上所述,前入路右半肝切除术可有效减轻肝癌患者的炎症反应,改善肝功能指标,促进术后恢复。
