红细胞分布宽度与白蛋白比值对急性呼吸窘迫综合征预后的预测价值
2022-04-16许路阳张国俊
许路阳 李 靖 张国俊
郑州大学第一附属医院呼吸与危重症医学科,河南郑州 450052
急性呼吸窘迫综合征(acute respiratory distress syn-drome,ARDS)是各种因素引起的,表现为一周以内出现的进行性呼吸困难及难治性低氧血症为主的临床综合征。ARDS 预后差,中重度ARDS 患者死亡率达45%[1-3]。因此,寻找有效的预后标志物,对临床治疗尤为重要。ARDS 与全身炎症反应及氧化应激密切相关[4]。红细胞分布宽度(red blood cell distribution width,RDW)可反映体内炎症及氧化应激的程度[5-6]。RDW 与多种疾病的预后相关[7-8],包括ARDS。白蛋白(albumin,ALB)影响血浆胶体渗透压及肺血管通透性,可监测ARDS 的严重程度并与预后相关[9-10]。红细胞分布宽度与白蛋白比值(RDW/ALB ratio,RAR)可同时反映疾病的炎症反应程度及营养状况,RAR 作为一种新的预后指标已被证实与乙型肝炎肝硬化及冠心病患者的预后相关[11-12],而其与ARDS 预后相关性的研究较少。本研究主要研究RAR 对ARDS 患者预后的预测价值。
1 资料与方法
1.1 一般资料
选取2019 年10 月至2020 年10 月就诊于郑州大学第一附属医院重症监护病房(intensive care unit,ICU)的ARDS 患者。纳入标准:符合2012 年的柏林定义[13],即在已知诱因后,新出现的或原有呼吸系统症状加重后1 周内发病;胸部影像学上出现双肺透亮度减低且不能完全用胸腔积液、肺不张及肺结节来解释;肺水肿的原因,不能用心力衰竭及液体负荷过多解释的呼吸衰竭,如没有危险因素,需要客观评估(如超声心动图)以排除静水压升高引起的肺水肿;出现低氧血症。排除标准:年龄<18 岁;中重度贫血(血红蛋白<60 g/L);血液系统肿瘤;ICU 住院时长<48 h;严重肝肾功能不全;临床资料不完整。本研究为回顾性研究,患者信息均为匿名。
1.2 数据收集
收集的资料包括性别、年龄、基础疾病(外科术后、重症肺炎、脓毒症)、实验室检查[RDW、ALB、中性粒细胞与淋巴细胞计数比值(neutrophil-to-lymphocyte ratio,NLR)]、乳酸、降钙素 原(procalcitonin,PCT)、血尿素氮(blood urea nitrogen,BUN)、降钙素原与白蛋白比值(PCT/ALB ratio,PAR)、急性生理学与慢性健康状况(acute physiology and chronic health evaluation,APACHEⅡ)评分、28 d 转归情况等。实验室检查为入ICU 24 h 内的最差值。
1.3 统计学方法
采用SPSS 21.0、Medcalc 19.0 及GraphPad Prism 8.3.0 软件对所得数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验。不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,采用Mann-Whitney U 检验。计数资料以例数或百分比表示,采用χ2检验。Cox 回归分析28 d 死亡的危险因素,受试者操作特征曲线(receiver operating characteristic curve,ROC)计算曲线下面积(area under the curve,AUC)评价RAR 的预测价值,Kaplan-Meier 法绘制生存曲线。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组基线资料比较
纳入ARDS 患者105 例,死亡组59 例,生存组46 例,28 d 死亡率为56.19%。死亡组年龄、APACHEⅡ评分、乳酸、RDW、BUN、PCT、NLR、RAR、PAR 高于生存组,ALB 低于生存组,差异有统计学意义(P <0.05)。见表1。
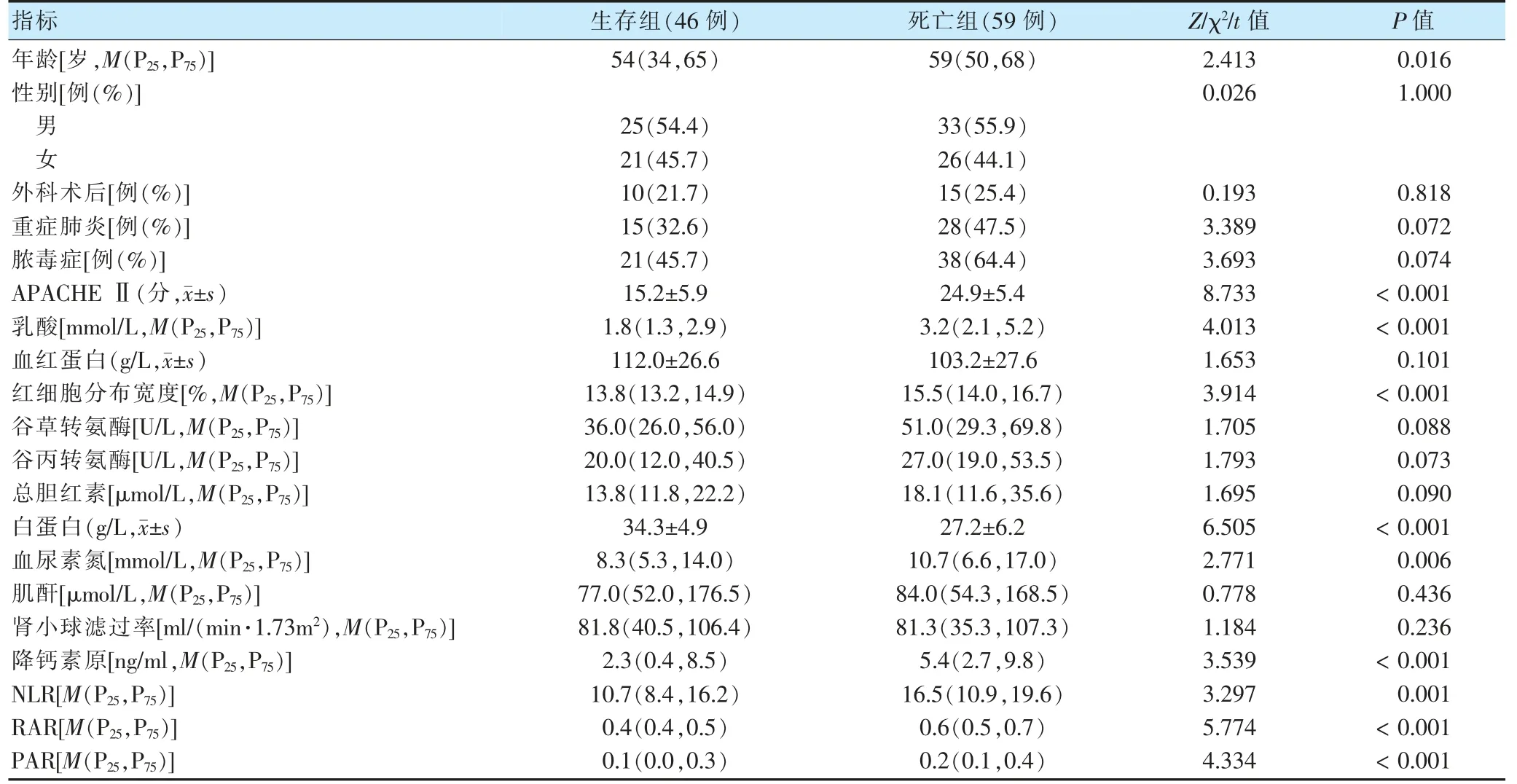
表1 生存组与死亡组基本资料比较
2.2 28 d 死亡的单因素与多因素Cox 回归分析
将差异有统计学意义(P <0.05)的变量进行单因素Cox 回归分析,发现年龄、乳酸、RDW、ALB、PCT、RAR、PAR 与患者28 d 死亡相关(P <0.05)。把单因素分析有统计学意义(P <0.05)的变量纳入多因素分析,共线性分析发现RAR(VIF=15.23)、PCT(VIF=19.64)、PAR(VIF=22.20)与各变量间存在共线性,由于RAR 由RDW 与ALB 构 成,PAR 由PCT 与ALB构成,删除RDW、ALB 及PCT 后各变量间不存在共线性。将年龄、乳酸、RAR、PAR 纳入COX 多因素回归分析发现,RAR 是患者28 d 死亡的独立危险因素(HR=3.06,P <0.05)。见表2。
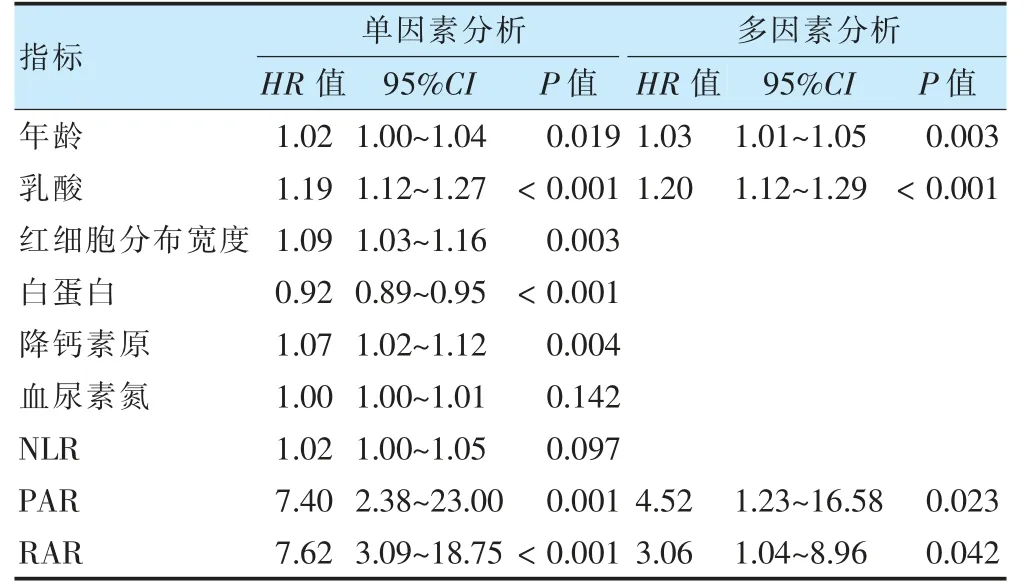
表2 28 d 死亡率的单因素与多因素Cox 回归分析
2.3 28 d 死亡的预测因子
采用年龄、乳酸、RAR、PAR 及各项联合进行ROC分析见图1~2。联合年龄、RAR、PAR 的ROC 分析显示AUC 为0.826(95%CI:0.740~0.893,P <0.001),再联合RAR 后发现AUC 增大为0.899(95%CI:0.824~0.949,P <0.001),差异有统计学意义(Z=2.480,P=0.013)。见表3。

表3 各指标预测28 d 死亡率的ROC 分析
3 讨论
ARDS 是呼吸系统危重症,中重度的患者死亡率达45%[1]。因此早期识别危重患者,尽早实施干预降低死亡率尤为重要。临床多利用APACHE Ⅱ[14]等评分判断疾病预后,但该评分复杂且花费大,本研究采用计算简便、经济的指标预测ARDS 的预后。
ARDS 是肺内炎症性疾病,组织病理学表现为急性炎症反应导致肺泡毛细血管屏障破坏,继而出现水肿、炎症细胞聚集、透明膜形成及间质纤维化[15-17]。研究发现在脂多糖诱导的ARDS 小鼠模型中,激活沉默信息调节因子1 可缓解ARDS 小鼠肺部的氧化应激及炎症反应,减轻肺损伤的程度[18]。因此炎症反应及氧化应激在ARDS 的发生发展中起着重要作用。
RDW 是反映红细胞体积分布的指标,可反映体内炎症反应的程度[19]。ARDS 全身炎症反应及氧化应激可影响RDW 的大小,但目前缺乏研究证实两者间病理生理机制。研究发现全身炎症反应及其释放的细胞因子可影响骨髓的造血功能、红细胞内铁代谢及红细胞的成熟,导致RDW 升高[20]。氧化应激会降低红细胞的寿命,将一些大的未成熟的红细胞释放到外周血,使RDW 升高[21]。因此RDW 可反映ARDS 体内的炎症反应及氧化应激程度,从而预测其预后。ALB 可反映患者营养状况,也是血浆胶体渗透压的主要决定因素[22]。ARDS 肺泡毛细血管屏障破坏,血管壁通透性增高,患者出现低蛋白血症时,血浆胶体渗透压降低,加剧了肺泡腔及肺间质的水肿,加重了肺损伤。研究发现ALB 与ARDS 肺损伤程度呈负相关,可能与其能维持血浆胶体渗透压、血流动力学稳定及缓解氧化应激相关[9]。因此ALB 可通过多种途径影响ARDS 的预后。
RAR 是RDW 与ALB 的比值,可同时反映ARDS全身炎症反应程度及营养状况,相比于单一的RDW[23]、ALB[22],RAR 可较为全面地反映疾病发展状态。本研究发现死亡组的RAR 高于生存组,多因素COX 回归分析提示,RAR 与ARDS 预后独立相关,且不受年龄、乳 酸、PAR 影 响。ROC 分 析 显 示RAR 的AUC 为0.829,提示RAR 对ARDS 28 d 预后有较好的预测价值,进一步联合年龄、乳酸、PAR、RAR 进行ROC 分析,发现与不联合RAR 时比较,AUC 显著增加,证实了RAR 的预测价值。PAR[24]也可反映ARDS 的炎症反应程度,但ROC 分析显示RAR 的AUC 较大,预测效果较好。乳酸可作为脓毒症的预后指标[25],本研究中多因素COX 回归分析发现,乳酸是ARDS 患者28 d 死亡的独立危险因素,但乳酸的AUC 低于RAR。相较于APACHE Ⅱ等一些复杂的评分系统,RAR 需要的计算指标较少且为入院常规检查。另外RDW 与ALB会受到贫血及肝肾功能的影响,本研究排除了中重度贫血、血液系统肿瘤及严重肝肾功能不全的患者,且生存组与死亡组的血红蛋白、肝肾功能比较,差异无统计学意义(P >0.05),减少了误差。因此,RAR 作为ARDS 患者的预后指标有一定的临床实用价值,可为临床医师决策提供参考。
本研究存在一定的局限性,本研究为单中心回顾性研究,样本量较少且随访期短,且未进行根据病因分类的亚组分析。RAR 由入ICU 24 h 内的最差值计算所得,没有监测其连续变化的过程及趋势。
综上所述,RAR 是ARDS 患者28 d 死亡的独立危险因素,对ARDS 患者28 d 死亡率有较好的预测价值,RAR>0.50 的ARDS 患者28 d 死亡率更高。
