加载MAGE-A10/hβD-2 双基因溶瘤病毒对膀胱癌细胞增殖及肿瘤生长的影响
2022-04-14张建军蔡龙俊蔡维奇
张建军 蔡龙俊 蔡维奇
1.江苏师范大学科文学院,江苏徐州 221132;2.徐州医科大学附属宿迁医院暨南京鼓楼医院集团宿迁医院泌尿外科,江苏宿迁 223800
膀胱癌是泌尿系统中常见的恶性肿瘤[1]。近年来,膀胱癌的发病率和病死率呈上升态势[2-3]。在中国,膀胱癌仍是发病率最高的泌尿生殖系肿瘤[3-5]。以溶瘤病毒为基础的免疫治疗近期在膀胱癌治疗中取得了较大的进展[6-7]。
黑色素瘤相关抗原A10(melanoma-associated antigen A10,MAGE-A10)是一种肿瘤相关抗原,可作为膀胱肿瘤特异性免疫治疗的新靶点[8]。人β 防御素2(human beta defensin 2,hβD-2)被认为是人体内环境对外来病原微生物免疫的第一道防线[9]。应用hβD-2的基因治疗能够介导抗肿瘤免疫,发挥抗肿瘤作用[10]。溶瘤病毒SG502 对膀胱癌具有较高靶向性的,其加载了人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)启动子和缺氧诱导因子-1(hypoxiainducible factor 1,HIF-1)启动子[11]。在溶瘤病毒SG502的基础上,本课题组应用PCR 技术将MAGE-A10 和hβD-2 基因片段成功连接到质粒pSG502 中,并将获得的特异性溶瘤腺病毒命名为SG502-MAGE-A10-hβD-2。
本研究拟探究SG502-MAGE-A10-hβD-2 对膀胱癌细胞增殖及肿瘤生长的影响。
1 材料与方法
1.1 实验细胞及实验动物
人膀胱癌细胞系T24、鼠膀胱癌细胞系MB49、人黑色素瘤细胞系LiBr 及人胚肾细胞系HEK293 购于中国科学院上海细胞库。6~7 周龄清洁级C57BL/6 雄性小鼠购自济南朋悦实验动物繁育有限公司,体重18~22 g,许可证号:SCXK(鲁)20190003,合格证号:1107262011002579。本课题动物实验经徐州医科大学动物实验伦理中心批准(批准号:xz2020050903L)。
1.2 主要试剂及仪器
溶瘤病毒SG502 及质粒pSG502 购自上海肝胆外科医院病毒与基因治疗中心。质粒pUC57(B522201)、病毒骨架质粒pPE3(B6100016)、胶回收试剂盒(SK8131)、质粒小样提取试剂盒(B519196-0010)购自上海生物工程公司。DNA 连接酶(2011A)、限制性内切酶(1068A)购自TaKaRa 公司。CCK-8 试剂盒(MA0218)购自大连美仑生物公司。hβD-2 抗体购自Abcam 公司(ab243124)、MAGE-A10 抗体购自Abnova 公司(PAB4741)。Ki67 抗体(GB11030)、β-actin 抗 体(GB11001)、HRP DAB 染色试剂盒(GB1212)购自武汉谷歌生物科技公司,小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,Ek-M21257)、γ 干扰素(interferon-γ,IFN-γ,Ek-M2014)酶联免疫吸附试验法(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Bioscience 公司。
PCR 仪(北京东胜科技公司,东胜龙ETC811),电泳仪及电泳装置(北京六一仪器厂,DYY-6型及DYCP-31DN)、酶标仪(TECAN 公司,infinite 200)、电泳跑胶系统(伯乐公司,1658033)、电子天平(花潮高科公司,精度0.1 mg,FA2004G).
1.3 细胞培养及动物饲养
将LiBr 及HEK293 细胞培养在含有10%FBS 及青、链霉素的DMEM 细胞培养液中,T24、MB49 细胞培养于含有10%FBS 及青、链霉素的RMPI-1640 细胞培养液中,置于37℃、5%CO2的恒温培养箱中常规培养传代。C57BL/6 小鼠分笼饲养于清洁级条件下的层流架中,饲养条件25~28℃,相对湿度40%~60%。
1.4 溶瘤腺病毒SG502-MAGE-A10-hβD-2 的构建及鉴定
从LiBr 细胞中提取总RNA;根据MAGE-A10 基因序列设计1 对引物(P1:5’-ACACTCCCACCTGCTACCC-3’,P2:5’-CATGTGGTATTTGACTTGCCT-3’),行PCR 扩增后,得到大小约1260 bp DNA 片段。用EcoRV 酶切pUC57 质粒,将目的基因的PCR 产物与pUC57 载体酶切产物进行连接,得到pUC57-MAGEA10 质粒。从膀胱组织中提取总RNA;根据hβD-2 基因序列设计1 对引物(P1:5’-TGAAGCTCCCAGCCATCAGCCATP -3’,P2:5’ -TGGACACCATAGTTTAA -TTTGG-3’),行PCR 扩增后,得到大小约311 bp DNA片段。用EcoRV 酶切pUC57 质粒,将目的基因的PCR 产物与pUC57 载体酶切产物进行连接,得到pUC57-hβD-2 质粒。分别提取质粒电泳及双酶切鉴定,并由安徽通用系统有限公司测序确认插入产物。
应用PCR 技术将引入SpeⅠ和SalⅠ酶切位点的MAGE-A10 和hβD-2 基因片段连接到经SpeⅠ和SalⅠ双酶切后的质粒pSG502 中,将鉴定正确的特异性溶瘤病毒载体命名为PSG502-MAGE-A10-hβD-2。
将特异性溶瘤病毒载体PSG502-MAGE-A10-hβD-2 与病毒骨架质粒pPE3 共转染至HEK293 细胞,共转染后9~14 d 出现病毒空斑,经过3 次病毒空斑纯化,提取溶瘤病毒DNA,应用PCR 进行鉴定,经鉴定正确的溶瘤病毒命名为SG502-MAGE-A10-hβD-2。反复扩增至需要病毒量,半数组织培养感染剂量法测定病毒滴度。实验重复3 次。
1.5 CCK-8 法检测细胞增殖
取96 孔板,将对数生长期的T24、MB49 细胞按5×103个/孔接种,每孔100 μl,每组设置4 个复孔。SG502组加入SG502 病毒(MOI 为10),SG502-MAGE-A10-hβD-2 组加入SG502-MAGE-A10-hβD-2 病毒(MOI为10),对照组加入PBS,分别培养24、48、72、96 h。加入CCK-8 试剂后用酶标仪检测在450 nm 处的光密度(optical density,OD)值,计算细胞成活率。细胞成活率(%)=(实验组OD 值/对照组OD 值)×100%。实验重复3 次。
1.6 溶瘤病毒对鼠膀胱癌肿瘤的作用
C57BL/6 小鼠适应性饲养1 周后,PBS 将用胰蛋白酶消化下来的MB49 细胞制成浓度为1.5×107/ml细胞悬液,取0.2 ml 细胞悬液注射到每只小鼠的左前肢腋窝皮下,待肿瘤生长至100~150 mm3后将成瘤后的18 只C57BL/6 小鼠按照随机数字表法分成对照组、SG502 组及SG502-MAGE-A10-hβD-2 组,每组各6 只。对照组、SG502 组、SG502-MAGE-A10-hβD-2 组每周2 次分别给予50 μl 生理盐水、含有2×108个病毒颗粒数的SG502 病毒的50 μl 生理盐水溶液、含有2×108个病毒颗粒数的SG502-MAGE-A10-hβD-2 病毒的50 μl 生理盐水溶液进行瘤内多点注射,连续5 周,测量成瘤体积以观察各组荷瘤小鼠肿瘤生长曲线。
1.7 ELISA 检测小鼠血清TNF-α 及IFN-γ 水平
实验结束1 d 后,脱颈处死小鼠,摘除眼球法取血,并应用酶联免疫吸附试验法检测小鼠血清TNF-α及IFN-γ。取出瘤体组织,剥离纤维包膜后在电子天平上称取瘤重,计算抑瘤率。抑瘤率(%)=(1-药物组肿瘤重量/对照组肿瘤重量)×100%。
1.8 Western blot 检测MAGE-A10 及hβD-2 蛋白的表达
肿瘤组织PBS 洗净,每20 毫克组织加入200 μl蛋白裂解液,在酶标仪上,用BCA 试剂盒检测并计算出各组蛋白的浓度,采用SDS-PAGE 电泳的方法转膜。快速封闭液常温封闭10 min,4℃条件下用MAGEA10(1∶1000)及hβD-2(1∶1000)一抗孵育过夜;再经山羊抗兔二抗(1∶5000)常温条件孵育1 h,ECL 显色,在化学发光成像系统中拍摄照片,并分析灰度值。实验重复3 次。
1.9 小鼠成瘤组织Ki67 的免疫组化检测
将石蜡包埋的对照组、SG502 组、SG502-MAGEA10-hβD-2 组肿瘤样品进行脱蜡,然后在过氧化氢中孵育以阻断辣根过氧化物酶。在柠檬酸盐缓冲液中进行抗原回收后山羊血清封闭,在4℃下将切片用一抗Ki67(1∶300)孵育过夜,孵育山羊抗兔二抗(1∶200),DAB 染色液显色,将切片用苏木精复染。将待测样本在400 倍镜下随机选取5 个视野,利用Image J 软件对实验结果进行定量分析,分别进行平均OD 值测定,计算其均值。
1.10 统计学方法
采用SPSS 22.0 软件对所得数据进行统计学分析,计量资料采用均数±标准差()表示,多组间比较在方差齐时采用One-way ANOVA 分析,方差不齐时应用非参数检验。重复测量资料应用重复测量资料方差分析,并进行球形检验,若不符合球形检验则结果进行Greenhouse-Geisser 校正。以P <0.05 为差异有统计学意义。
2 结果
2.1 溶瘤病毒克隆的鉴定及病毒滴度的测定
PCR 鉴定结果见图1,溶瘤病毒SG502-MAGEA10-hβD-2 扩增出约311 及1260 bp 的特异性片段,而阴性对照(ddH2O)未扩增出片段,提示所得的病毒即为携带MAGE-A10 及hβD-2 基因的溶瘤腺病毒SG502-MAGE-A10-hβD-2。应用半数组织培养感染剂量法测得纯化后病毒滴度为2.05×1010PFU/ml。
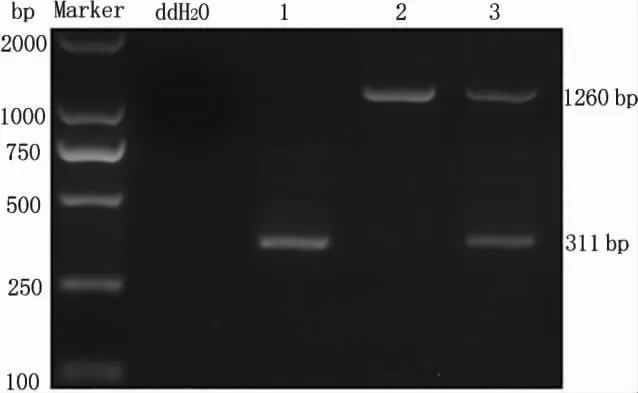
图1 溶瘤病毒的PCR 鉴定(n=3)
2.2 各组对T24 及MB49 细胞增殖的影响
整体分析发现:SG502 组T24 及MB49 细胞抑制率与对照组组间比较、时间点比较及交互作用,差异均有统计学意义(P <0.05)。提示SG502 病毒可抑制T24 及MB49 细胞的增殖。进一步两两比较,组内比较:SG502 组组内各时间点的T24 及MB49 细胞抑制率比较,差异均有统计学意义(P <0.05);组间比较:SG502组与对照组24、48、72、96h的T24及MB49细胞抑制率比较,差异均有统计学意义(P<0.05)。整体分析发现:SG502-MAGE-A10-hβD-2 组T24及MB49 细胞抑制率与SG502 组组间比较、时间点比较及交互作用,差异均有统计学意义(P <0.05)。提示SG502-MAGE-A10-hβD-2 病毒可抑制T24 及MB49细胞的增殖。进一步两两比较,组内比较:SG502-MAGE-A10-hβD-2 组组内各时间点的T24 及MB49细胞抑制率比较,差异均有统计学意义(P <0.05);组间比较:SG502-MAGE-A10-hβD-2 组与SG502 组24、48、72、96 h 的T24 及MB49 细胞抑制率比较,差异均有统计学意义(P <0.05)。见图2。
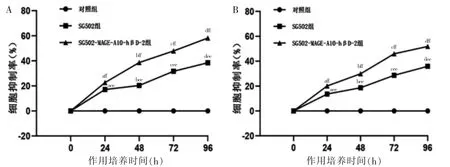
图2 各组对T24 及MB49 增殖的影响(n=3)
2.3 各组MB49 成瘤小鼠肿瘤生长比较
整体分析发现:SG502 组肿瘤体积与对照组组间比较、时间点比较及交互作用,差异均有统计学意义(P <0.05)。提示SG502 病毒病毒可抑制MB49 成瘤小鼠肿瘤生长。进一步两两比较,组内比较:SG502 组组内各时间点的肿瘤体积比较,差异均有统计学意义(P <0.05);组间比较:SG502 组与对照组14、21、28、35、42 d 的肿瘤体积比较,差异均有统计学意义(P <0.05)。整体分析发现:SG502-MAGE-A10-hβD-2 组肿瘤体积与SG502 组组间比较、时间点比较及交互作用,差异均有统计学意义(P <0.05)。提示SG502-MAGE-A10-hβD-2 病毒可抑制MB49 成瘤小鼠肿瘤生长。进一步两两比较,组内比较:SG502-MAGEA10-hβD-2 组组内各时间点的肿瘤体积比较,差异均有统计学意义(P <0.05);组间比较:SG502-MAGEA10-hβD-2 组与SG502 组14、21、28、35、42 d 的肿瘤体积比较,差异均有统计学意义(P <0.05)。见图3A。SG502 组及SG502-MAGE-A10-hβD-2 组肿瘤生长较对照组均受到抑制,SG502 组抑瘤率为35.33%,SG502-MAGE-A10-hβD-2 组抑瘤率为46.59%。SG502 组肿瘤重量均小于对照组,SG502-MAGEA10-hβD-2 组肿瘤重量均小于SG502组,差异均有统计学意义(P <0.05 或P <0.01)。见图3B。
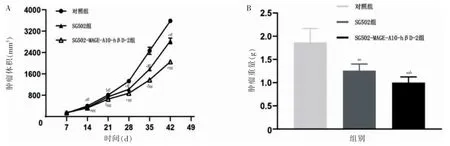
图3 各组MB49 成瘤小鼠肿瘤生长比较(n=6)
2.4 各组MB49 成瘤小鼠血清TNF-α、IFN-γ 水平比较
SG502 组TNF-α、IFN-γ水平均高于对照组,SG502-MAGE-A10-hβD-2 组TNF-α、IFN-γ 水平高于SG502 组,差异均有高度统计学意义(P <0.01)。见图4。
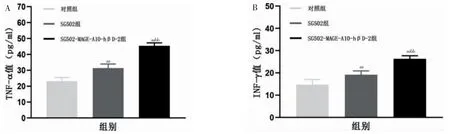
图4 各组MB49 成瘤小鼠血清TNF-α、IFN-γ 水平比较(n=6)
2.5 各组成瘤小鼠肿瘤中MAGE-A10 及hβD-2 的蛋白表达
各组成瘤小鼠干预5 周后,SG502-MAGE-A10-hβD-2 组小鼠肿瘤中有MAGE-A10 及hβD-2 蛋白表达,而对照组和SG502 组小鼠中未见MAGE-A10及hβD-2 蛋白表达。见图5。
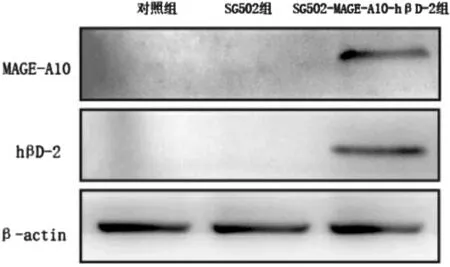
图5 各组小鼠肿瘤中MAGE-A10 及hβD-2 蛋白表达情况
2.6 各组肿瘤组织Ki67 表达情况比较
SG502 组及SG502-MAGE-A10-hβD-2 组肿瘤组织中的Ki67 表达低于对照组,差异有高度统计学意义(P <0.01)。见图6。

图6 各组肿瘤组织Ki67 表达情况比较(n=6)
3 讨论
溶瘤病毒治疗肿瘤可特异性地感染并杀伤肿瘤细胞,而对正常细胞不会造成过多的伤害[12-13]。目前全球已有160 多种溶瘤病毒正在进行临床前研究及临床试验[14],而在中国,有5 项临床试验正在进行[15]。溶瘤病毒拥有三大“杀手锏”,即直接溶瘤、打破免疫耐受和表达调控基因[6]。带有特异性启动子的溶瘤病毒因具有一定的肿瘤靶向性、多种抗肿瘤机制等优势,在膀胱癌研究中受到广泛的关注。溶瘤病毒CG0070已经用于膀胱癌的治疗,并且取得了一定的效果[7]。溶瘤病毒SG502-SEA 对小鼠膀胱癌肿瘤细胞有明显的杀伤作用[16-17]。
MAGE-A10 是肿瘤和睾丸抗原(cancer-testis,CT)家族的一个成员,在黑色素瘤、膀胱癌和肺癌中有阳性表达[18]。其在非肌层浸润性膀胱癌阳性表达中与肿瘤的分级呈正相关[8]。本课题组前期的研究表明:MAGE-A10 阳性表达的非肌层浸润性膀胱癌患者的肿瘤复发率更高,预后更差[19]。hβD-2 被认为是人体内环境对外来病原微生物免疫的第一道防线[9]。应用hβD-2 的基因治疗可介导抗肿瘤免疫,增强抗肿瘤作用[20]。本研究发现加载MAGE-A10 及hβD-2 双基因的溶瘤病毒SG502-MAGE-A10-hβD-2 可抑制T24及MB49 细胞的增殖,且对MB49 细胞成瘤小鼠肿瘤的生长具有抑制作用。
溶瘤病毒可激发机体自身的抗肿瘤免疫反应,使肿瘤微环境产生免疫原性,同时调节免疫抑制性肿瘤微环境[21-23]。TNF-α 具有抗感染与抗肿瘤作用[24]。而IFN-γ 具有免疫调节及重要的抗肿瘤作用[25]。本研究发现:SG502 组TNF-α、IFN-γ 水平均高于对照组,SG502-MAGE-A10-hβD-2 组TNF-α、IFN-γ 水平高于SG502 组,差异均有高度统计学意义(P <0.01)。提示溶瘤病毒SG502-MAGE-A10-hβD-2 具有抗肿瘤及免疫增强作用,其机制有待于进一步研究。
综上所述,SG502-MAGE-A10-hβD-2可抑制T24及MB49 细胞的增殖,抑制MB49 成瘤小鼠肿瘤生长,并可以刺激小鼠分泌TNF-α 及IFN-γ,以上研究结果为未来研究膀胱癌肿瘤疫苗提供了依据。
