碱性成纤维细胞生长因子对肿瘤坏死因子-α联合放线菌酮协同诱导的人软骨细胞损伤的保护作用及机制研究
2022-04-14熊成浩杨波唐道琪薛琦方海洲王菊芳
熊成浩 杨波 唐道琪 薛琦 方海洲 王菊芳
1.珠海亿胜生物制药有限公司,广东珠海 519085;2.亿胜生物科技有限公司,香港 999077;3.华南理工大学生物科学与工程学院,广东广州 510006
[关键字] 碱性成纤维细胞生长因子;软骨损伤;细胞凋亡;肿瘤坏死因子-α
骨关节炎(osteoarthritis,OA)是一种严重影响老年人健康关节性疾病[1-2],炎症及炎症引起的关节软骨损伤与骨关节炎的发生发展有着密切的联系[3-4]。近来的研究发现碱性成纤维细胞因子(basic fibroblast growth factor,bFGF)在软骨、神经及心肌修复等过程中扮演重要的角色[5-7]。尽管已有研究报道,bFGF 可以通过促进软骨细胞的生长,分化及胞外基质的合成修复损伤的软骨组织[8],但是bFGF 对炎症条件诱导的软骨细胞损伤是否具有保护作用目前并不明确,本研究旨在利用肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和放线菌酮(cycloheximide,CHX)联合诱导的体外软骨细胞炎症损伤模型,探究bFGF 对于软骨细胞在炎症环境下的保护作用及机制,为bFGF 在软骨损伤修复领域的应用提供了实验依据。
1 材料与方法
1.1 细胞培养
膝关节来源的人原代软骨细胞(4650)购自美国ScienCell 公司,采用人软骨细胞培养基(4651,Scien-Cell 公司)进行培养,本实验中所用细胞均使用P3 代细胞。
1.2 主要试剂和仪器
bFGF(珠海亿胜,批号:200505);TNF-α(南京金斯瑞生物科技股份有限公司,Z01001),凋亡试剂盒(BD,556547),JC-1 试剂盒(上海碧云天生物技术有限公司,C2006);MTT(Sigma,M5655);放线菌酮(上海翊圣生物科技有限公司,40325ES03);兔抗鼠Bcl-2和Bax 抗体(CST,3498T、5023T);二氧化碳培养箱(NuAire,NU-5810E);流式细胞仪(贝克曼,CytoFlex);化学发光曝光仪(GE;Amersham Imager 680)。
1.3 软骨细胞损伤模型的建立
96 孔板每孔接种1.0×104个细胞,待汇合度达到70%时弃去上清,给药组中加入含有1 μmol/L CHX及10、20、50 ng/ml TNF-α 的完全培养基,对照组加入100 μl 完全培养基(无CHX 及TNF-α)。将孔板放置到培养箱中继续培养48 h 后用MTT 法检测细胞活力。
1.4 细胞活力的检测
96 孔板每孔接种1.0×104个细胞,待细胞生长至汇合度达到70%时弃去上清,模型组加入含有1 μmol/L CHX 和50 ng/ml TNF-α 的完全培养基,bFGF 低剂量和高剂量给药组在模型组给药的基础上分别给予1 ng/ml 和10 ng/ml 的bFGF,对照组给予等体积的完全培养基,48 h 后用MTT 法检测细胞活力。
1.5 细胞凋亡的检测
12 孔板每孔接种1.0×105个细胞,待细胞汇合度达到70%时进行给药。给药组别的设置与“1.4”一致,药物处理48 h 后,使用流式检测试剂盒对各组细胞进行染色,随后采用流式细胞仪检测各组细胞的凋亡。
1.6 线粒体损伤的检测
12 孔板每孔接种1.0×105个细胞,细胞汇合度达到70%时进行给药。给药组别的设置与“1.4”一致,48 h 后收集细胞,JC-1 染色后采用流式细胞仪进行检测。
1.7 Bcl-2 和Bax 凋亡相关蛋白的检测
12 孔板每孔接种1.0×105个细胞,待细胞汇合度达到70%时进行给药,给药组别的设置与“1.4”一致,24 h 后用RIPA 裂解液充分裂解细胞后收集总蛋白提取液。对总蛋白进行电泳后转膜、封闭、孵育一抗和二抗、漂洗后进行显影,采用Image J 7.0 软件对蛋白条带的灰度值进行分析,以GAPDH 为内参,计算目标蛋白的相对表达量。
1.8 统计学方法
采用SPSS 18.0 软件对所得数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验或方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 TNF-α 联合CHX 诱导软骨细胞损伤的模型建立
1 μmol/L CHX 联合10、20、50 ng/ml TNF-α 的实验组软骨细胞活力[(72.85±9.38)%、(67.88±1.25)%、(56.95±4.82)%]低于对照组,差异有高度统计学意义(F=24.870,P <0.001)。当TNF-α 为50 ng/ml 时,细胞活力下降约一半,为较为适宜的诱导剂量。因此,采用1 μmol/L CHX 联合50 ng/ml 的TNF-α 建立软骨细胞损伤模型。
2.2 bFGF 对TNF-α/CHX 损伤的软骨细胞活力的影响
bFGF 低剂量和高剂量组的细胞活力[(77.34±7.23)%、(86.51±6.48)%]与模型组比较,差异有统计学意义(t=3.218,P <0.05;t=5.501,P <0.01)。见图1。

图1 不同给药组别软骨细胞的细胞活力比较(n=3)
2.3 bFGF 对TNF-α/CHX 损伤的软骨细胞凋亡的影响
与对照组比较,模型组凋亡率明显升高,差异有高度统计学意义(t=21.87,P <0.001),而bFGF 低剂量和高剂量组凋亡率低于模型组,差异有统计学意义(t=3.320,P <0.05;t=5.415,P <0.01)。见图2、表1。

图2 流式检测各给药组软骨细胞的凋亡情况
表1 不同组别软骨细胞凋亡率比较(%,,n=3)

表1 不同组别软骨细胞凋亡率比较(%,,n=3)
注 与对照组比较,aP <0.01;与模型组比较,bP <0.05,bbP <0.01。bFGF:碱性成纤维生长因子
2.4 bFGF 对软骨细胞线粒体损伤的影响
模型组细胞FITC 阳性细胞比率高于对照组,差异有高度统计学意义(t=15.41,P <0.001)。而bFGF的给药可以降低FITC 的阳性细胞比率,高剂量bFGF 组FITC 阳性细胞比率低于模型组,差异有高度统计学意义(t=6.684,P <0.01)。见图3、表2。
表2 不同组别细胞JC-1 染色后FITC 阳性细胞比率比较(%,,n=3)

表2 不同组别细胞JC-1 染色后FITC 阳性细胞比率比较(%,,n=3)
注 与对照组比较,aP <0.01;与模型组比较,bP <0.01。bFGF:碱性成纤维生长因子

图3 JC-1 染色检测各组别软骨细胞线粒体的损伤情况
2.5 bFGF 对Bcl-2 和Bax 蛋白表达水平的影响
模型组细胞Bcl-2 的表达水平低于对照组,Bax的表达水平高于对照组,差异有高度统计学意义(t=9.863,P <0.01;t=7.357,P <0.01)。但是在给予bFGF后,高剂量组Bcl-2 蛋白的表达水平高于模型组,差异有统计学意义(t=2.838,P <0.05);低剂量组和高剂量组Bax 蛋白的表达水平低于模型组,差异有统计学意义(t=4.198,P <0.05;t=4.726,P <0.01)。见图4、表3。
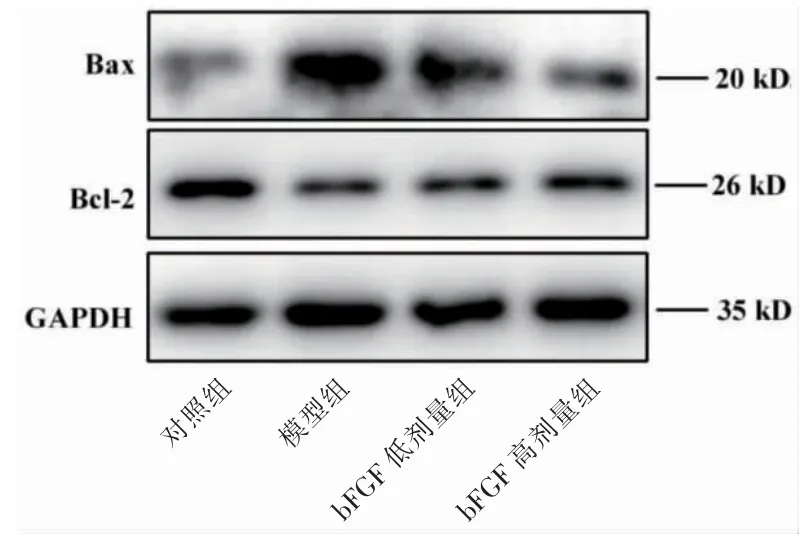
图4 Western blot 检测软骨细胞线粒体损伤和凋亡相关蛋白Bcl-2 和Bax 的表达
表3 不同组别细胞凋亡相关蛋白Bcl-2和Bax 表达水平比较(%,,n=3)
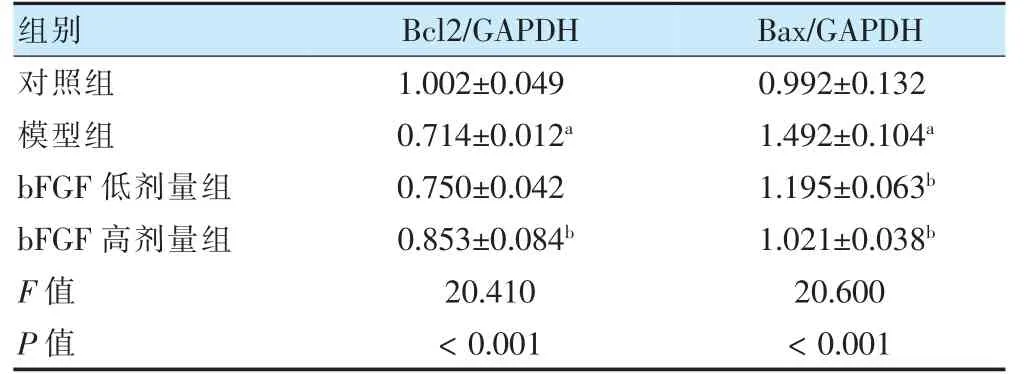
表3 不同组别细胞凋亡相关蛋白Bcl-2和Bax 表达水平比较(%,,n=3)
注 与对照组比较,aP <0.01;与模型组比较,bbP <0.01,bP <0.05。bFGF:碱性成纤维生长因子
3 讨论
TNF-α 是一种多功能的炎症细胞因子,主要来源于巨噬细胞、纤维母细胞及内皮细胞等[9-11]。体外培养的条件下,炎症因子对软骨细胞的细胞活力无明显影响,致敏剂CHX 可以抑制细胞内cFLIP 生成,与炎症因子联用可以有效地诱导细胞损伤[12-13]。Lee等[14]采用CHX 与TNF-α 联用诱导软骨细胞损伤,建立了软骨细胞炎症损伤模型。在本研究中,1 μmol/L CHX 存在的条件下,TNF-α 可以明显地降低软骨细胞的活力,并且具有剂量依赖的趋势,当TNF-α 为50 ng/ml 时细胞活力接近50%,为较为适宜的诱导剂量,因此选择该条件作为建立软骨细胞损伤模型的条件。
bFGF 具有组织修复、血管生成及神经营养等生物学功能[15-18]。Li等[19]研究结果显示,关节关节软骨组织中bFGF 的缺失可以明显促进软骨的凋亡和坏死。此外,体外培养实验显示10 ng/ml 的bFGF 可以强烈促进人原代软骨细胞的增殖,上调软骨细胞胶原蛋白和蛋白聚糖的表达[20],这些研究显示bFGF 对软骨增殖,分化和存活等具有重要的影响。本研究结果显示,与模型组比较,bFGF 能有效上调软骨细胞的细胞活力,提示bFGF 对软骨细胞的损伤具有明显的保护作用。
近年来的研究显示,bFGF 可以抑制凋亡、自噬等多种途径实现对各种细胞的保护作用。Liu等[21]研究显示在U251 细胞中,bFGF 的敲减可以降低线粒体的膜电位,促进细胞凋亡。本研究结果也显示,bFGF可以有效地保护线粒体的功能,抑制模型细胞的凋亡。Bcl-2 和Bax 是与细胞凋亡密切相关的抗凋亡蛋白和促凋亡蛋白[22],Tong等[23]研究显示在缺氧诱导的心肌细胞损伤模型中,bFGF 可以显著抑制模型细胞Bax 的表达,上调Bcl-2 的表达,从而抑制心肌细胞凋亡的发生,这与本研究结果具有一定的相似性,而bFGF 的这一作用也在神经细胞、血管平滑肌细胞和肾脏细胞的相关研究中得到了证实[24-26]。
综上所述,bFGF 可以通过抑制线粒体膜的损伤,保护线粒体的功能,调控线粒体凋亡相关蛋白Bax 和Bcl-2 的表达等机制抑制软骨细胞的炎症损伤,具有一定的治疗前景。
