茶树菇菌丝多糖发酵工艺优化
2022-04-13郭汉忠谭才邓张淑玲王家腾
郭汉忠,谭才邓,张淑玲,王家腾
(1.广东轻工职业技术学院 食品与生物技术学院,广东 广州 510300;2.广东第二师范学院 生物与食品工程学院,广东 广州 510303)
茶树菇(Agrocybe aegerita)又称茶薪菇、杨树菇,属蘑菇菌目,粪伞科,田头菇属,是一种具有较高营养价值的野生蕈菌[1-3]。我国是食用菌产业大国,总产量从2014年的3 270万t增加至2020年的超4 000万t,其中除平菇、金针菇、香菇等常规品种外,茶树菇也占很大的比重,且呈上升趋势[4]。茶树菇是目前市场上极受欢迎的食用菌之一,其生长于亚热带地区,在我国的主要产地为福建、江西等地[5-6],随着茶树菇的食药用价值被不断挖掘,其进入快速发展阶段,产量急剧上升。茶树菇不仅具有补肾滋阴、健脾胃、提高人体免疫力、增强人体防病能力等功效,而且富含抗癌多糖[7-9],现代医学研究表明,其提取物针对小白鼠肉瘤180和艾氏腹水癌有高达80%~90%的抑制率,故人们也把它称为“抗癌尖兵”[10-11]。茶树菇是世界卫生组织推荐的健康食品之一,近年来国内对茶树菇多糖及其复合物的研究己成为热点,大量研究表明,糖类是重要的信息分子,参与许多生理和病理过程。
茶树菇多糖的提取原料一般可以是子实体[12-14]和菌丝体[15-17]两种,茶树菇子实体的生长周期较长,一般一个周期需要60 d左右;茶树菇菌丝体的发酵周期较短,一般为7~10 d,可大大缩短加工周期。目前,关于茶树菇多糖深加工产品及其提取在国际上未见报道,国内的茶树菇多糖深加工产品中,提取多糖的原料大部分由子实体中进行提取,如魏华等[18]通过以茶树菇子实体为原料,采用热水浸提法提取所得多糖的得率为4.81%。但以茶树菇菌丝为原料提取多糖及优化菌丝液态发酵工艺的研究鲜见报道,茶树菇菌丝相较于子实体而言,具有生长周期短、易培养等特点,且用茶树菇子实体或菌丝体提取所得的多糖具有相同的功能性[19]。因此利用茶树菇菌丝体为原料提取茶树菇多糖,可获得较大的效益,本研究以茶树菇菌丝体为原料提取菌丝多糖用于深加工产品,通过优化液态发酵培养基[20-21],对影响深层发酵的培养条件进行优化,以得到最佳的发酵培养工艺,以期提高菌丝多糖含量[22-24],为茶树菇液态发酵生产茶树菇多糖的产业化提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
茶树菇:由广东轻工职业技术学院菌种室提供。
1.1.2 试剂
麦芽糖(分析纯):上海伯奥生物科技有限公司;酵母提取粉(生化试剂):广东环凯微生物科技有限公司;硫酸镁(分析纯):天津市百世化工有限公司;磷酸二氢钾、硫酸锰(分析纯):广州化学试剂厂;苯酚(分析纯):天津市诺克科技发展有限公司;硫酸铁(分析纯):广东汕头市西陇化工厂;浓硫酸(分析纯):广东广试试剂科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)改良培养基:马铃薯200 g/L,葡萄糖20 g/L,氯霉素100 mg/L,琼脂粉20 g/L,pH6.0。
液态发酵基础培养基[25]:葡萄糖20 g/L,蛋白胨10 g/L,KH2PO42.5 g/L,MgSO41.5 g/L,pH6.0。
以上培养基均于121 ℃高压灭菌20 min。
1.2 仪器与设备
YX-280型手提压力蒸汽灭菌锅:广州越特科学仪器有限公司;SW-CJ-2FD超净工作台:广州佰伦净化设备制造有限公司;SHP-150生化培养箱:上海精宏实验设备有限公司;WN-250B全温型恒温培养摇床:天津市欧诺仪器仪表有限公司;FA224电子天平:上海舜宇恒平科学仪器有限公司;JY96-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;SC-3614高容量低速离心机:安徽中科中佳科学仪器有限公司;V-5100可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 菌种活化
茶树菇母种接种至新鲜配制的PDA平板,于26 ℃避光培养3~4 d,挑取菌落边缘生长旺盛的菌丝转接至PDA平板中,26 ℃避光培养3~4 d。
1.3.2 种子液的制备
将活化的茶树菇菌种置于装有适量无菌水的匀浆杯中进行匀浆操作,吸取5 mL菌丝匀浆液接种至100 mL新鲜配制的液态发酵基础培养基中,混匀静置过夜,于26 ℃摇床中130 r/min振荡培养6 d。
1.3.3 培养条件优化单因素试验
培养基碳源对茶树菇菌丝多糖发酵的影响:分别以不同碳源替代液体发酵基础培养基中的葡萄糖,考察蔗糖、麦芽糖、玉米淀粉(添加量20 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响;确定最优碳源种类后,分别考察碳源添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响。
培养基氮源对茶树菇菌丝多糖发酵的影响:分别以不同氮源替代液体发酵基础培养基中的蛋白胨,考察尿素、硫酸铵、酵母提取粉(添加量10 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响;确定最优氮源种类后,分别考察氮源添加量(10 g/L、15 g/L、20g/L、25 g/L、30 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响。
培养基促生长因子对茶树菇菌丝多糖发酵的影响:在液体发酵基础培养基中添加不同促生长因子,分别考察MnSO4、FeSO4、维生素B1(vitamin B1,VB1)、维生素C(vitamin C,VC)(添加量2 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响;确定最优促生长因子种类后,分别考察促生长因子添加量(1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)对茶树菇菌丝生物量、菌丝多糖含量的影响。
培养时间对茶树菇菌丝多糖发酵的影响:分别考察不同培养时间(4 d、5 d、6 d、7 d、8 d)对茶树菇菌丝生物量、菌丝多糖含量的影响。
摇床转速对茶树菇菌丝多糖发酵的影响:分别考察不同摇床转速(110 r/min、120 r/min、130 r/min、140 r/min、150 r/min)对茶树菇菌丝生物量、菌丝多糖含量的影响。
1.3.4 培养条件优化响应面试验
在单因素试验的基础上,以茶树菇菌丝多糖含量(Y)为考察指标,以麦芽糖添加量(A)、酵母提取粉添加量(B)、MnSO4添加量(C)、培养时间(D)为考察因素,利用Box-Behnken试验设计[26-27],通过Design-Expert 8.0.6软件设计4因素3水平响应面试验优化茶树菇菌丝多糖发酵条件,响应面试验因素与水平见表1。

表1 茶树菇菌丝多糖发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for optimization of fermentation conditions of mycelia polysaccharides from Agrocybe aegerita
1.3.5 测定方法
菌丝生物量的测量方法:采用直接干燥法[28],其计算公式如下:

式中:X为样品中的菌丝生物量,g/L;x1为干燥后的总质量,g;x0为称量瓶的质量,g;x为过滤后所称取的样品质量,g;V为所称量的样品过滤前总体积,L。
菌丝多糖含量采用苯酚-硫酸法[29-30]测定,其计算公式如下[31]:

式中:m1为从标准曲线上查得样品测定液中含糖量,μg;V1为样品定容体积,mL;V2为比色测定时所移取样品测定液的体积,mL;m2为样品质量,g;0.9为葡萄糖换算成葡聚糖的校正系数。
1.3.6 数据处理
采用Excel 2016对单因素试验数据进行整理及绘图,Design-Expert 8.0.6软件对响应面结果数据进行回归分析,得出三维图并对其结果趋势进行统计分析。
2 结果与分析
2.1 茶树菇菌丝多糖发酵条件优化单因素试验
2.1.1 培养基碳源对茶树菇菌丝生物量及菌丝多糖含量的影响
由图1可知,麦芽糖对菌丝生物量及生产茶树菇多糖的效果最好,以其为培养基碳源时获得的茶树菇菌丝生物量(菌丝干质量)及菌丝多糖含量分别为6.53 g/L、2.68%,而作为速效碳源的葡萄糖对菌丝多糖的产率却最低,有可能是被吸收后作为能量的形式被利用,从而转化率较低。因此,选择麦芽糖为液态发酵生产茶树菇菌丝多糖的最佳培养基碳源。

图1 碳源种类对茶树菇菌丝生物量及多糖含量的影响Fig.1 Effect of carbon sources types on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
由图2可知,茶树菇菌丝干质量、菌丝多糖含量均随麦芽糖添加量的增加而增加,麦芽糖添加量为30 g/L时,茶树菇菌丝干质量及多糖含量达到最高,分别为6.95 g/L、2.84%;当麦芽糖添加量低于或高于30 g/L时,茶树菇菌丝干质量及多糖含量均呈下降趋势。因此,选择麦芽糖添加量30 g/L为茶树菇液态发酵培养基碳源最佳添加量。
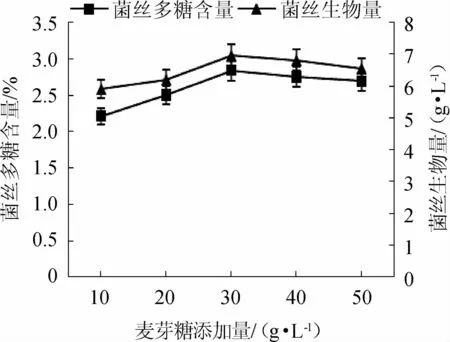
图2 不同麦芽糖添加量对茶树菇菌丝生物量及多糖含量的影响Fig.2 Effect of different maltose addition on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
2.1.2 培养基氮源对茶树菇菌丝生物量及菌丝多糖含量的影响
由图3可知,酵母提取粉对菌丝生物量及生产茶树菇多糖的效果最好,以其为培养基氮源时获得的茶树菇菌丝生物量(菌丝干质量)及菌丝多糖含量分别为5.94 g/L、2.32%,而尿素(无机氮源)比有机氮源对菌丝多糖的产率最低,有可能在培养的过程中尿素中的能量并没有被菌丝有效的利用,甚至是抑制其菌丝的生长,以致于菌丝没有足够的营养物质而引起生长迟缓。因此,选择酵母提取粉为液态发酵生产茶树菇菌丝多糖的最佳培养基氮源。

图3 氮源种类对茶树菇菌丝生物量及菌丝多糖含量的影响Fig.3 Effect of nitrogen sources types on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
由图4可知,茶树菇菌丝干质量、菌丝多糖含量均随酵母提取粉添加量的增加而增加,酵母提取粉添加量为20 g/L时,茶树菇菌丝干质量及多糖含量均达到最高,分别为5.36 g/L、2.33%;当酵母提取粉添加量低于或高于20 g/L时,茶树菇菌丝干质量及多糖含量均呈下降趋势。因此,选择酵母提取粉添加量20 g/L为茶树菇液态发酵培养基氮源最佳添加量。

图4 酵母提取粉添加量对茶树菇菌丝生物量及多糖含量的影响Fig.4 Effect of yeast extract powder addition on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
2.1.3 培养基促生长因子对茶树菇菌丝生物量及菌丝多糖含量的影响
由图5可知,MnSO4对菌丝生物量及生产茶树菇多糖的效果最好,以其为培养基促生长因子时获得的茶树菇菌丝生物量(菌丝干质量)及菌丝多糖含量分别为5.42 g/L、2.40%,而以维生素B1(有机小分子)为培养基促生长因子时菌丝多糖的产率最低,有可能是因为维生素B1在发酵培养中对于茶树菇菌丝体内酶的转化效率较低,影响其新陈代谢,从而导致多糖产量下降。因此,选择MnSO4为液态发酵生产茶树菇菌丝多糖的最佳培养基促生长因子。

图5 促生长因子种类对茶树菇菌丝生物量及多糖含量的影响Fig.5 Effect of growth promoting factors on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
由图6可知,茶树菇菌丝干质量、菌丝多糖含量均随促生长因子MnSO4用量的增加而增加,MnSO4添加量为2.0 g/L时,茶树菇菌丝干质量及多糖含量均达到最高,分别为5.95 g/L、2.42%;当MnSO4添加量低于或高于2.0 g/L时,茶树菇菌丝干质量及多糖含量均呈下降趋势。因此,选择促生长因子MnSO4添加量2.0 g/L为茶树菇液态发酵培养基促生长因子最佳添加量。

图6 MnSO4添加量对茶树菇菌丝生物量及多糖含量的影响Fig.6 Effect of MnSO4 addition on biomass and polysaccharide contents of mycelial from Agrocybe aegerita
2.1.4 培养时间对茶树菇菌丝生物量及菌丝多糖含量的影响
由图7可知,随着培养时间的延长,茶树菇菌丝生物量及菌丝多糖含量均呈上升趋势,在培养6 d时达到最高值,分别是5.54 g/L、2.18%;之后均呈微下降趋势,有可能是因为生长环境营养素含量不断下降,而菌丝为维持生命活动而消耗自身组成成分,造成菌丝生物量及菌丝多糖含量下降。因此,选择培养6 d是液态发酵生产茶树菇菌丝生物量及多糖的最佳培养时间。

图7 培养时间对茶树菇菌丝生物量及多糖含量的影响Fig.7 Effect of culture time on biomass and polysaccharose contents of mycelial from Agrocybe aegerita
2.1.5 摇床转速对茶树菇菌丝生物量及菌丝多糖含量的影响
由图8可知,随摇床转速的升高,茶树菇菌丝生物量及菌丝多糖含量均呈稍微上升的趋势,在摇床转速为130 r/min时达到最高值,分别是5.22 g/L、2.21%;之后均呈稍微下降的趋势,有可能是因为摇床转速越高,发酵容器内的氧气也随之增加,而菌丝在一定氧气浓度下能够促进自身生长,氧气浓度过低或过高,均会抑制菌丝的生长,从而造成菌丝生物量及菌丝多糖含量下降。因此,选择摇床转速130 r/min是液态发酵生产茶树菇菌丝生物量及多糖的最佳转速。
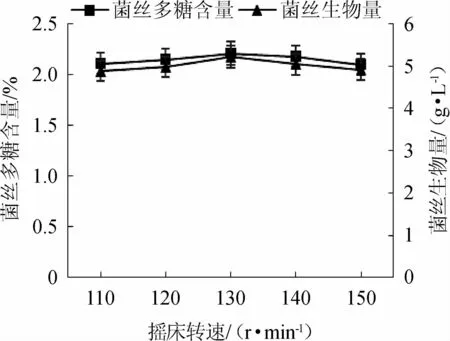
图8 摇床转速对茶树菇菌丝生物量及多糖含量的影响Fig.8 Effect of shaking speed on biomass and polysaccharose contents of mycelial from Agrocybe aegerita
2.2 茶树菇菌丝多糖发酵条件优化响应面试验设计及结果

表2 茶树菇菌丝多糖发酵条件优化响应面试验设计及结果Table 2 Design and results of response surface tests for optimization of fermentation conditions of mycelial polysaccharides from Agrocybe aegerita
由多元回归方程拟合,可得出茶树菇菌丝多糖含量与4个因素之间的二次多项回归方程式:Y=1.94A+3.46B+42.98C+4.78D-0.18AB+0.85AC-0.03AD+1.90BC-0.03BD+1.00CD-0.23A2-0.76B2-136.07C2-0.40D2-21.96,决定系数R2=0.967 3。由此可知,该回归方程有较好的拟合性,对该回归方程进行方差分析,结果见表3。
由表3可知,回归模型P值<0.000 1,说明该模型有极显著性,而失拟项P=0.243 8>0.05,不显著。由P值可知,一次项A、B,二次项A2、B2、C2、D2对结果影响极显著(P<0.01);一次项C、D,交互项AB对结果影响显著(P<0.05)。由F值可知,各因素对多糖含量的影响力大小依次为麦芽糖添加量(A)>酵母提取粉添加量(B)>培养时间(D)>MnSO4添加量(C)。

表3 响应面试验结果方差分析Table 3 Variance analysis of response surface tests
因麦芽糖添加量和酵母提取粉添加量之间有交互作用,对其进行响应面分析,探究其具体的交互关系规律,其响应曲面及等高线见图9。

图9 麦芽糖添加量和酵母提取粉添加量交互作用对茶树菇菌丝多糖含量影响的响应曲面及等高线Fig.9 Response surface plots and counter lines of effects of interaction between maltose and yeast extract addition on contents of mycelial polysaccharide from Agrocybe aegerita
由图9可知,麦芽糖添加量和酵母提取粉添加量在相应的试验范围内,其交互作用有响应极值,呈现由立体中心点(极值)向四周下降的趋势,且其交互作用结果与方差分析结果一致。由Design-Expert 8.06软件计算即可预测出4个因素间的最佳发酵条件为麦芽糖添加量33.7 g/L、酵母提取粉添加量20.5 g/L、MnSO4添加量2.1 g/L、培养时间6.06 d,此条件下茶树菇菌丝多糖含量理论值为3.81%。为方便实际操作,修改发酵条件为麦芽糖添加量34 g/L、酵母提取粉添加量21 g/L、MnSO4添加量2.0 g/L、培养时间6 d,在此条件下,得到的茶树菇菌丝生物量为7.65 g/L,菌丝多糖含量实际值为3.73%。由响应面法优化得到的茶树菇菌丝多糖液态发酵最佳工艺条件的回归模型是符合实际的,可为今后茶树菇菌丝多糖发酵工艺条件的选择提供参考。
3 结论
对茶树菇菌丝液体培养基组分优化试验中,通过对碳源、氮源、促生长因子、培养时间及摇床转速的单因素试验,得到最佳的液体培养条件为麦芽糖添加量34 g/L、酵母提取粉添加量21 g/L、MnSO4添加量2.0 g/L、培养时间6 d,摇床转速130 r/min,KH2PO42.5 g/L,MgSO41.5 g/L,pH 6.0,在此工艺条件下,得到的茶树菇菌丝生物量为7.65 g/L,菌丝多糖含量为3.73%。通过该研究,不仅可以解决茶树菇子实体生长周期长,其多糖产品深加工成本高,而且可以从液态发酵培养所得到的菌丝体中提取到更多的茶树菇多糖,能制作更实惠的有利于人体健康的茶树菇多糖产品,实现经济效益与社会效益并存的“双赢”价值。
