新型吲唑拼接鬼臼毒素衍生物的合成及抗肿瘤活性研究*
2022-04-11梁玉清尹彩霞梁光平王丹丹
杨 俊,梁玉清,尹彩霞,梁光平,王丹丹
(1 遵义医药高等专科学校,贵州 遵义 563006;2 铜仁职业技术学院,贵州 铜仁 554300)
据估计,2020年全球约有1930万新发癌症病例,女性乳腺癌已超过肺癌成为最常见的癌症,有近230万病例,其次是肺癌、结肠直肠癌、前列腺癌、胃癌;在近1000万癌症死亡病例中,肺癌仍然是癌症死亡的主要原因,其次是结肠直肠癌、肝癌、胃癌、乳腺癌,癌症依旧是威胁人类健康的主要原因之一[1-2]。吲唑结构广泛的存在于活性化合物和药物之中,其中较为突出的是抗肿瘤活性,如:Entrectinib[3]用于治疗 12岁以上的的成人和儿童患者的神经营养性酪氨酸受体激酶(NTRK)融合阳性的实体瘤和ROS1阳性转移非小细胞肺癌;1[4]作为有效的选择性PAK1抑制剂,具有抗肿瘤迁移和侵袭活性;Bozitinib[5]是一种有效的高选择性c-MET抑制剂,在体外和体内 NSCLC模型中均显示出优异的活性。小蘖科鬼臼属桃儿七、山荷叶、美洲鬼臼等植物,民间曾用于治疗尖锐湿疣、牛皮癣等疾病,鬼臼毒素(Podophyllotoxin)是在其根或茎中提取得到的一种具有显著的抗肿瘤作用的芳基萘类木脂素,其突出的抗肿瘤作用主要机制为,抑制微管蛋白聚合[6],抑制拓扑异构酶Ⅱ活性[7-8],自由基机制[9],由鬼臼毒素进行结构修饰的依托泊苷等药物,因为耐药性及水溶性差限制其应用。基于天然活性产物鬼臼毒素良好的抗肿瘤活性及吲唑抗肿瘤活性骨架,我们根据前药和药物拼合原理,通过丁二酸酐将吲唑活性骨架与鬼臼毒素进行拼接,寻找抗肿瘤活性较好的活性分子,同时可能解决依托泊苷的肿瘤耐药性问题。
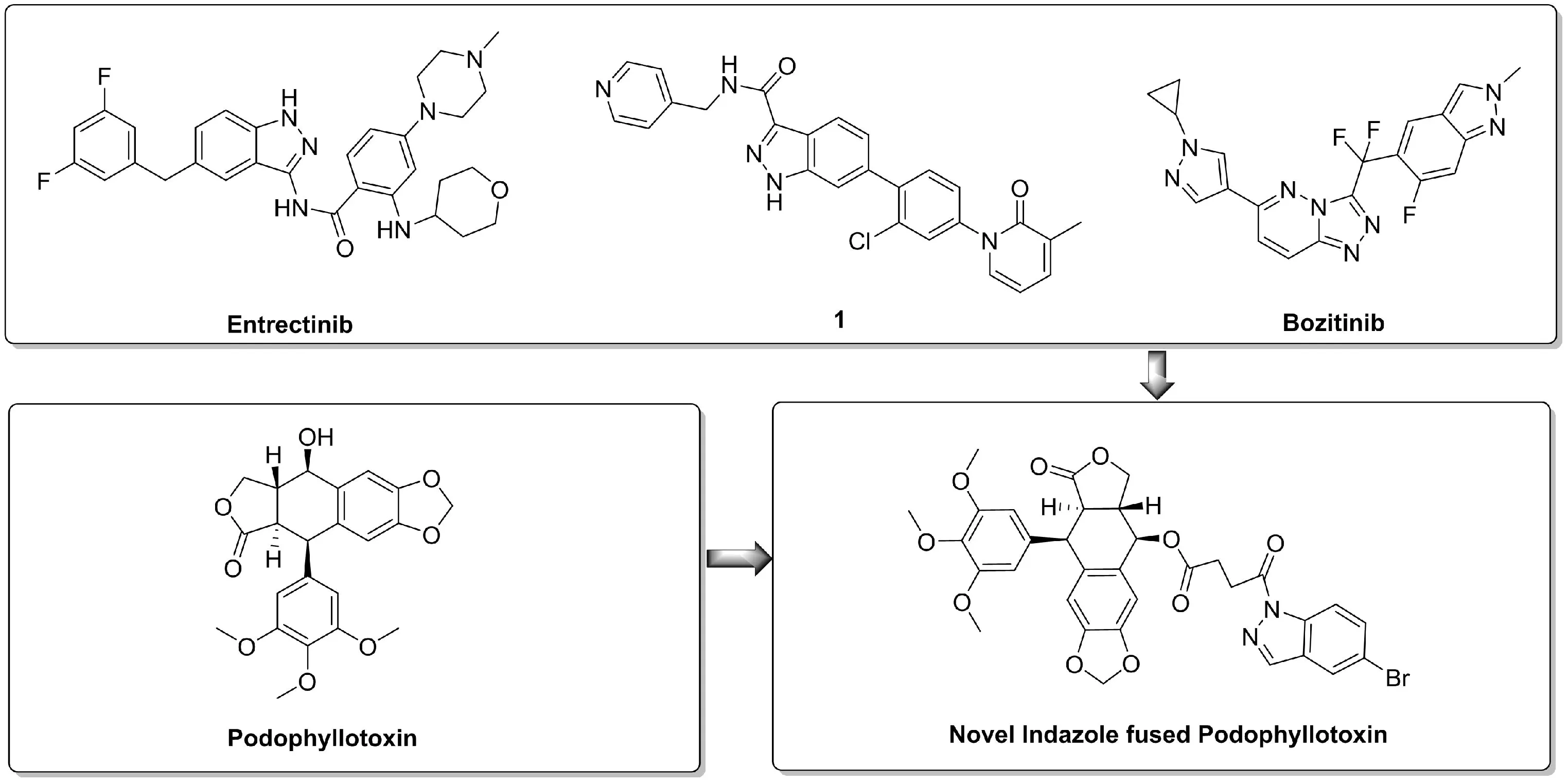
图1 设计思路
1 仪器、试剂与细胞
1.1 主要仪器
ATY224型电子天平,日本岛津公司;SGW X-4显微熔点仪,上海仪电物理光学仪器有限公司;RE-2000B型旋转蒸发仪,巩义市瑞德仪器设备有限公司;Bruker Avance Ⅲ 400MHZ核磁共振仪(CDCl3为溶剂,TMS为内标),德国布鲁克公司;WFH-203B型暗箱式紫外分析仪,上海亮研智能科技有限公司;Aglient 1290-6545高分辨质谱仪,安捷伦科技有限公司;SW-CJ-1FD超净工作台,苏州集团安泰空气技术有限公司;Flexstation 3酶标仪,美国分子仪器公司;MCO-15AC CO2恒温培养箱,SANYO 公司。
1.2 药物与试剂
5-溴吲唑(纯度> 98.0%),上海阿拉丁生化科技股份有限公司;三乙胺(纯度>98.0%),上海阿拉丁生化科技股份有限公司;鬼臼毒素(纯度>98.0%),上海麦克林生化科技有限公司;丁二酸酐(纯度>98.0%),上海阿拉丁生化科技股份有限公司;N,N′-二环己基碳二亚胺(纯度>98.0%),上海阿拉丁生化科技股份有限公司;4-二甲氨基吡啶(纯度>99.0%),上海阿拉丁生化科技股份有限公司;噻唑蓝(批号3580MG250),Biofroxx公司;优级胎牛血清Fetal Bovine Serum(批号10091-148),Gibco公司;青霉素/链霉素溶液Penicillin-Streptomycin(批号15070-063),Gibco公司。
1.3 细 胞
人非小细胞肺癌细胞(A549)、人肺腺癌耐顺铂株(A549/DDP)、人乳腺癌细胞(MCF-7),均购自Procell公司,所有细胞株均在液氮中冻存,需要时复苏。
2 方 法
2.1 新型吲唑拼接鬼臼毒素衍生物的合成
2.1.1 N-丁二酸单取代-5-溴吲唑的合成
在反应管中依次加入197.0 mg 5-溴-1H-吲唑(1 mmol),170.2 mg 丁二酸酐(1.7 eq,1.7 mmol),12.6 mg 催化剂4-二甲氨基吡啶(10%),0.5 mL三乙胺和3 mL二氯甲烷溶液,回流反应12 h,TLC检测基本反应完全,旋干溶剂,加入 30 mL乙酸乙酯稀释,然后加入1 M盐酸溶液,乙酸乙酯反复萃取,合并乙酸乙酯层,旋干溶剂上样经硅胶柱层析(洗脱剂:V(石油醚):V(乙酸乙酯)= 2:1)纯化得N-丁二酸单取代-5-溴吲唑。
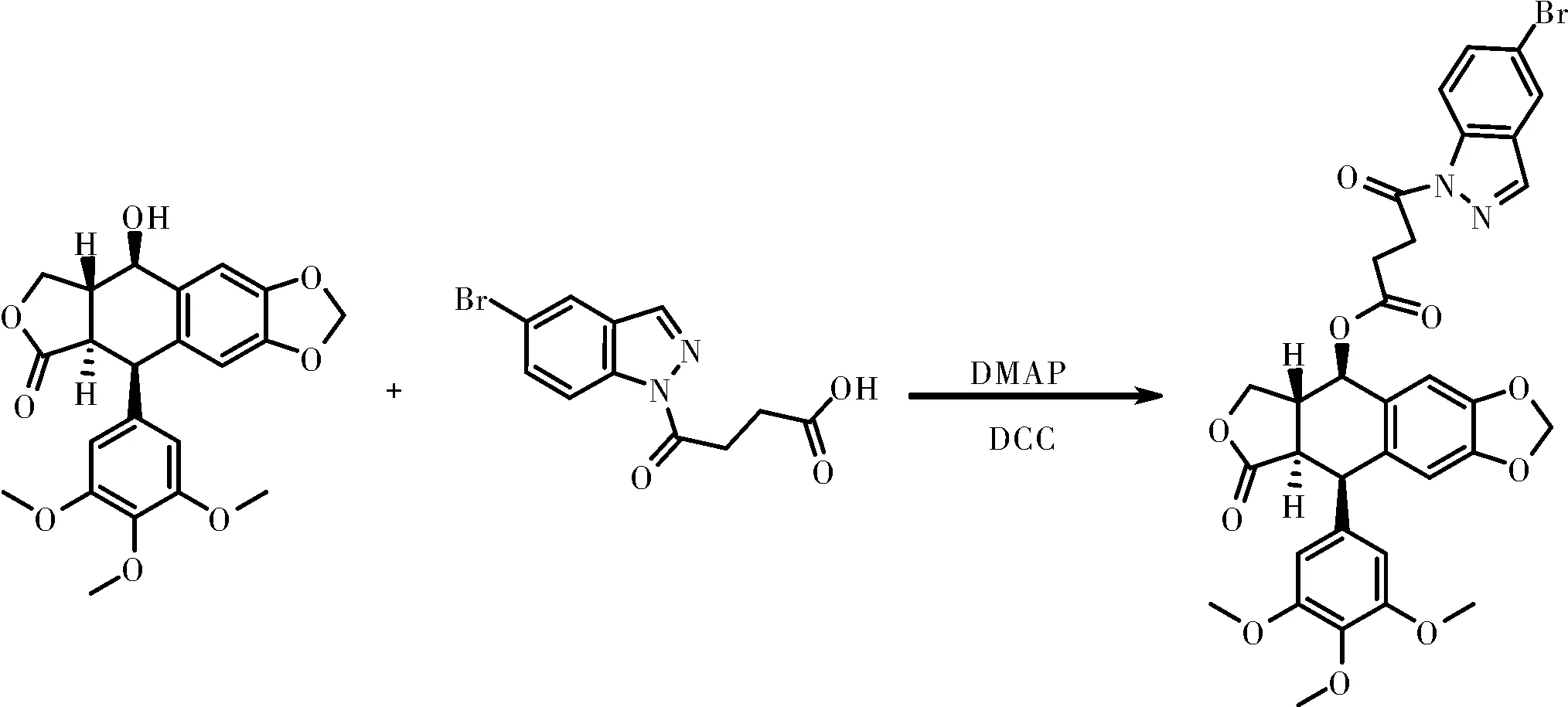
图2 新型吲唑拼接鬼臼毒素衍生物的合成
2.1.2 新型吲唑拼接鬼臼毒素衍生物的合成
取N-丁二酸单取代-5-溴吲唑177.0 mg(0.6 mmol),207.2 mg鬼臼毒素(0.5 mmol),12.3 mg催化剂4-二甲氨基吡啶,154.8 mg脱水剂N,N′-二环己基碳二亚胺,4 mL二氯甲烷溶液于反应管之中,TLC检测基本反应完全,加入30 mL二氯甲烷稀释,加入0.1 N稀盐酸50 mL萃取,取二氯甲烷层,分别用饱和碳酸氢酸钠水溶液、饱和食盐水洗涤,无水硫酸钠干燥,旋干二氯甲烷层上样经硅胶柱层析(洗脱剂:V(石油醚):V(乙酸乙酯)=3:1 至2:1)纯化得最终产物新型吲唑拼接鬼臼毒素化合物。
2.2 细胞培养
细胞培养,以A549/DDP细胞为例。将A549/DDP细胞从液氮中取出,快速放入37 ℃水浴锅中,轻摇冻存管使冻存液溶解;溶解后把细胞转移到含有5 mL培养基的离心管中,离心收集细胞,室温1000 rpm离心5 min,弃上清;用含10%胎牛血清的完全培养基悬浮细胞,接种到培养皿中,轻轻吹打混匀,37 ℃、5%CO2饱和湿度条件下培养;当细胞的密度达到80% 时,对细胞进行传代;弃去培养基,用PBS洗一次;加 1~2 mL 0.25% 胰蛋白酶消化细胞,显微镜下观察,消化1~2 min,可看到细胞相互分离变圆,即消化完成;快速弃去胰酶,加入完全培养基,吹打细胞,制成单细胞悬液,按1:3的比例传代,37 ℃、5% CO2饱和湿度条件下扩大培养。
2.3 体外抗肿瘤活性测试
对人非小细胞肺癌细胞(A549)、人肺腺癌耐顺铂株(A549/DDP)、人乳腺癌细胞(MCF-7)的体外抗肿瘤活性测试,采用改良MTT法[10],以A549/DDP为例。取处于对数生长期,生长状态良好的A549/DDP细胞,用含10%小牛血清的培养基配成4000个·mL-1细胞悬液,接种在96孔板,每孔接80 μL,同时设空白组,37 ℃培养过夜;分别将新配制的新型吲唑拼接鬼臼毒素化合物二甲基亚砜溶液以浓度梯度加入到各孔中,使孔中化合物最终浓度分别为5 μmol·L-1, 10 μmol·L-1, 20 μmol·L-1, 40 μmol·L-1和80 μmol·L-1,每组设3复孔;设阳性对照组依托泊苷及顺铂终浓度为5 μmol·L-1, 10 μmol·L-1, 20 μmol·L-1, 40 μmol·L-1和80 μmol·L-1,同时设空白组;细胞培养72 h后,每孔加入10 μL MTT的磷酸盐缓冲液,再 37 ℃下培养4 h,离心5 min除去未转化的MTT,每孔中加入 150 μL 二甲基亚砜,以溶解还原的MTT 晶体甲臜(formazan),用酶标仪在568 nm波长测定各孔吸光值OD。细胞增殖抑制率= 1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值),A549/DDP细胞半抑制浓度IC50由spss软件分析得到。
2.4 分子对接实验
采用ChemDraw Professional 18.0绘制新型吲唑拼接鬼臼毒素衍生物的2D结构,利用Chem 3D 18.0进行3D结构优化;然后在PDB(https://www.rcsb.org)数据库中检索并下载微管蛋白秋水仙碱复合物[11-12](PDB:1SA0)的3D图,利用Py MOL 2.4.0软件对微管蛋白秋水仙碱复合物进行除水、去除原配体;最后运用AutoDock的可视化软件进行分子对接。
2.5 数据处理
采用SPSS 19.0软件进行数据处理、统计分析,数据以x±s表示。
3 结 果
3.1 新型吲唑拼接鬼臼毒素衍生物的合成结果
新型吲唑拼接鬼臼毒素衍生物:白色固体, 熔点:201.0~201.9 ℃;产率:85.3%;1H NMR(CDCl3,400 MHz)δ:8.29(d,J=8.9 Hz, 1H), 8.09(s, 1H), 7.89(s, 1H), 7.65(dd,J=8.9, 1.8 Hz, 1H), 6.86(s, 1H), 6.53(s, 1H), 6.40(s, 2H), 5.98~5.96(m, 3H), 4.60(d,J=3.5 Hz, 1H), 4.47~4.43(m, 1H), 4.21~4.16(m, 1H), 3.81(s, 3H), 3.75(s, 6H), 3.64~3.58(m, 2H), 2.94~2.90(m, 4H);13C NMR(CDCl3, 100 MHz)δ:173.76, 173.03, 171.96, 152.68, 148.18, 147.65, 139.15, 137.87, 137.15, 134.89, 132.80, 132.38, 128.26, 127.86, 123.68, 17.95, 116.76, 109.74, 108.11, 107.13, 101.63, 73.98, 71.44, 60.81, 56.18, 45.57, 43.80, 38.73, 30.29, 28.67;HRMS(ESI-TOF) m/z:Calcd. for C33H29BrNNaO10[M+Na]+:715.0903; Found:715.0905。
3.2 体外抗肿瘤活性测试结果
新型吲唑拼接鬼臼毒素衍生物的体外抗肿瘤活性测试结果见表1,该化合物对人非小细胞肺癌细胞(A549)的体外抑制作用不明显,对人肺腺癌耐顺铂株(A549/DDP)具有细胞毒性[IC50=(82.43±2.35) μM],且活性明显优于阳性对照药物顺铂(IC50>100),同时略优于阳性对照药物依托泊苷[IC50=(84.39±2.69) μM];与阳性对照药物依托泊苷和顺铂相比,该化合物表现出对A549/DDP耐药细胞具有较好的选择性,RF值<1;对人乳腺癌细胞(MCF-7)细胞株的细胞毒性[IC50=(38.29±2.45)μM],优于阳性对照药物顺铂[IC50=(54.72±1.37) μM],弱于阳性对照药物依托泊苷[IC50=(13.18±0.55)μM]。
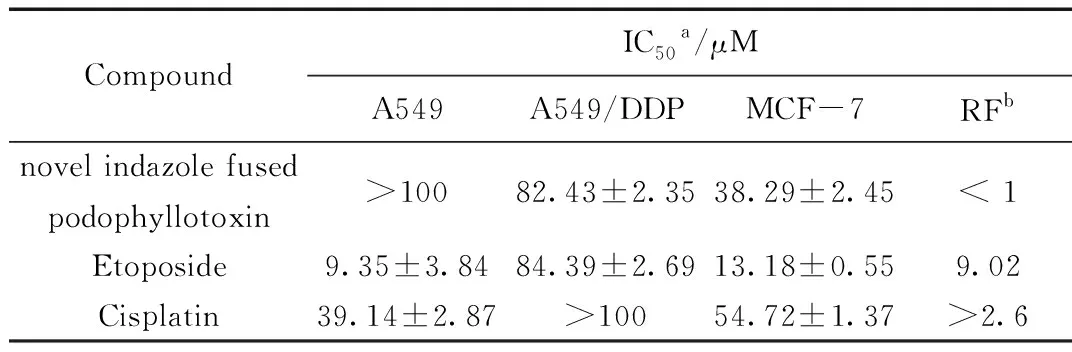
表1 新型吲唑拼接鬼臼毒素衍生物的体外抗肿瘤活性测试结果
3.3 分子对接实验结果
新型吲唑拼接鬼臼毒素衍生物丁二酸侧链1位酯基与微管蛋白秋水仙碱作用位点的ASN-101氨基酸残基形成氢键(d= 2.3 Å),对接的结合能(affinity)为 -11.2 kcal/mol,表示化合物新型吲唑拼接鬼臼毒素衍生物与微管蛋白能够进行较好的结合,其抗肿瘤机制可能是作用于微管蛋白,影响有丝分裂过程,从而影响其细胞分裂过程而走向凋亡。

图3 新型吲唑拼接鬼臼毒素衍生物与微管蛋白秋水仙碱作用位点(PDB:1SA0)分子对接图
4 结 论
新型吲唑拼接鬼臼毒素衍生物的合成方法简便、产率高,该化合物对人肺腺癌耐顺铂株(A549/DDP)具有较好的选择性,且细胞毒性明显优于阳性对照药物顺铂,同时略优于阳性对照药物依托泊苷;对人乳腺癌细胞(MCF-7)细胞株的细胞毒性,优于阳性对照药物顺铂,分子对接结果显示该化合物与微管蛋白秋水仙碱作用位点的ASN-101氨基酸残基与形成氢键(d=2.3 Å),结合能(affinity)为 -11.2 kcal/mol,能够较好的结合,其作用机制可能是作用于微管蛋白,影响有丝分裂过程,从而影响其细胞分裂过程而走向凋亡,有待进一步实验验证,该化合物对研究活性骨架拼接及抗肿瘤耐药药物研发具有一定的意义。
