馥感啉口服液通过TGF-β1/Smad3信号通路改善肥胖哮喘小鼠气道重塑
2022-04-07李小英郭健敏张文强戴锦龙
李小英,郭健敏,张文强,戴锦龙,杨 威,江 涛
(1.广东药科大学中药学院,广东 广州 510006;2.广东莱恩医药研究院有限公司,广东省药物非临床评价研究企业重点实验室,国家中药现代化工程技术研究中心中药非临床评价分中心,广东省创新药物评价与研究工程技术研究中心,广东 广州 510990)
支气管哮喘为儿科常见疾病,据文献报道,全球哮喘患者约 2 亿左右,其中小儿支气管哮喘占 35% 以上,患病率约为1%~8%,发病率呈逐年上升的趋势[1-2]。近年来多项研究发现,肥胖型哮喘更容易导致哮喘急性发作,且即使给予一线抗哮喘药物治疗,肥胖型哮喘患者的病情依然控制不佳,所以迫切需要有效的补充及替代方法来治疗肥胖型哮喘[3]。
肥胖哮喘的特征表现为气道重塑、气道高反应性(Airway hyperresponsiveness,AHR)及慢性气道炎症。转化生长因子β1(Transforming growth factor β1,TGF-β1)是一种多效性的细胞因子,在哮喘患者中显著高于正常人,可通过多种机制如诱导纤维母细胞增生、胶原纤维及细胞外基质合成等促使结缔组织合成增加,介导下游靶点Smad3发生磷酸化,促使气道重塑发生[4]。近年来,TGF-β1/Smad3信号级联已经成为气道炎症及气道重塑研究的热点[5-6]。
馥感啉口服液(以下简称馥感啉,FGL)复方中主要含黄芪、浙贝母、麻黄、甘草等成分,具有清热解毒、止咳平喘、益气疏表的功效,临床上主要用于小儿反复感冒所致发热、咳嗽、气喘、咽喉肿痛等症状。本研究通过卵清蛋白(Ovalbumin,OVA)联合高脂饲料的方法建立肥胖哮喘小鼠模型,并与硫酸特布他林进行比较,观察馥感啉对肥胖哮喘小鼠的治疗效果,初步探讨馥感啉治疗肥胖哮喘机制。
1 材料
1.1 动物健康C57 BL/6小鼠102只,雌雄各半,PND16- PND18,体质量(8.5~14.8)g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004。动物饲养于广东莱恩医药研究院SPF级动物房,严格按照国际AAALAC和《广东省实验动物管理条例》要求进行研究,研究过程符合动物伦理和福利要求。
1.2 主要试剂馥感啉(广州一品红制药有限公司,批号:19120501)主要有效成分黄芪甲苷(大于80 mg·L-1)、贝母素甲、盐酸麻黄碱等,浓度1 079 mg·L-1,棕褐色液体,味甜、微苦、涩,密封,置阴凉处保存;硫酸特布他林片(阿斯利康制药有限公司,批号:1709089);卵清蛋白(OVA,Sigma公司,SLBK7542V);Dorminal 20%(Alfasan Intenational B.V,批号为1709296-02);IgE、TGF-β1、Smad3、SP ELISA试剂盒(广州开晨生物科技有限公司;E20200701A);Smad3抗体,美国abcam,批号:ab84177;SARA抗体,中国安诺伦,批号22033-1-AP;高脂饲料D12492(北京科澳协力饲料有限公司)。
1.3 主要仪器电子天平(赛多利斯科学仪器(北京)有限公司);低速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。酶标分析仪(BioTek,Synergy LX,美国);超声雾化器(欧姆龙健康医疗有限公司);振荡式肺功能检测系统(Flexivent,SCIREQ,法国);荧光显微镜成像系统(Keyence,BZ-X800,日本)。
2 方法
2.1 动物处理在动物适应性观察结束之后,随机挑选8只为阴性对照组(Control),正常维持饲料(含脂肪10%)喂养;其他动物高脂饲料(蛋白:碳水化合物:脂肪=1 ∶1 ∶3)喂养。六周后分组,选取体重大于阴性对照组平均体重约20%的动物建立肥胖哮喘模型,分为肥胖组(Obesity model)、肥胖哮喘模型组(Obesity asthma model)、硫酸特布他林(Terbutaline)组0.4 mg·kg-1、馥感啉(FGL)5.86、11.72、23.44 g·kg-1组。哮喘模型建立:参考文献[7]稍加改进,除阴性对照组外,其余各组通过腹腔注射10 mg·L-1OVA溶液 0.2 mL进行致敏,隔天1次,连续3次,观察14 d后激发,激发时将OVA溶液10 mg·L-1雾化吸入,每天1次,每次3~5 min,连续7 d。阴性对照组以等量PBS溶液致敏和激发。采用灌胃给药,于致敏d 1开始持续至动物处理,给药体积30 mL·kg-1,每天1次,共26 d,阴性对照组和模型组给予等体积的纯水;硫酸特布他林组于后5 d灌胃给药,前21 d给予等体积的纯水。
2.2 标本采集各组小鼠于最后一次激发后,测定肺功能。小鼠麻醉后,仰卧位于固定板上,颈部剃毛,消毒,颈部正中切口,暴露气管,然后用眼科剪做一个倒T形切口,清洁创口后连接肺功能测定仪的专用管道插入小鼠气管中,测定肺功能。肺功能测定结束后,腹主动脉采血并处死小鼠,打开胸腔,取左肺切片染色,右肺-80 ℃冷冻保存。
2.3 体质量及肺脏指数肥胖模型造模期间,每周称质量1次,6周后,计算肥胖模型成功率;给药期间动物每3 d称量次体质量,并于末次处理时剖取动物肺脏,称取质量,计算肺脏指数。其中,肥胖模型成功率=体质量大于阴性组平均体质量20%的动物数量/其余动物数量×100;肺脏指数(%)=肺脏重量/体质量×100。
2.4 呼吸功能评价方法于给药d 26,雾化激发后,腹腔注射1% Dorminal(50 mg·kg-1)麻醉,暴露支气管,做T型切口插管,连接肺功能震荡仪测定呼吸系统阻力(Respiratory system resistance,Rrs)、呼吸系统顺应性(Respiratory system compliance,Crs)、呼吸系统弹性(Respiratory system elasticity,Ers)。
2.5 肺部组织病理学检查小鼠肺组织制备成厚度为3~5 μm的切片,分别进行HE 及Masson染色,光镜下观察病理变化。
2.6 白细胞总数及IgE的含量检测肺功能测定结束后,利用腹主动脉采血方法对小鼠进行安乐死,并采集1~2 mL的血液,取约0.5 mL用乙二胺四乙酸抗凝,测定白细胞总数。剩余血液分离血浆后-20 ℃冷冻保存,采用ELISA法对小鼠血清中Ig E的含量进行检测,具体操作均按试剂盒说明书所述的执行。
2.7 肺组织中TGF-β1、Smad3、SARA(Smad anchor for receptor activation)、P物质(substance P,SP)含量检测取动物部分肺组织-80 ℃冷冻保存,4周内取出匀浆,吸取上清,采用ELISA法检测TGF-β1、Smad3、SP含量。石蜡切片免疫组化检测小鼠肺组织中Smad3及SARA蛋白表达。

3 结果
3.1 馥感啉对肥胖哮喘小鼠体质量及肺脏指数的影响与阴性对照组相比,给药期间各组动物体质量均明显增加(P<0.05)(Fig 1)。与肥胖哮喘模型组相比,馥感啉各组动物肺脏质量明显降低(P<0.05),肺脏系数降低,但差异无统计学意义(P>0.05),见Tab 1。

Fig 1 Weight gain curve

Tab 1 Effect of Fuganlin oral liquid tablets on lung organ index of mice
3.2 馥感啉对肥胖哮喘小鼠呼吸功能指标的影响在给药结束之后,检测不同组小鼠的呼吸功能。结果发现,肥胖哮喘模型组Rrs和Ers明显高于阴性对照组(P<0.05),馥感啉治疗后抑制了Rrs增加和Ers升高;肥胖哮喘模型组Crs低于阴性对照组,但无显著性差异(P>0.05),给与馥感啉治疗后,Crs升高,以馥感啉 23.44 g·kg-1组升高差异具有显著性(P<0.05)见Tab 2。

Tab 2 Effect of Fuganlin oral liquid tablets on breathing function of mice )
3.3 组织病理学检查结果HE染色结果显示,肥胖哮喘模型组小鼠肺脏出现不同程度细支气管黏膜增高,主要表现为细支气管管腔变小,黏膜挤压增高。馥感啉治疗后,细支气管黏膜增高明显缓解。MASSON 染色结果可见肥胖哮喘模型组胶原蛋白沉积面积较阴性对照组明显增加,馥感啉对OVA诱导的胶原蛋白沉积有明显的抑制作用。见Tab 3,Fig 2,3。
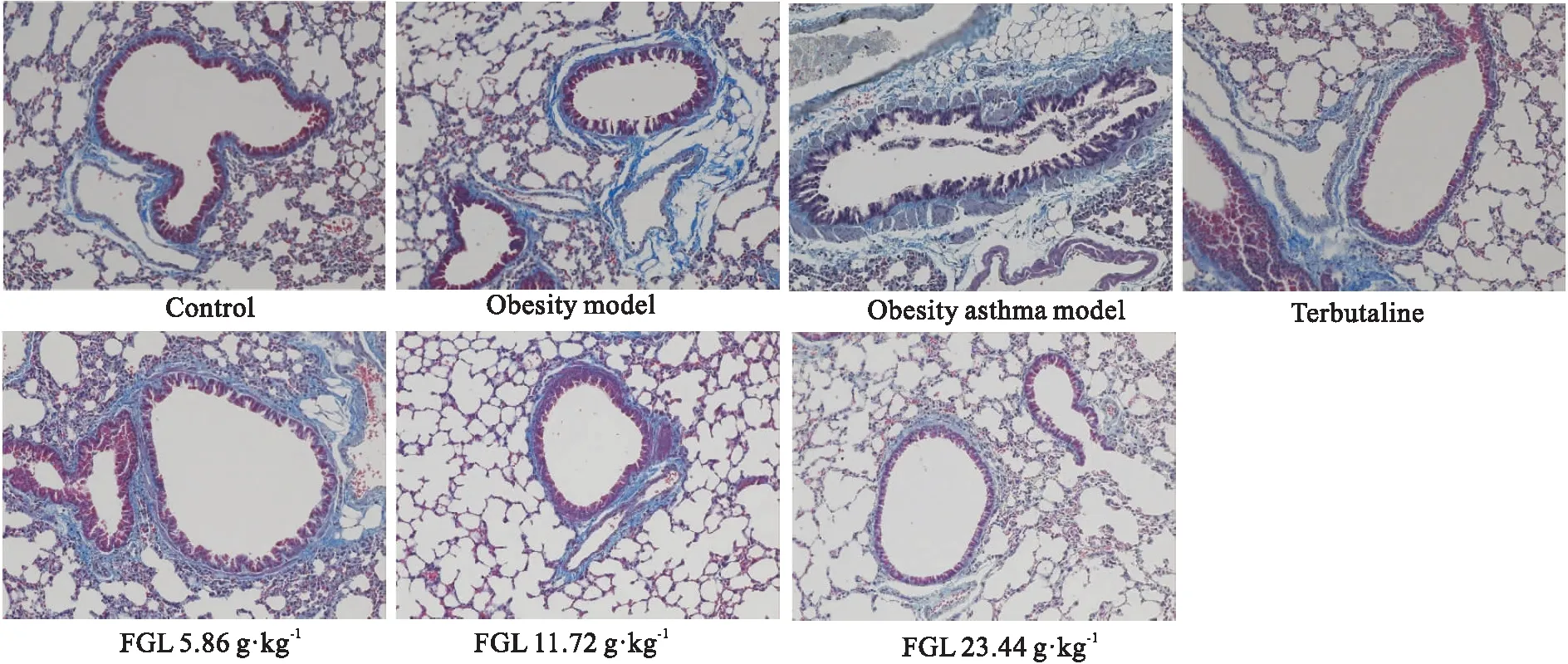
Fig 3 The pathological changes of lung tissues affected by Fuganlin oral liquid (MASSON×200)

Tab 3 Effect of Fuganlin oral liquid tablets on thickness of bronchial mucosa of lung tissues of mice )
3.4 馥感啉对肥胖哮喘模型炎症的影响与阴性对照组比较,肥胖哮喘模型组白细胞总数升高,但差异无显著性(P>0.05),馥感啉治疗后抑制了血液中白细胞总数增加;与阴性对照组比较,肥胖哮喘模型组血清中IgE含量、肺组织中SP含量明显升高(P<0.05),馥感啉治疗后抑制了血清中IgE及肺组织中SP表达,提示馥感啉对肥胖哮喘模型具有抗炎效果。见Tab 4,5。

Tab 4 Effect of Fuganlin oral liquid on total white blood cells and IgE in mouse
3.5 馥感啉对肥胖哮喘小鼠肺组织中TGF-β1、Smad3及SARA的影响ELISA结果表明,肥胖哮喘模型组与阴性对照组比较TGF-β1水平明显升高,在馥感啉干预治疗后TGF-β1水平明显降低(P<0.05);同时,Smad3的磷酸化水平在肥胖哮喘模型组明显升高(P<0.05),而升高的磷酸化Smad3能够被馥感啉抑制。IHC结果表明,Smad3及SARA蛋白水平在模型组表达较阴性对照组明显升高(P<0.05),经馥感啉治疗后Smad3及SARA在肺组织表达水平下调,提示馥感啉参与调控TGF-β1/Smad3信号转导。见Tab 6,Fig 4,5。

Tab 5 Effect of Fuganlin oral liquid on SP in lung tissues of mice
Tab 6 Effect of pediatric treatment of Fuganlin oral liquid tablets on TGF-β1 and Smad3 in mouse lung tissues
4 讨论
有研究表明,强制振荡技术(FOT)是评估成人和儿童支气管高反应性的可靠方法[8]。FOT技术在正常潮气呼吸期间,通过叠加振荡压力或流动波来测量呼吸系统阻抗[8- 9]。阻抗的实际部分为呼吸系统阻力(Rrs),反应呼吸系统的总体阻力,包括气道组织以及胸壁的影响,是呼吸系统的总体表征;阻抗的虚拟部分为呼吸系统抵抗,其反映呼吸系统弹性和顺应性。在本研究中建立肥胖哮喘模型,馥感啉治疗之后检测小鼠呼吸功能,结果显示,肥胖哮喘模型组Rrs显著高于阴性对照组,经馥感啉治疗后小鼠Rrs降低,Crs升高,有效改善呼吸功能。表明馥感啉可以通过调节呼吸系统功能改善哮喘症状。
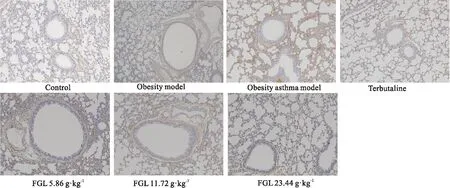
Fig 4 Expression of Smad3in lung tissues affected by Fuganlin oral liquid (×200)

Fig 5 Expression of SARA in lung tissues affected by Fuganlin oral liquid (×200)
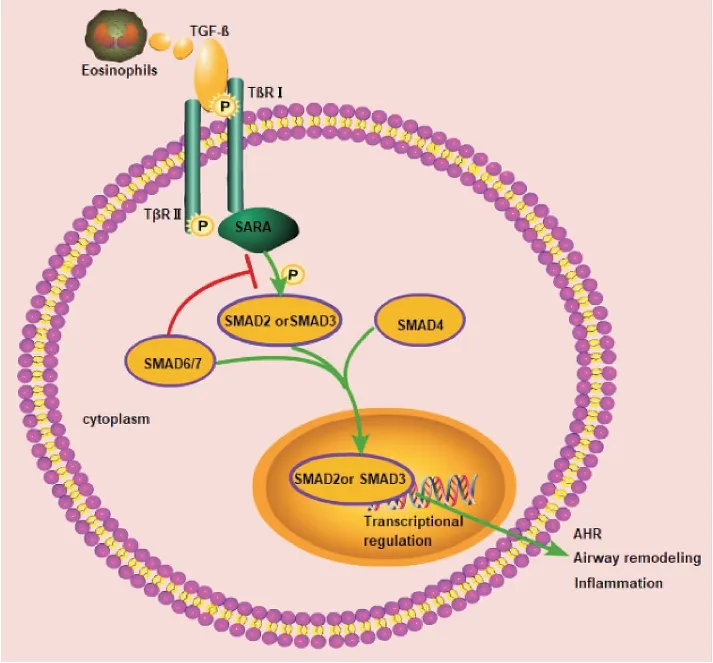
Fig 6 TGF-β1/SMAD3 signaling path way
肥胖型哮喘是一种慢性气道炎症性疾病[10],在本研究中结果显示,馥感啉能有效抑制小鼠血液中白细胞总数及血清中Ig E升高。SP广泛存在于气管及小支气管的气道平滑肌、气道上皮、黏膜下层及血管周围[11],可促进淋巴细胞、嗜酸性粒细胞、单核巨噬细胞等炎性细胞释放炎性因子,造成炎症反应。同时,SP高度释放促进气管黏液分泌,使气道阻力增加,参与气道高反应性的形成[12]。馥感啉能有效抑制肥胖哮喘小鼠肺组织SP含量增高,表明馥感啉对肥胖哮喘小鼠模型肺组织炎性及气道高反应性有明显的抑制作用。
哮喘的慢性气道炎症如果不能得到有效控制,在反复损伤和修复过程中,气道平滑肌、上皮、血管和细胞外基质发生不可逆的改变从而导致肺功能降低,即发生气道重塑[13]。TGF-β1与气道重塑密切相关,分泌过高刺激肺组织支气管上皮细胞结构改变,使Smad与β2微管蛋白分离,Smad2或Smad3与Smad锚激活受体SARA结合,被呈递给TGF-β/activin受体复合物接受磷酸化后与Smad4形成复合体,从而激活转录反应,影响支气管上皮细胞及气道平滑肌增殖(Fig 6)[14]。在本研究中,ELISA结果显示经馥感啉治疗后肺组织中TGF-β1、Smad3含量明显降低,IHC结果表明馥感啉可以有效抑制Smad3及SARA蛋白表达水平升高。HE染色观察到肥胖哮喘模型组细支气管管腔变小,黏膜挤压增高,Masson染色结果可见肥胖哮喘模型组胶原蛋白沉积增加等气道重塑的表现,经馥感啉治疗后能够缓解上述气道重塑的病理变化。以上结果表明馥感啉可能通过TGF-β1/Smad3信号减少胶原沉积和抑制细支气管基底膜增厚进而缓解气道重塑。
综上所述,馥感啉具有改善肥胖哮喘小鼠气道炎症,降低气道高反应性,改善呼吸功能,拮抗气道重塑的作用,其机制可能与TGF- β1/Smad3信号通路有关。