基于转录组学探讨铁死亡相关基因在奥希替尼获得性耐药NSCLC细胞中的表达及意义
2022-04-07生高凡江诗琴
曹 霖,生高凡,江诗琴,黄 民,金 晶
(中山大学药学院,广东 广州 510006)
肺癌作为发病率和死亡率极高的恶性肿瘤之一,严重威胁着人类的生存和健康[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占比约80%,但患者的5年生存率却不足20%[2]。目前,NSCLC的治疗手段主要以手术、化疗、放疗、介入、免疫疗法和靶向治疗等为主,其中化疗仍是主要治疗方式之一,但其不良反应也对患者的生活质量造成了较大影响[3]。奥希替尼(osimertinib,Osi)作为第三代表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)类药物,针对广泛存在的EGFR T790M突变导致的吉非替尼耐药而开发,不仅具有比前两代药物更好的疗效,同时对于中枢神经系统的肿瘤转移也有一定的作用[4-5]。然而,Osi的耐药依旧限制了其长期的临床应用,并最终致使癌症进展恶化。因此,探究Osi耐药的产生机制显得尤为重要。
转录组学是指在特定的细胞、组织或生物体中针对特定的发育阶段或生理条件对完整的转录本进行研究,这套完整的转录本就称为一个转录组,主要包括mRNA、rRNA、tRNA、ncRNA、miRNA和lncRNA等[6]。RNA-seq作为一种比较成熟的转录组学研究方法,主要通过将RNA转化为cDNA片段文库并进行深度高通量测序,从而获得研究目标的转录组,具有检测范围广、背景信号低、样本用量少等优点[7]。近年来,转录组学已被应用于识别疾病的生物标志物,以及研究各种刺激和应激导致的生物学反应,并在推动基因组和分子生物学研究中发挥着关键作用[8]。
本研究以人非小细胞肺癌细胞H1975细胞、及其Osi获得性耐药株H1975/OR细胞为研究对象,基于转录组学初步探讨了铁死亡通路在Osi耐药中可能发挥的作用,为进一步进行Osi的耐药机制研究提供支持,并为克服Osi治疗肺癌出现的耐药性提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞株 人肺成纤维细胞HLF-1和人非小细胞肺癌细胞H1975购自中国科学院上海细胞库,人非小细胞肺癌Osi耐药细胞H1975/OR由澳门大学陆金健教授课题组馈赠。
1.1.2试剂 DMEM培养基(批号:10013043)、胎牛血清(批号:08020001)、青霉素-链霉素溶液(批号:30002351)购自美国Corning公司;CCK-8试剂盒(批号:230078)购自上海毕傲图生物科技有限公司;RPMI 1640培养基(批号:8121327)、0.25%胰蛋白酶-EDTA(批号:2193232)、PBS缓冲液(批号:8120140)、BCA试剂盒(批号:VL319460)购自美国Thermo Fisher公司;RNAex Pro TRIzol试剂(批号:A2A0207)购自广州瑞真生物科技有限公司;Osimertinib(批号:1-NJL-79-1)购自加拿大Toronto Research Chemicals(trc)公司;RSL3(批号:1219810-16-8)、Erastin(批号:571203-78-6)购自上海陶素生化科技有限公司;RIPA蛋白裂解液购自上海博彩生物科技有限公司;PVDF膜(批号:R1CB59666)、ECL化学发光液(批号:2017802)购自美国Millipore公司; 兔抗TFR1抗体(批号:00026160)购自美国Proteintech公司;兔抗FPN(批号:A20180627764)、FTH(批号:A20180627766)、FTL(批号:A20180627765)抗体购自武汉云克隆科技股份有限公司;兔抗SLC7A11(批号:4000000753)、GPX4(批号:3561103009)抗体购自武汉爱博泰克生物科技有限公司;兔抗β-actin抗体(批号:18)、HRP标记的兔二抗(批号:30)购自美国Cell Signaling Technology(CST)公司。
1.1.3仪器 二氧化碳培养箱(美国Thermo Fisher公司);IX73研究级倒置荧光显微镜(日本Olympus公司);低温高速离心机(德国Eppendorf公司);电泳及电转系统(美国Bio-Rad公司);Image Quant LAS4000 曝光成像仪(美国General Electric公司);多功能酶标仪(美国Thermo Fisher公司)。
1.2 方法
1.2.1细胞培养 HLF-1细胞接种于含10%胎牛血清、1%青霉素-链霉素的DMEM培养基中,H1975细胞和H1975/OR细胞接种于含10%胎牛血清、1%青霉素-链霉素的RPMI 1640培养基中,于37 ℃、5% CO2条件下培养,细胞处于对数生长期时用于实验。
1.2.2CCK-8法检测细胞存活率 将处于对数生长期的H1975细胞和H1975/OR细胞以5×107·L-1的密度分别接种于96孔板中,每孔100 μL。培养24 h后,加入100 μL含不同浓度Osi、RSL3或Erastin的培养液,用RPMI 1640培养基稀释药液,使其终浓度分别为:Osi(0.001、0.01、0.1、1、10 μmol·L-1),RSL3(25 nmol·L-1),Erastin(2 μmol·L-1),并设置空白对照组,每组5个复孔。Osi培养72 h或RSL3、Erastin培养24 h后,吸弃培养液,另设3个空白复孔,每孔加入100 μL含10% CCK-8的无血清RPMI 1640培养基,培养1 h后,酶标仪检测波长450 nm处的吸光度值OD,相对细胞存活率/%=(实验组OD-空白孔OD)/(对照组OD-空白孔OD)×100%。
1.2.3转录组学样本处理及数据分析 将处于对数生长期的H1975细胞和H1975/OR细胞以1×109·L-1的密度分别接种于6孔板中,每孔2 mL。培养24 h后,显微镜下确定细胞生长状态良好,终止培养。吸弃培养基,加入PBS洗涤细胞2次。每孔加入500 μL TRIzol,反复吹打至细胞充分裂解,转移至耐-192 ℃低温的螺纹口冻存管后,立即于液氮中进行速冻,-80 ℃冰箱保存。
提取H1975和H1975/OR细胞的总RNA并进行质量检测,质检合格后进行mRNA纯化、片段化及双链cDNA的合成与纯化。然后通过末端修复、接头连接及PCR扩增等步骤,完成样本文库构建并上机进行测序。测序平台采用高通量Illumina Hiseq 4000测序仪,产出原始数据并进行预处理,去除接头和低质量reads,与参考基因组进行比对及统计,对基因和转录本进行表达丰度分析,根据FPKM值筛选获得差异基因并对其表达谱进行分析,对差异基因进行GO功能富集性分析和KEGG通路富集性分析。样本处理、上机测序及生物信息分析由杭州联川生物技术股份有限公司完成。
1.2.4Western blot检测蛋白表达 将处于对数生长期的HLF-1细胞、H1975细胞和H1975/OR细胞以1×109·L-1的密度分别接种于6孔板中,每孔2 mL。培养24 h后,显微镜下确定细胞生长状态良好,终止培养。吸弃培养基,加入PBS洗涤细胞2次。加入RIPA并于冰上裂解细胞30 min,刮取收集于1.5 mL EP管中超声15 s,离心获得总蛋白。进行BCA蛋白定量后,加入上样缓冲液,于干式恒温器100 ℃加热变性10 min。10% SDS-PAGE电泳分离后,电转至PVDF膜上,5%脱脂牛奶室温封闭1 h,加入一抗TFR1、FPN、SLC7A11、FTL、FTH、GPX4、β-actin,4 ℃孵育过夜,二抗室温孵育1 h,显影。采用ImageJ软件进行灰度扫描分析结果。

2 结果
2.1 H1975细胞和H1975/OR细胞对Osi的敏感性差异为了验证H1975细胞和H1975/OR细胞对于Osi的敏感性存在差异,采用CCK-8法考察不同浓度Osi对两种细胞存活率的影响。结果如Fig 1所示,随着Osi浓度的增加,H1975细胞的存活率明显下降,显微镜视野下也可明显观察到死细胞数目的增多,Osi对其的IC50为0.06 μmol·L-1。与之相比,H1975/OR细胞在显微镜视野下状态良好,其存活率只在Osi浓度高于1 μmol·L-1时才出现了较为显著的下降趋势,IC50为4.23 μmol·L-1,说明H1975细胞对Osi的敏感性远强于获得性耐药的H1975/OR细胞。

Fig 1 Effect of Osi on cell viability of H1975 cells and
2.2 转录组学发现H1975细胞和H1975/OR细胞的铁死亡通路存在差异为进一步探究H1975/OR细胞对于Osi可能存在的耐药机制,采用转录组学技术对两种细胞的基因表达差异进行了分析比较,以差异倍数FC≥2或FC≤0.5为变化阈值,P值<0.05作为筛选差异基因的标准。结果如Fig 2所示,H1975/OR细胞与H1975细胞相比,其中71个差异基因上调,48个差异基因下调。
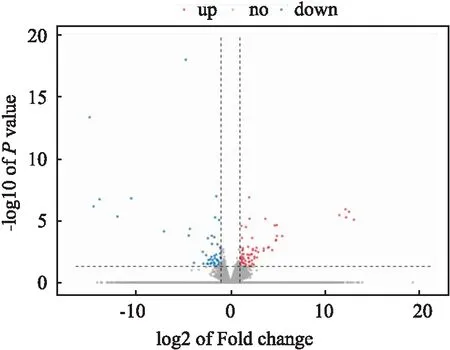
Fig 2 Volcano diagram of differential gene numbers between H1975 and H1975/OR cells
对差异基因进行GO富集分析,主要包括生物学过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)3类,结果如Fig 3所示。将GO富集分析结果绘制为气泡图,气泡的颜色和大小分别表示每一项的P值大小和该项包含的差异基因数,如Fig 4所示。其中,生物学过程的富集结果显示,H1975细胞和H1975/OR细胞的差异基因主要富集在DNA为模板的转录调控、多细胞组织发育、RNA聚合酶Ⅱ的转录调控、以及胞内蛋白代谢等生物过程。细胞组分的富集结果显示,差异基因主要分布在细胞核、细胞膜、细胞质、胞质溶胶和核质等细胞部位。分子功能的富集结果显示,差异基因主要是通过影响蛋白、金属离子、核酸等分子的结合以及转移酶和水解酶等的功能而发挥作用。

Fig 3 GO functional enrichment of differential genes between H1975 and H1975/OR cells

Fig 4 Bubble diagram of GO functional enrichment of differential genes between H1975 and H1975/OR cells
对差异表达基因进行KEGG通路富集分析,将结果绘制为气泡图,气泡的颜色和大小分别表示每种信号通路的P值大小和该条信号通路包含的差异基因数,如Fig 5所示。结果显示,差异基因主要参与了甲状腺激素合成、铁死亡、胆固醇代谢、单纯疱疹病毒1感染、长寿调节途径、AMPK等信号通路。其中,铁死亡通路的富集程度和差异基因数均较高,提示铁死亡信号通路的改变可能在Osi获得性耐药中扮演着重要角色。
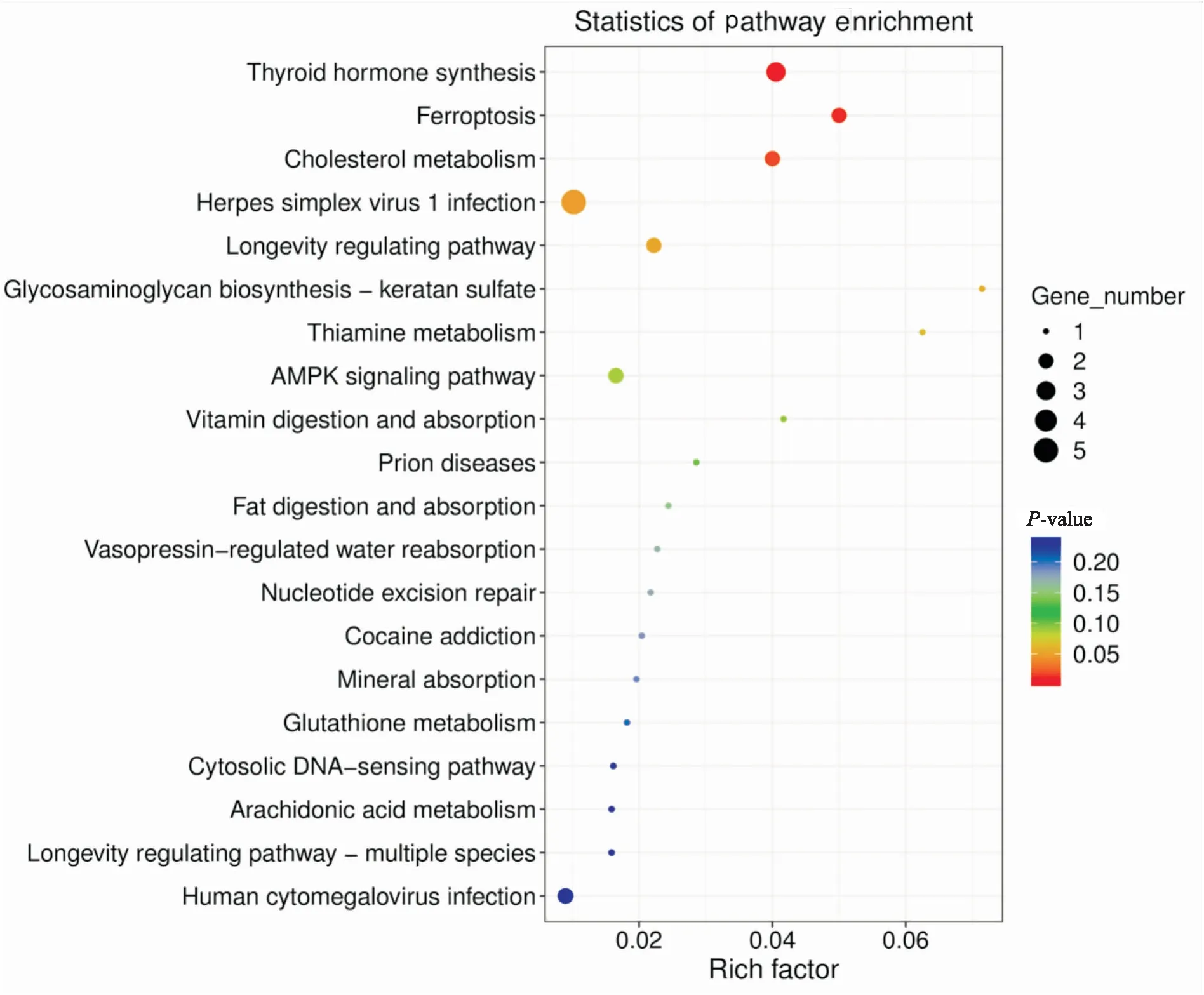
Fig 5 Bubble diagram of KEGG enrichment of differential genes between H1975 and H1975/OR cells
2.3 HLF-1、H1975细胞和H1975/OR细胞的铁死亡相关蛋白表达存在差异基于转录组学所获得的结果,为进一步验证铁死亡通路在Osi敏感与耐药肺癌细胞上的差异,采用Western blot技术检测了HLF-1、H1975和H1975/OR细胞部分铁死亡通路相关的蛋白表达差异。如Fig 6所示,其中,除TFR1以外的蛋白在Osi耐药H1975/OR细胞上相比H1975细胞均具有显著的表达水平升高。同时,除FTH以外的蛋白在肺癌细胞H1975和H1975/OR细胞上都显示出了比人肺成纤维细胞HLF-1更高的表达水平。

Fig 6 Ferroptosis pathway proteins expression level of HLF-1, H1975 and H1975/OR cells n=3)
2.4 铁死亡诱导剂对H1975细胞和H1975/OR细胞存活率的影响为进一步证实铁死亡通路在Osi获得性耐药中的作用,采用CCK-8法考察两种铁死亡的诱导剂RSL3和Erastin对H1975细胞和H1975/OR细胞的存活率影响。如Fig 7所示,与对照组相比,RSL3在25 nmol·L-1时能明显降低H1975/OR细胞的存活率,而对H1975细胞则只有略微的影响。同时,Erastin在2 μmol·L-1时也能明显降低H1975/OR细胞的存活率,而对H1975细胞则无影响,表明Osi耐药的H1975/OR细胞对于铁死亡的诱导剂具有更高的敏感性。
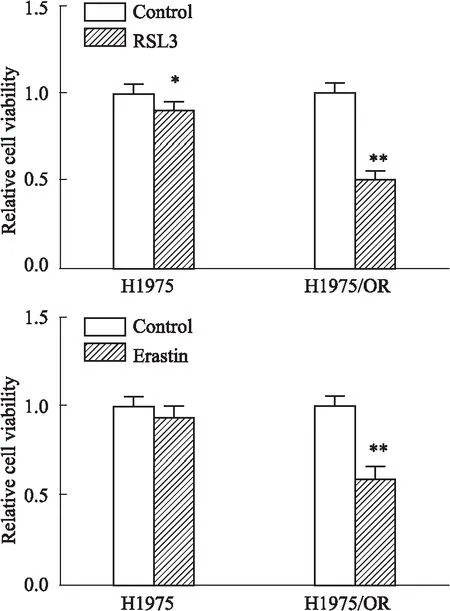
Fig 7 Effect of RSL3 and Erastin on cell viability of H1975 cells and H1975/OR cells n=5)
3 讨论
肺癌作为一种高发病率与高死亡率的恶性肿瘤,始终是影响人类健康与生存的一大难题,而现有的治疗方式如化疗和放疗等均具有较严重的不良反应。近年来,靶向治疗不仅具有较低的毒副作用,同时也显示出了更好的疗效,在改善肺癌病人的生存情况方面取得了巨大突破。以吉非替尼、阿法替尼等为代表的第一、二代EGFR-TKIs显著延长了许多患者的生存期,已作为具有EGFR敏感型突变NSCLC患者的一线用药[9]。然而,多数患者在接受10-14个月治疗后均会显示出耐药性,其中50%以上是由于EGFR T790M突变所导致[10]。Osi作为第三代EGFR-TKI类靶向治疗药物,在对于具有EGFR T790M突变的非小细胞肺癌患者中具有显著疗效,同时,较少的不良反应和对中枢神经系统肿瘤转移的治疗能力也使其在临床得到广泛使用[4]。然而,长期使用后产生的耐药性极大地限制了Osi在临床的进一步应用,不同于前两代EGFR-TKI较为普遍的T790M突变耐药机制,目前对Osi的耐药机制还存在着众多说法。因此,探究Osi耐药的机制并找到克服耐药的方法是临床研究急待解决的问题之一[11]。
随着高通量测序技术发展成熟,生命科学对遗传信息的研究已进入了一个新的阶段。RNA-seq作为研究转录组学的代表性方法,现在已广泛应用于对生命体各个层面的机制研究[6]。目前,RNA-seq的主要研究步骤包括:提取RNA并将其逆转录为cDNA,对cDNA进行末端修复、接头连接等步骤并扩增获得cDNA文库,对得到的cDNA文库进行高通量测序,并与参考基因组进行比对分析获得差异基因,以及差异基因的后续分析及可视化等步骤[7]。研究发现,通过对非小细胞肺癌H1975细胞及其Osi获得性耐药H1975/OR细胞的转录组学进行分析,证实二者在基因表达水平差异较大。进一步分析GO功能富集结果,二者在生物学过程、细胞组分、分子功能等方面均有着较大差异,而KEGG通路富集揭示了这些差异基因存在的信号通路,如甲状腺激素合成、铁死亡、胆固醇代谢、单纯疱疹病毒1感染、长寿调节途径、AMPK等信号通路。其中,铁死亡相关信号通路的差异尤为明显,可能预示着铁死亡在Osi耐药的形成中扮演着必要的角色。
铁死亡是由脂质过氧化物的蓄积和随后的质膜破裂引起的铁依赖性的调节性细胞死亡,在形态、生化与基因调控上均不同于凋亡与坏死[12]。铁死亡可由外源性或内源性途径诱导,外源性途径是通过抑制细胞膜转运蛋白,如胱氨酸/谷氨酸转运蛋白(又称system Xc-)或激活转铁蛋白等启动,内源性途径是通过阻断胞内抗氧化酶(如GPX4)激活[13]。目前铁死亡被认为是天然的肿瘤抑制机制,在许多癌症疗法,如放疗、免疫疗法和部分化疗中发挥着重要作用,已发现部分癌症相关通路与铁死亡的发生发展密切相关[14]。铁死亡诱导剂Erastin和RSL3可对工程性RAS突变的肿瘤细胞选择性致死,抑制RAS或其下游信号分子可逆转Erastin和RSL3的作用[15]。NRF2信号通路可通过激活与铁代谢、GSH代谢以及ROS解毒酶相关基因抵御铁死亡过程中的氧化损伤[16]。在上皮-间质-转化(EMT)的过程中,钙粘蛋白1介导的细胞间接触可以保护细胞免遭铁死亡,而SNAIL、TWIST1或ZEB1表达增加可恢复对铁死亡的敏感性[17]。目前已发现多种获批准上市的药物(如索拉非尼、青蒿素和他汀类)、电离辐射和细胞因子(如TGF-β1和IFN-γ)等可诱导铁死亡,从而抑制肿瘤生长[11]。但迄今为止,关于铁死亡在肿瘤耐药中发挥的作用还较少被研究。
铁死亡相关的信号通路包含多种蛋白的调控作用,其中转铁蛋白受体1(transferrin receptor 1,TFR1)介导的铁摄取可促进铁死亡,而铁转运蛋白(ferroportin,FPN)介导的铁输出则可抑制铁死亡;组成铁蛋白(ferritin)的FTH和FTL可介导胞内铁的存储,其自噬降解会通过增加胞质内铁的蓄积促进铁死亡的发生;SLC7A11所属的system xc-负责将半胱氨酸导入细胞,随后由GCL介导产生谷胱甘肽;GPX4可以直接将过氧化氢磷脂还原为羟基磷脂,从而作为癌细胞铁死亡的中枢抑制因子[18]。基于转录组学的结果,通过比较两株细胞以及正常细胞HLF-1的铁死亡相关蛋白表达情况,发现负责铁转运的蛋白TFR1、FPN,铁存储相关的蛋白FTL、FTH,以及介导清除过氧化脂质相关的蛋白SLC7A11、GPX4等均有不同程度的变化,进一步证实了铁死亡信号通路的改变与肿瘤的发生发展以及耐药的产生有着密不可分的关系。对于铁死亡的诱导剂RSL3和Erastin,H1975/OR细胞均显示出了比H1975细胞更强的敏感性,说明诱导耐药细胞铁死亡增强可能成为解决Osi耐药的途径之一。
综上所述,本研究发现了人非小细胞肺癌细胞H1975与其Osi耐药细胞H1975/OR在多个细胞组分与信号通路中基因表达的差异,其中铁死亡通路的变化显著,并证实Osi耐药细胞对铁死亡诱导剂更加敏感。本研究为开展克服Osi耐药的相关研究提供思路,并为诱导铁死亡克服Osi耐药提供实验依据。
(致谢:本实验在中山大学药学院临床药理研究所完成,衷心感谢提供指导与帮助的各位老师及同学。)