Foxo6在高糖高脂应激诱导血管内皮细胞胰岛素抵抗中的表达及与NF-κB通路的相互作用
2022-04-07涂以思熊小伟牛艾琳尹婷婷张雅楠黄起壬
夏 敏, 涂以思, 熊小伟, 牛艾琳, 尹婷婷, 张雅楠, 黄起壬
(1. 江西省基础药理学重点实验室,江西 南昌 330006;南昌大学 2.药学院药理教研室、3.第三临床医学院,江西 南昌 330006)
近年来,在世界大范围的慢性病的排名中,糖尿病的死亡率已升到第二,患者常由于心血管并发症而死亡,给社会、家庭造成沉重负担[1-2]。糖尿病有1型和2型之分,因为胰岛β细胞天生胰岛素分泌不足引起了1型糖尿病,而2型糖尿病(type 2 diabetes mellitus,T2DM)以慢性高血糖和胰岛素抵抗(insulin resistance,IR)为基本特点[3],其发病率呈年轻化趋势[4],大多数研究认为IR先于T2DM的发生,因此对于IR的研究尤为重要。
叉头框(forkhead box,Fox)超级家族是继homeodomain、bHLH和bZIP这3个家族之后的第四大转录因子超级家族,叉头框o(forkhead box o,Foxo)是Fox超级家族的成员,其结构特征是存在叉头域,这在Fox家族的所有成员中都普遍存在[5]。其中,哺乳动物中的o家族(叉头框/盒)由Foxo1(FKHR)、Foxo3(FKHRL1)、Foxo4(AFX)和Foxo6组成。Foxos在多种不同的细胞中发挥着重要作用,不仅参与了众多细胞的生理过程,而且与人类的多种疾病包括癌症、糖尿病、不孕症、神经退行性病变和免疫系统功能障碍等有关[6]。例如:肝脏中,胰岛素通过抑制Foxos使葡萄糖的产生减少,同时使葡萄糖的利用率增加,而肝脏IR会激活Foxos,引起高血糖、高甘油三酯血症,并且,Foxos可以诱导肝组织产生IL-1β等炎性细胞因子,因此其在促进肝脏IR和炎症中发挥着重要作用[7]。据报道Foxos家族成员通过抑制PI3K/AKT信号下游通路与IR有关。但目前关于Foxos与内皮细胞IR的联系尚未见报道,各亚型在HG/HF应激诱导内皮细胞IR中的表达如何以及具体哪一个亚型发挥了关键作用也不清楚,因此本文探讨Foxos在HG/HF应激诱导内皮细胞IR中的表达改变并研究其具体的作用机制。
血管内皮细胞损伤、IR和炎症标志物的增加是T2DM发生和发展的核心因素[8],但目前关于血管内皮细胞IR发生的分子机制还不十分明确。因此,阐明其发生的分子机制对于发现治疗T2DM药物的作用靶点,改善患者的生活质量具有重要意义。慢性炎症反应在IR的发病机制中扮演着重要作用。NF-κB是典型的炎症信号通路之一,参与了肥胖,且和糖尿病发病有关。其信号通路的激活不仅可以实现对下游基因的调控,而且与炎症密切相关,并且可以从多种途径诱发IR,在IR的形成中起着重要作用[9]。NF -κBp65或p65(也称为RELA),是核转录因子,它可以增强巨噬细胞促炎细胞因子的产生,加重高脂饮食诱导的慢性炎症和巨噬细胞IR[10];而抑制RELA核转运蛋白的表达或抑制RELA核转运可增加胰岛素刺激的葡萄糖转运和消耗,从而改善巨噬细胞IR。那HG/HF诱导的内皮细胞IR是否可以通过炎症这条通路发挥作用,以及沉默Foxo6基因后是否可以通过此通路逆转IR?以上就是我们所关注的问题。
1 材料
1.1 细胞株及血清培养基实验用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)株购自美国ATCC( Catalog No: CRL1730) ;胎牛血清购自天津TBD公司;DMEM培养基购自北京Solarbio公司。
1.2 抗体和试剂NO检测试剂盒(20190722)、人内皮素-1(ET-1)酶联免疫检测试剂盒(2H-KMLJh311095)均购自南京建成;Foxo6兔多克隆抗体(19122-1-AP)、NF-kBp65兔多克隆抗体(96033)、GAPDH鼠多克隆抗体(Ls203561)均购自武汉三鹰;AKT-pS473兔单克隆抗体(#9271S)、AKT兔单克隆抗体(#9272S)均购自Abcam;逆转录试剂盒(#22106-01)购自Tolobio;SYBR Green(FP171206)购自天根;荧光素酶报告基因检测试剂盒购自普洛麦格,肿瘤坏死因子α(tumor necrosis factor,TNF-α)ELISA试剂盒(2H-KMLJh311776)购自武汉博士德;白细胞介素-6(interleukin-6,IL-6)试剂盒(2H-KMLJ31201mm)购自南京卡米洛;ChIP试剂盒(#25268)购自Cell Signaling Technology;引物购自南昌臻善生物科技公司,小干扰RNA(small interfering RNA,siRNA)购自锐博生物有限公司,过表达质粒RELA(49607-11)购自上海吉凯基因有限公司。
1.3 主要仪器680型酶标仪(BIO-RAD,美国);SmartSpec Plus核酸蛋白分析仪(BIO-RAD,美国);PCR仪(BIO-RAD,美国);荧光倒置显微镜(Olympus,日本);流式细胞仪(BECKMAN COULTER,美国)。
2 方法
2.1Foxos在HG/HF处理的HUVECs中的差异性表达将HUVECs均匀接种于培养皿,随机分为两组,即Ctrl组和高糖高脂(High glucose and High fat,HG/HF)组,HG/HF组用22 mmol的葡萄糖和0.25 mmol的棕榈酸(PA)处理细胞24 h后,两组均用胰岛素(100 nmol·L-1)处理30 min,去除细胞上清液,采用Trizol法提取各组细胞RNA,按照Tolobio试剂盒将RNA逆转录成cDNA,通过qRT-PCR检测Foxo1、Foxo3、Foxo4、Foxo6基因的表达,PCR扩增所用引物由南昌臻善生物科技公司合成,Foxo1上游引物:5′-TTGCTGACTTCTGACTCTCCTC-3′,下游引物:5′-ATGTCCAGCGTGGGTATGG-3′;Foxo3上游引物:5′-GAACTCCCTACGCCAGTCTC-3′,下游引物:5′-GCAGCAAAGGACATCATCG-3′;Foxo4上游引物:5′-GCTCCGACTCTTCTGTTGCT-3′,下游引物:5′-AGGCATTCTGTCTTGGCTTG-3′;Foxo6上游引物:5′-GCGGAAAACTCACACCTACC-3′,下游引物:5′-CGGTTGAAGAGAGGGACTGA-3′。PCR扩增体系为20 μL,其中cDNA为2 μL,上下游引物各0.8 μL,PCR循环数为39,95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火延伸32 s。
2.2Foxo6 siRNAs沉默效率的筛选实验将HUVECs均匀接种于六孔板,随机分为5组,即control组、control+NC组、control+Foxo6siRNA1组、control+Foxo6siRNA2组、control+Foxo6siRNA3组,除Ctrl组外,其余组分别转染阴性对照NC、Foxo6siRNA1、Foxo6siRNA2、Foxo6siRNA3 24 h后,采用Trizol法提取各组细胞RNA,按照Tolobio试剂盒将各组RNA逆转录成cDNA,通过qRT-PCR进行检测。也可以用裂解液裂解各组细胞,Western blot法检测各组细胞的Foxo6蛋白表达,Foxo6的分子量为58,从而筛选出沉默Foxo6最显著的siRNA。
2.3Foxo6 siRNA逆转IR实验将HUVECs均匀接种于培养皿,随机分为4组,即control组、HG/HF组、HG/HF+NC组、HG/HF+Foxo6siRNA3组,除control组外,其余组分别加HG/HF处理细胞24 h,然后HG/HF+NC组转染阴性对照,HG/HF+Foxo6siRNA3组转染siRNA3 24 h,收集细胞上清液检测NO和ET-1,收集细胞通过Western blot检测AKT-pS473的表达。
将SD雄性大鼠用10%水合氯醛进行麻醉,沿大鼠的胸部和腹部纵向切开,剥离大鼠的主动脉,用PBS洗干净,将其移入培养瓶中,放入孵箱孵育3~5 h,然后加入完全培养基(含10%FBS、肝素钠和生长因子ECGS),待其生长状态良好,传代置培养皿。将原代培养的大鼠主动脉内皮细胞(RAECs)随机分为4组,即control组、HG/HF组、HG/HF+NC组、HG/HF+Foxo6siRNA3组,收集细胞上清液检测NO、ET-1,收集细胞通过Western blot检测AKT-pS473的表达。
2.4 免疫共沉淀法(CoIP)检测Foxo6与NF-κBp65相互作用将HUVECs均匀接种于培养皿,按照总蛋白提取方法提取4组处理好的细胞蛋白,每个组又分为加入相应抗体的IP组、阴性对照IgG组、未经任何处理的input组,除input组外,IP组和IgG组分别加入1 μL NF-κBp65的抗体混悬过夜;次日IP组和IgG组再分别加入25 μL的琼脂糖珠使蛋白沉淀,4 ℃混悬仪混匀1~3 h或者过夜;4 ℃ 2 500 r·min-1离心5 min,留沉淀,加入上样缓冲液,上样缓冲液的量根据加入珠子的量决定,涡旋混匀,煮沸10 min,最后加入适量上样缓冲液混匀,-20 ℃保存备用,通过Western blot检测Foxo6的蛋白表达。
2.5 免疫荧光检测NF-κBp65亚细胞定位将细胞均匀接种于24孔板中,经前期处理后,加4%多聚甲醛固定细胞,随后加入TritonX-100室温通透3 min,洗净后加入5%BSA室温封闭2 h,然后加入由5%BSA新鲜配制的NF-κBp65的一抗(比例为1:100)4 ℃孵育过夜,次日加荧光二抗(1:100)室温孵育2 h,然后DAPI染核,最后荧光显微镜下观察。
2.6 染色质免疫共沉淀(ChIP)检测NF-κBp65与其靶基因启动子结合活性
2.6.1细胞交联与样品制备 根据实验要求及分组,将细胞培养于培养皿,加入37%的甲醛溶液固定细胞,加入10×甘氨酸溶液终止上述固定反应,加入含PIC的1X PBS刮下细胞,收集细胞离心,去除上清。
2.6.2细胞核处理和染色质剪切 分别将离心完的细胞用1 mL 1×缓冲液A+DTT+PIC重悬,冰上静置,3 000 r·min-1,离心5 min沉淀细胞核。将上清弃去,用缓冲液B+DTT 1 mL重悬细胞核沉淀,离心去除上清。用缓冲液B+DTT 100 μL继续重悬,加微球菌核酸酶,消化DNA为150~900 bp的片段;加0.5 mol·L-1 EDTA使消化停止,离心收集细胞核沉淀,将其重悬于1×ChIP缓冲液+PIC中,冰上孵育,对细胞核样品进行超声破碎,离心,转移上清,每管取2 μL测定染色质浓度,剩余样品保存于-80 ℃进行后续实验。
2.6.3染色质免疫沉淀 每管加等量的交联染色质样品,每个沉淀反应需要用1×ChIP缓冲液补齐到500 μL,并补加适量的200×PIC,将稀释后的ChIP染色质,每个样品吸取10 μL作为Input组,保存于-20 ℃;每个样品管加3 μL的Foxo6抗体,每个阴性对照管加1.5 μL的IgG抗体,每个阳性对照管加10 μL H3抗体,封严各反应管,转子上孵育4 h以上或过夜。取30 μL ChIP级蛋白G琼脂糖微珠加入到每个免疫沉淀反应中,转子上孵育2 h,沉淀蛋白G琼脂糖微球,除上清;分别加低盐漂洗液和高盐漂洗液洗涤,吸除上清。
2.6.4将染色体从抗体/蛋白G微珠上洗脱并解交联 每组对应的Input组分别加入150 μL 1×ChIP洗脱缓冲液,室温放置;其它每份ChIP免疫沉淀样品中分别加入150 μL 1×ChIP洗脱缓冲液,进行洗脱;沉淀蛋白G琼脂糖微球,除上清;把每个样品管中洗脱下来的染色质上清转移到一个新的离心管中,并做好标记。在所有管中,包括Input组管,都加入6 μL 5 mol·L-1 NaCl和2 μL蛋白酶K,65 ℃孵育2 h。
2.6.5离心柱纯化DNA 将750 μL DNA结合缓冲液加到DNA样品中混匀,将每组样品450 μL转移到离心柱中,14 000 r·min-1离心,弃废液,加漂洗缓冲液,离心,加50 μL DNA洗脱缓冲液,离心。
2.6.6用PCR定量进行ChIP富集效率的分析 琼脂糖凝胶电泳对IL-6和TNF-α进行定性分析,进行ChIP富集效率的PCR定量分析。
2.7 荧光素酶报告基因检测NF-κB转录活性构建编码RELA启动子的荧光素酶报告基因质粒,用0.5 g空载体或RELA质粒分别转染control组和HG/HF组的HUVECs细胞于24孔板,实验分为4组,即control+NC组、control+RELA组、HG/HF+NC组、HG/HF+RELA组,根据24孔板的用量,按照说明书操作,根据公式:萤火虫/海肾荧光素酶进行计算,并以control+NC组的比值为单位1,既可以得到不同处理组的相对荧光素酶活性。
2.8 ELISA法检测NF-κBp65靶基因的表达按照ELISA检测试剂盒说明书对IL-6、TNF-α进行检测,绘制标准曲线并计算各组的含量。

3 结果
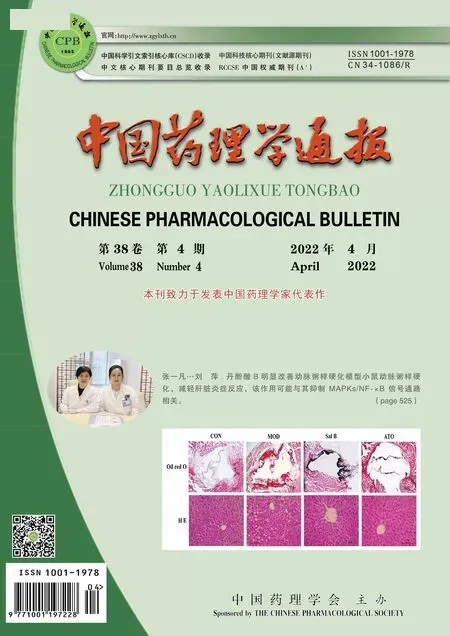
3.1 IR模型的确立HUVECs IR指标常用培养基上清NO、ET-1水平以及Western blot法中AKT-pS473的表达水平表示,HG/HF组与control组比较,NO水平降低(P<0.05),而ET-1水平升高(P<0.05),AKT-pS473的表达水平明显降低(P<0.05),表明IR模型的成功建立(Fig 1)。
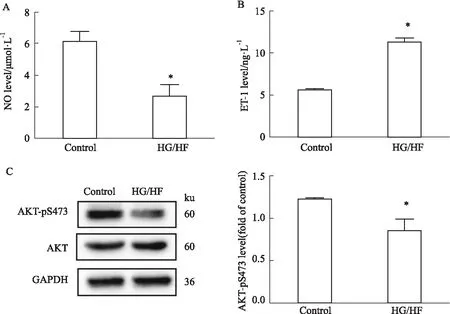
Fig 1 NO, ET-1 and AKT-pS473 levels of various treatment in cultured HUVECs
3.2Foxos在HG/HF应激诱导IR中的表达变化为了验证Foxos在HG/HF诱导的内皮细胞IR中是否发生了变化,采用qRT-PCR和Western blot检测其表达水平,qRT-PCR的结果显示Foxo6在HG/HF组中变化最明显,并且表达量明显升高(P<0.01),Western blot的结果表明Foxo6在HG/HF组中的表达量也是明显升高的(P<0.05)(Fig 2)。
3.3 沉默Foxo6 siRNA的筛选3.2中结果证明Foxo6在HG/HF组中变化最明显并且表达量升高,说明Foxo6在HG/HF应激诱导IR中可能发挥了重要作用。为了进一步阐明Foxo6与IR间究竟是一种伴随现象还是一种因果关系,通过构建Foxo6 siRNA,观察Foxo6水平下调是否能逆转HG/HF应激所诱导的IR效应。为此,针对Foxo6基因设计了3个不同靶位的siRNA序列并构建成质粒,目的是筛选出沉默效率最高的siRNA,用于后续的研究。qRT-PCR和Western blot均显示,Foxo6 siRNA3序列沉默效果最明显(P<0.05),因此选取Foxo6 siRNA3序列用来进行后续研究(Fig 3)。

Fig 3 Foxo6 mRNA and protein expression levels of various treatment in cultured HUVECs n=3)
3.4 沉默Foxo6对HG/HF应激诱导IR的影响实验分为control、HG/HF、HG/HF+NC、HG/HF+Foxo6siRNA3组。在HUVECs实验中,与HG/HF组相比,沉默Foxo6后,NO水平明显升高(P<0.01),ET-1水平降低(P<0.05),AKT-pS473的表达水平明显升高(P<0.05),说明沉默Foxo6可明显逆转HG/HF诱导的血管内皮细胞IR(A-C);在大鼠原代主动脉内皮细胞(RAECs)实验中也得到了类似的结果(D-F)(Fig 4)。

Fig 4 NO, ET-1 and AKT-pS473 levels of various treatment in cultured HUVECs and n=3)
3.5Foxo6沉默对HG/HF诱导的Foxo6与NF-κBp65相互作用的影响研究表明,IR也是一种慢性炎症反应。NF-κB是炎症反应中最为关键的转录因子。同为核转录因子的Foxo6是否与NF-κB通路产生相互作用从而调控HG/HF诱导的IR。为此,探究了Foxo6对NF-κB介导的炎症通路的影响。CoIP结果显示,与control组相比,HG/HF组和HG/HF+NC组中Foxo6的表达水平明显升高(P<0.01),说明在HG/HF应激下Foxo6与NF-κBp65发生了相互作用促进IR;转染Foxo6 siRNA3之后,Foxo6的表达水平降低(P<0.05),表明沉默Foxo6后使其相互作用减弱(Fig 5)。
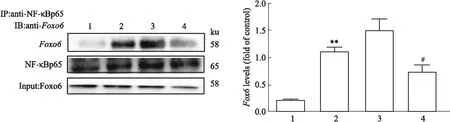
Fig 5 Interaction between Foxo6 and NF-κBp65 of various treatment in cultured HUVECs n=3)
3.6Foxo6沉默对HG/HF诱导的NF-κBp65亚细胞定位的影响免疫荧光结果显示,control组NF-κBp65主要位于胞质中,而HG/HF组NF-κBp65定位在核内,说明NF-κBp65在受到HG/HF应激后发生了核转移;沉默Foxo6基因后,NF-κBp65主要定位于核外,揭示沉默Foxo6基因可抑制NF-κBp65的核移位(A);此外,通过提取细胞核蛋白和细胞质蛋白,分别进行Western blot检测,其结果与免疫荧光结果相似(B、C)(Fig 6)。
Fig 6 Expression and location of Foxo6 in nucleus and cytoplasm after Foxo6 was silenced in various treatment in cultured HUVECs n=3)
3.7Foxo6增强NF-κBp65与靶基因启动子的结合活性IL-6、TNF-α是NF-κB的下游靶标分子,琼脂糖凝胶电泳结果表明HG/HF和HG/HF+NC组中IL-6和TNF-α基因表达增加(P<0.01,P<0.05),沉默Foxo6基因后IL-6和TNF-α基因表达降低(P<0.05),qRT-PCR结果表明Foxo6增强NF-κBp65与IL-6和TNF-α的富集效率(Fig 7)。
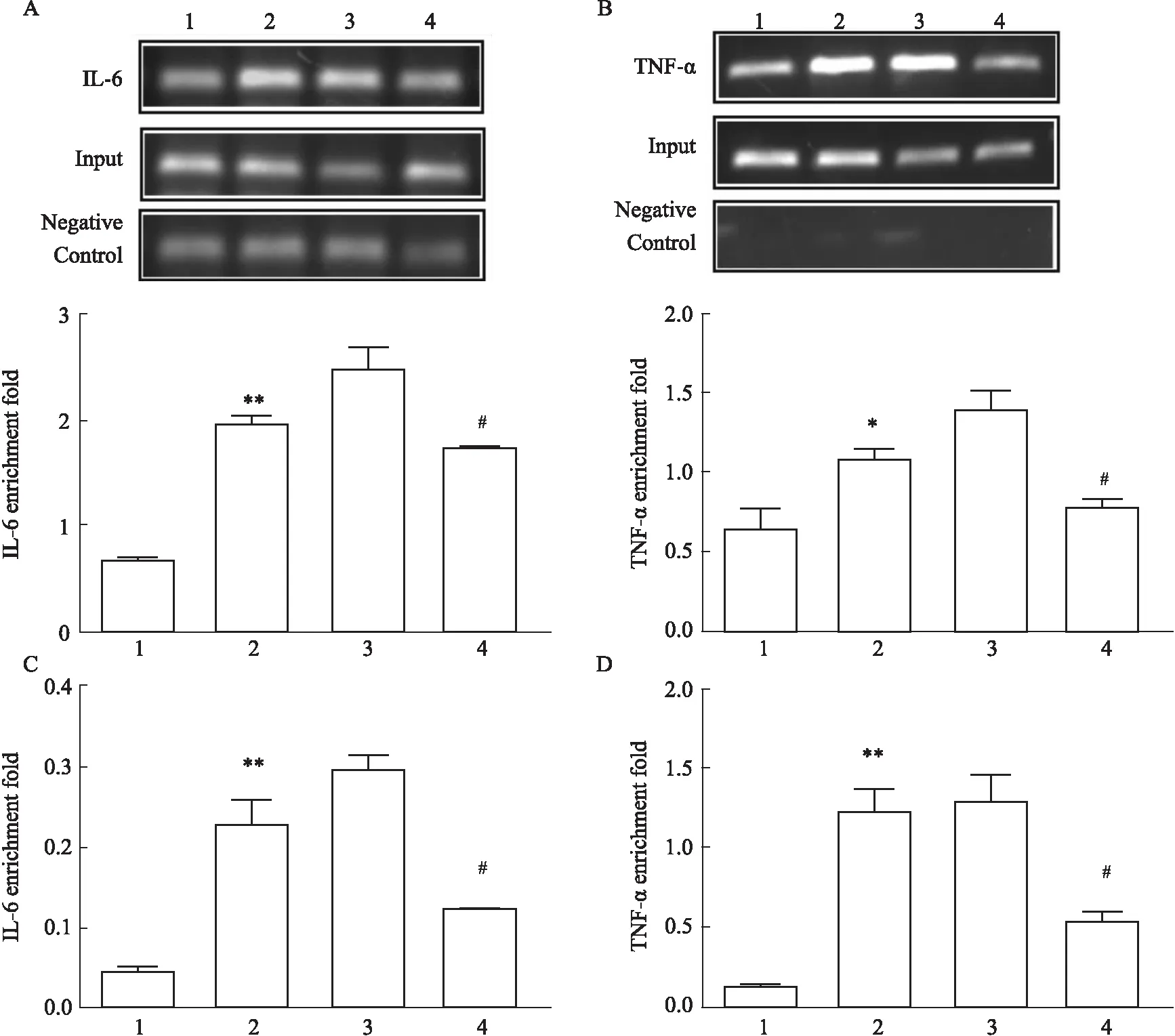
Fig 7 Silencing Foxo6 inhibited binding activity of NF-κBp65 to its target gene promoter in various treatment in cultured HUVECs n=3)
3.8Foxo6增强NF-κB转录活性以及促进NF-κBp65靶基因的表达实验分为4组,分别是control+NC组,control+RELA过表达质粒组,HG/HF+NC组、HG/HF+RELA过表达质粒组。荧光素酶报告基因结果显示,与control+RELA或HG/HF+NC组相比,HG/HF+RELA组中的NF-κBp65的转录活性明显增强(P<0.01),表明Foxo6影响NF-κBp65的转录活性(A);IL-6、TNF-α是NF-κB的下游靶标分子,炎症状态下IL-6和TNF-α的表达活性增强。ELISA结果显示,与Ctrl组相比,HG/HF组中IL-6和TNF-α的表达增加(P<0.01),表明Foxo6促进NF-κBp65下游靶基因的表达;沉默Foxo6后IL-6和TNF-α的表达降低(P<0.05,P<0.01),表明Foxo6沉默后可能下调IL-6和TNF-α的表达(B、C)(Fig 8)。
Foxos是一类转录因子家族,重要作用包括其可以激活或抑制基因转录、调节下游靶基因的表达,异常的Foxos功能与神经退行性疾病、癌症和糖尿病[14]等疾病有关,研究表明Foxos与IR有关[15],但其在内皮细胞IR中的作用如何以及具体哪一个亚型起了关键作用尚不明确,而且Foxos在不同的细胞和不同的状态下发挥的作用也各不相同。先前的研究认为,Foxo6只在大脑中表达,因此对Foxo6的研究相对较少,后来Foxo6也被证明在多个组织和器官中表达,但Foxo6在内皮细胞IR中的表达和作用以及其具体的作用机制目前也无相关报道。尤其是近几年来,有很多关于内皮细胞IR的研究,但具体作用机制还不完全清楚[16]。在实验中用HG/HF处理HUVECs 24 h成功构建IR模型,观察Foxos在其中的表达和变化,结果发现Foxo6基因变化最显著,并且在HG/HF组中表达量升高,因此,选择Foxo6这一个变化最明显的亚型来进行后续研究。随后,构建了沉默Foxo6的siRNA,并从中筛选出沉默效果最明显的一条siRNA3链进行后续实验,通过检测NO、ET-1、AKT-pS473等指标证明沉默Foxo6可以逆转IR。接下来进一步探讨Foxo6促进IR的具体作用机制。造成IR的原因有多种,一是微血管损伤,二是胰岛素信号转导异常、三是线粒体功能障碍、四是炎症,其中炎症是一个重要方面,炎症信号已经成为IR的驱动因素,同时大量基础研究表明血管内皮的IR在心脑血管疾病的进展中起着重要作用,并与炎症反应之间相互影响、相互促进[17]。NF-κB作为经典的炎症通路,在调节IR中起着重要作用,但NF-κB在内皮细胞IR中起着什么作用,其是否和Foxo6存在相互作用呢?因此,又对Foxo6是否可以通过炎症这条通路促进IR进行了探索?通过研究Foxo6是否与NF-κBp65相互作用以及Foxo6是否影响NF-κB的转录活性以及与其下游靶基因的表达,从而阐明Foxo6促进IR的具体作用机制。
4 讨论
IR与T2DM密切相关,并加速着T2DM的进展,同时血管功能障碍也诱发了心脑血管疾病[11]。血管IR表现为血管内皮功能障碍,其原因主要是由于血管舒张异常所导致[12],血管内皮功能障碍不仅是血管疾病的最初阶段,还是代谢性疾病的预测因子[13],此与机体长期高水平的血糖浓度和炎症状态密不可分,IR型的糖尿病患者常伴随高血糖和高血脂,糖和脂又是我们日常生活中所必需的营养物质,摄入过多对人类的健康产生极大危害。近几年来,有很多关于内皮细胞IR的研究,但具体的机制还不完全清楚。对于前期的研究工作已经证明HG/HF可以诱导内皮细胞IR,因此,弄清内皮细胞IR的作用机制对防治包括糖尿病血管并发症和动脉粥样硬化等疾病有重要意义。
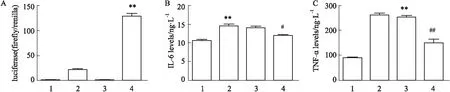
Fig 8 Effects of Foxo6 silencing on NF-κB transcriptional activity (A) and expression of target genes including IL-6 (B) and TNF-ɑ (C)
综上所述,Foxo6在HG/HF应激诱导内皮细胞IR中的表达最显著,并且表达量升高,其作用机制可能是Foxo6与NF-κBp65相互作用从而促进IR,Foxo6基因有可能作为T2DM治疗的新靶点,同时为IR的治疗提供一定的理论依据。但目前只是在细胞水平证明了Foxo6低表达可以逆转IR,其在动物水平是否有同样的结果还需要进一步验证。